Forklaring: hvad er en isotop?
Hvis du nogensinde har studeret en periodisk tabel over elementerne (se nedenfor), er du sikkert allerede klar over, at denne tabel afslører meget om de kemiske egenskaber af de atomer, der udgør vores verden.
men du er måske ikke klar over, at hver firkant i det periodiske system faktisk repræsenterer en familie af isotoper — atomer, der har samme navn og kemiske egenskaber, men har forskellige masser.
for at forstå, hvad isotoper er, og hvordan vi kan bruge dem, skal vi se nærmere på det indre af et atom.
byggesten af stof
et atom er sammensat af en utrolig tæt kerne (kaldet en kerne) af protoner og neutroner, omgivet af en diffus sky af elektroner.
Du kan tænke på protoner og neutroner som den samme slags partikel med en nøgleforskel: protonerne er positivt ladede, mens neutroner ikke bærer nogen ladning. Dette betyder, at protoner kan “føle” elektriske eller magnetiske felter, mens neutroner ikke kan.elektronerne, som er meget lettere end protoner eller neutroner, bærer den samme ladningsstørrelse som en proton, men med det modsatte tegn, hvilket betyder, at hvert atom, der har lige mange protoner og elektroner, er elektrisk neutral.
det er elektronerne, der bestemmer den kemiske opførsel af et bestemt element.

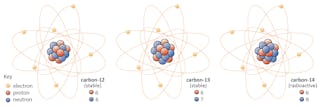
isotoper af et element deler det samme antal protoner, men har forskellige antal neutroner. Lad os bruge kulstof som et eksempel.
Der findes tre isotoper af kulstof i naturen – kulstof-12, kulstof-13 og kulstof-14. Alle tre har seks protoner, men deres neutronnumre – henholdsvis 6, 7 og 8 – er alle forskellige. Dette betyder, at alle tre isotoper har forskellige atommasser (kulstof-14 er den tungeste), men deler det samme atomnummer (å=6).
Kemisk kan alle tre ikke skelnes, fordi antallet af elektroner i hver af disse tre isotoper er det samme.
så forskellige isotoper af det samme element er identiske, kemisk set. Men nogle isotoper har evnen til at omgå denne regel ved at omdanne til et andet element helt.
marcherer mod stabilitet
denne transformative evne, som nogle isotoper har, har at gøre med det faktum, at ikke alle isotoper er stabile, og det er det, der førte Frederick Soddy til sin Nobelprisvindende opdagelse af isotoper i 1913.
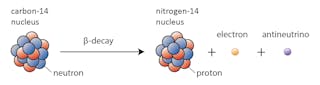
nogle isotoper – såsom kulstof-12-vil med glæde fortsætte med at eksistere som kulstof, medmindre der sker noget ekstraordinært. Andre-kulstof – 14, siger-vil på et tidspunkt henfalde til en stabil isotop i nærheden.
i dette tilfælde ændres en af neutronerne i carbon-14 til en proton, der danner nitrogen-14. Under denne proces, der er kendt som beta-henfald, udsender kernen stråling i form af en elektron og en antineutrino.
Der er mange faktorer, der kan få en kerne til at henfalde. En af de vigtigste er forholdet mellem protoner og neutroner, som en bestemt kerne har. Hvis en kerne har for mange neutroner (definitionen af “for mange” afhænger af, hvor tung kernen er), er der en chance for, at den vil henfalde mod stabilitet.
det samme gælder, hvis en kerne har for mange protoner. Dette er en af grundene til, at nogle isotoper af et givet element er radioaktive, mens andre ikke er det.
fra bellies of stars
nu undrer du dig måske over, hvordan alle disse isotoper blev oprettet i første omgang. Det viser sig, dette spørgsmål er komplekst, men giver en vis sandhed til ordsproget om, at vi alle er lavet af stjernestøv.
Nogle af de lettere isotoper blev dannet meget tidligt i universets historie under Big Bang. Andre skyldes processer, der sker inden for stjerner eller som et resultat af tilfældige kollisioner mellem meget energiske kerner – kendt som kosmiske stråler – i vores atmosfære.
de fleste naturligt eksisterende isotoper er det endelige (stabile eller langlivede) produkt som følge af en lang række nukleare reaktioner og henfald.
i de fleste af disse tilfælde har lette kerner været nødt til at smadre sammen med nok energi til at tillade den stærke kraft – en limlignende binding, der dannes, når protoner og neutroner kommer tæt nok til at røre ved-for at overvinde den elektromagnetiske kraft – som skubber protoner fra hinanden. Hvis den stærke kraft vinder ud, binder de kolliderende kerner sammen eller smelter sammen for at danne en tungere kerne.
vores sol er et godt eksempel på dette. En af dens vigtigste energikilder er en række fusionsreaktioner og beta-henfaldsprocesser, der omdanner brint til helium.

omdannelse af viden til værktøjer
siden begyndelsen af 1900 ‘ erne, da eksistensen af isotoper først blev realiseret, har atomfysikere og kemikere søgt måder at studere, hvordan isotoper kan dannes, hvordan de henfalder, og hvordan vi kan bruge dem.som det viser sig, arten af isotoper – deres kemiske ensartethed, deres nukleare særpræg – gør dem nyttige til en bred vifte af applikationer inden for så forskellige områder som medicin, arkæologi, landbrug, elproduktion og minedrift.
Hvis du nogensinde har haft en PET-scanning, har du draget fordel af et biprodukt af det radioaktive henfald af visse isotoper (ofte kaldet medicinske isotoper). Vi producerer disse medicinske isotoper ved hjælp af vores viden om, hvordan nukleare reaktioner fortsætter, ved hjælp af atomreaktorer eller acceleratorer kaldet cyklotroner.
men vi har også fundet måder at gøre brug af naturligt forekommende radioaktive isotoper. Kulstof dating, for eksempel, gør brug af den langlivede isotop carbon-14 at bestemme, hvor gamle objekter er.
under normale omstændigheder produceres kulstof-14 i vores atmosfære via kosmiske strålereaktioner med nitrogen-14. Det har en halveringstid på cirka 5.700 år, hvilket betyder, at halvdelen af en mængde kulstof-14 vil være henfaldet i den periode.

mens en biologisk organisme er i live, tager den cirka en kulstof-14-isotop for hver billion stabile kulstof-12-isotoper, og forholdet mellem kulstof-12 og kulstof-14 forbliver omtrent det samme, mens organismen lever. Når det dør, stopper nyt indtag af kulstof.
dette betyder forholdet mellem kulstof-14 og kulstof-12 ændringer i resterne af denne organisme over tid.
Hvis vi ekstraherer kulstof ved hjælp af kemiske metoder fra en prøve, kan vi derefter anvende en metode kaldet accelerator massespektrometri (AMS) for at adskille de enkelte carbonisotoper efter vægt.
AMS gør brug af det faktum, at accelererede partikler med samme ladning, men forskellige masser følger separate stier gennem magnetfelter. Ved at gøre brug af disse separate stier, vi kan bestemme isotopforhold med utrolig nøjagtighed.
som du kan se fra disse eksempler, anvender vi vores viden om isotoper på forskellige måder. Vi producerer dem, opdager dem, ekstraherer dem og studerer dem med det dobbelte formål at forstå, hvorfor atomkernen opfører sig som den gør, og hvordan vi kan udnytte dens kraft til vores fordel.
Leave a Reply