Førstelinjebehandling for metastatisk Kastratresistent prostatacancer
i 2019 tegner prostatacancer (PCa) sig for næsten 1 ud af 5 nye diagnoser af kræft hos mænd i USA.1 i de sidste mange år faldt den samlede forekomst af prostatacancer (PCa) med cirka 7% om året.1 det kraftige fald i forekomsten er ofte tilskrevet nedsat prostata-specifikt antigen (PSA) test fra 2008 til 2013. Den nedsatte brug af PSA-screening var forårsaget af United States (US) Preventive Services Task Force anbefalinger mod rutinemæssig PSA-screening. Dette var en klasse D-anbefaling specifikt hos mænd i alderen 75 år og ældre, som blev erklæret i 2008 og senere udvidet til alle mænd i 2011 på grund af stigende bekymring for overdiagnose og overbehandling.2 selvom forekomsten af PSA-test stoppede faldende og stabiliseret fra 2013 til 2015,3 effekten af screeningsreduktion på forekomsten af avanceret sygdom er stadig uklar. En analyse af et stort kræftregister, der dækker 89% af den amerikanske befolkning, rapporterede, at det samlede fald i PCa-forekomsten faktisk maskerer en stigning i diagnoser i fjernstadiet fra 2010 på tværs af alder og race.4
uanset den givne behandling udvikler cirka 20% -30% af patienterne med lokaliseret PCa sig til metastatisk sygdom, der ofte behandles med hormonbehandling.5 Dette kan gives gennem kirurgisk kastration (bilateral orchiektomi) eller gennem medicinsk kastration ved hjælp af androgen deprivationsterapi (ADT). Begge metoder opnår et kastratniveau af serumtestosteron, der betragtes som standarden for pleje til behandling af metastatisk hormonfølsom PCa (mhspc). Imidlertid er mHSPC bestemt til at udvikle sig til metastatisk kastratresistent prostatacancer (mCRPC).6 Den kastratresistente prostatacancer (CRPC) tilstand er defineret som sygdomsprogression på trods af at man når kastrat testosteronniveauer (serum testosteron < 50 ng/dL eller 1.7 nmol / L) og kan præsentere som enten en kontinuerlig stigning i serum-PSA-niveauer, progression af allerede eksisterende sygdom og/eller udseendet af nye metastaser.7 CRPC har en median overlevelse på ca.tre år8 og er forbundet med en signifikant forringelse af livskvaliteten.9 den nøjagtige mekanisme for overgang fra mHSPC til mCRPC er stadig uklar. Det er imidlertid kendt, at på trods af kastratniveauer af androgener forbliver androgenreceptoren (AR) aktiv og fortsætter med at drive PCa-progression i CRPC.10 Dette har ført til udviklingen af nye midler, der sigter mod yderligere faldende androgenproduktion eller blokering af AR-funktion. Der er dog andre biologiske veje, der fungerer uafhængigt af androgensignalering og også resulterer i CRPC.
der er sket flere signifikante skift i behandlingsmulighederne for mhspc-rummet, hvilket resulterer i betydelig overlevelsesfordel (se linket “den hurtigt udviklende ledelsesstrategi for metastatisk hormonfølsom prostatacancer”), herunder introduktion af kemoterapi i CHAARTED study11 og STAMPEDE-forsøget,12 tilsætningen af abirateronacetat og prednison i LATITUDE study13 og STAMPEDE-forsøget,14 tilsætningen af ENSALUTAMID i ARCHES trial15 og ENSAMET-undersøgelsen, 16 og endelig tilføjelsen af abirateronacetat og prednison i LATITUDE study13 og STAMPEDE-forsøget, 14 tilsætningen af apalutamid, en oral nonsteroidal anti-androgen, som kan lide det er vigtigt at vide, at ar-translokation, DNA-binding og ar-medieret transkription er i stand til at binde sig direkte til det ligandbindende domæne i AR og forhindrer ar-translokation, DNA-binding og AR-medieret transkription.17 TITAN-studiet viste fordele ved samlet overlevelse (OS) hos apalutamidbehandlede mhspc-patienter.18 Apalutamid har også vist fordel i forhold til placebo i den ikke-metastatiske CRPC (nmCRP) indstilling i det spartanske fase 3 placebokontrollerede forsøg,19 svarende til den fordel, der er vist hos patienter, der ikke er behandlet med ikke-metastatisk kastratresistent prostatacancer (nmcrpc), i PROSPER trial20 (se linket “de nye behandlinger for den ikke-metastatiske kastratresistente prostatacancer”). Disse behandlingsfremskridt i indstillingen mHSPC og nmCRPC har rejst spørgsmålet om, hvilke behandlingsmuligheder der skal tilbydes patienter i mCRPC-indstillingen.21
behandlingen af mænd med CRPC har ændret sig dramatisk i løbet af de sidste 15 år. Før 2004, hvor patienter mislykkedes primær ADT, blev behandlinger udelukkende administreret til palliation. The landmark trials af Tannock et al.22 og Petrylak et al.23 i 2004 var de første til at introducere kemoterapi hos mCRPC-patienter, der viste sig at forbedre deres overlevelse. Men siden FDA blev godkendt, er fem yderligere gavnlige stoffer, der viser en overlevelsesfordel, blevet FDA-godkendt baseret på randomiserede kliniske forsøg (tabel 1). Disse omfatter ensalutamid og abirateron, som specifikt påvirker androgenaksen, sipuleucel-T, som stimulerer immunsystemet; 24 cabasitaksel, som er et andet kemoterapeutisk middel;25 og radium-223, en radionuklidbehandling.26 andre behandlinger for mCRPC har vist sig at forbedre resultaterne, men er endnu blevet godkendt af FDA og vil blive diskuteret i en anden gennemgang. På grund af den betydelige stigning i flere FDA-godkendte terapeutiske midler hos patienter med CRPC udfordres klinikere med en overflod af behandlingsmuligheder og mange potentielle sekvenser af disse midler, hvilket gør klinisk beslutningstagning i mCRPC betydeligt mere kompleks.
tabel 1. Agenter, der er godkendt til behandling af metastatisk kastratresistent prostatacancer i USA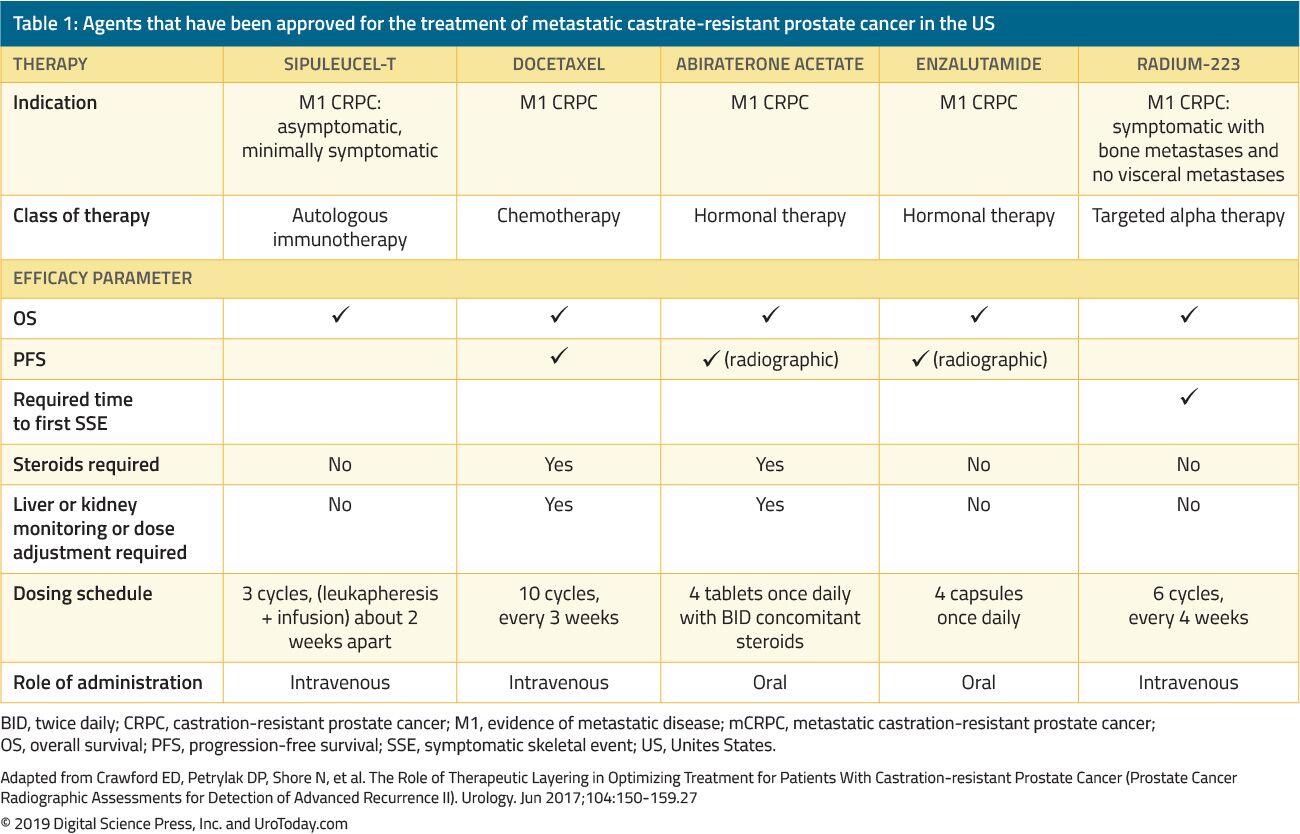
mCRPC er normalt en svækkende sygdom, og patienter vil sandsynligvis drage fordel af en ledelsesstrategi formaliseret af et tværfagligt team bestående af urologer, medicinske onkologer, strålingsonkologer, sygeplejersker, psykologer og socialarbejdere.28 Det er bydende nødvendigt at diskutere palliationsbehandlingsmuligheder, når man overvejer yderligere systemisk behandling, herunder håndtering af smerter, forstoppelse, anoreksi, kvalme, depression og træthed.
et andet afgørende punkt at overveje, når man etablerer den passende behandlingssekvens i dette sygdomsrum, er de tilknyttede omkostninger. Ved hjælp af modeller, der omfattede yderligere behandlingslinjer før eller efter mCRPC-behandling i en gennemsnitlig periode på 28,1 måneder, var de gennemsnitlige omkostninger ved mCRPC-behandling i en gennemsnitlig periode på 28,1 måneder ca. $48.000 pr.29 disse omkostninger er ret høje på grund af det faktum, at patienter kan modtage flere terapilinjer og pådrage sig løbende medicinske tjenester i løbet af deres sygdom.30
kun to forsøg har vist en marginal overlevelsesfordel for patienter, der er tilbage på LHRH – analoger i stedet for at tilføje anden-og tredjelinjeterapier.31, 32 undersøgelser har vist, at CRPC ikke er resistent over for ADT, men snarere overfølsom over for det.10 Behandlingsmedieret selektionstryk under ADT får AR til at forstærke og sikre, at situationen ikke eskalerer, ADT fortsættes med at blive administreret i mCRPC-indstillingen. Behandling-medieret selektionstryk fortsætter også gennem hele tumorens levetid, hvilket intensiverer behovet for korrekt sekvensbehandling. Men fordi potentielle data mangler, opvejer den lille potentielle fordel ved fortsat kastration stadig den minimale risiko for denne behandling. Derudover er alle efterfølgende godkendte behandlinger blevet undersøgt hos mænd med løbende ADT, hvilket tilføjer en anden grund til, at det skal fortsættes.
før man går i dybden med de faktiske tilgængelige behandlingsmuligheder, er det vigtigt at erkende, at det stadig er uklart, hvornår man skal begynde behandling hos mCRPC-patienter, der er helt asymptomatiske. Det er stadig ukendt, om tidligere behandling er overlegen, eller om vi skal vente, indtil patienten bliver symptomatisk og udvikler smerte. Inden behandlingen påbegyndes, bør vi overveje patientens eksisterende comorbiditeter og forventede bivirkninger ved start af behandlingen. Patienter med mcrpc i tidlig fase i COU-AA-302-studiet, der fik abirateron, overlevede typisk næsten et år længere end dem, der fik placebo (median OS, henholdsvis 53,6 måneder mod 41,8 måneder, HR, 0,61; 95% CI, 0,43 til 0,87; P = .006).33 således havde tidlige mCRPC-patienter gavn af tidligere start af abirateron. I de samme forsøgspatienter med asymptomatisk eller mildt symptomatisk mCRPC med baseline PSA < 15, 6 ng/mL abirateron førte også til en hurtigere hastighed og en større grad af PSA-tilbagegang end placebo.34 selvom de aktuelt tilgængelige data er begrænsede, antyder det sandsynligvis, at det er mere fordelagtigt at starte behandling tidligere end senere.33,34
godkendte førstelinjebehandlingsmuligheder for metastatisk kastratresistent prostatacancer
Abirateron
Abirateron er et antiandrogen, som hæmmer 17. Cou-AA-302 fase III-studiet evaluerede abirateron hos 1.088 chemo-na-patienter, asymptomatiske eller mildt symptomatiske mcrpc-patienter uden viscerale metastaser. I dette forsøg blev patienter randomiseret til abirateronacetat eller placebo, begge kombineret med prednisone35 (Figur 1). Patienterne blev stratificeret af enten Eastern Cooperative Oncology Group (ECOG) præstationsstatus 0 eller 1 og ved asymptomatisk eller let symptomatisk sygdom.35 OS og radiografisk progressionsfri overlevelse (rPFS) var de co-primære endepunkter. Forsøget viste, at der efter en median opfølgning på 22,2 måneder var en signifikant forbedring af rPFS i abirateronarmen (median 16,5 vs. 8,2 måneder, HR 0,52, p < 0,001). Ved den endelige analyse efter en median opfølgning på 49,2 måneder var os-slutpunktet signifikant positivt (34,7 vs. 30,3 måneder, HR: 0,81, 95% CI: 0,70-0,93, p = 0,0033).36 det er vigtigt at huske, at mCRPC spænder over et bredt prognostisk spektrum, selv når det er kemoterapi-na kurstve.37 i en analyse af abirateronarmen i COU-AA-302-undersøgelsen havde patienter, der ikke havde smerter ved baseline, normale alkaliske phosphatase-og LDH-niveauer og mindre end 10 knoglemetastaser, et median OS på 42,6 måneder.37 patienter med flere risikofaktorer for progression havde imidlertid signifikant kortere median OS.37 ved vurderingen af abiraterons toksicitetsprofil syntes det at give flere bivirkninger relateret til mineralocorticoidoverskud og leverfunktionsabnormiteter, men disse blev for det meste klassificeret 1-2 bivirkninger. Endelig blev abirateron også vist at være lige så effektivt i den ældre befolkning (> 75 år).38
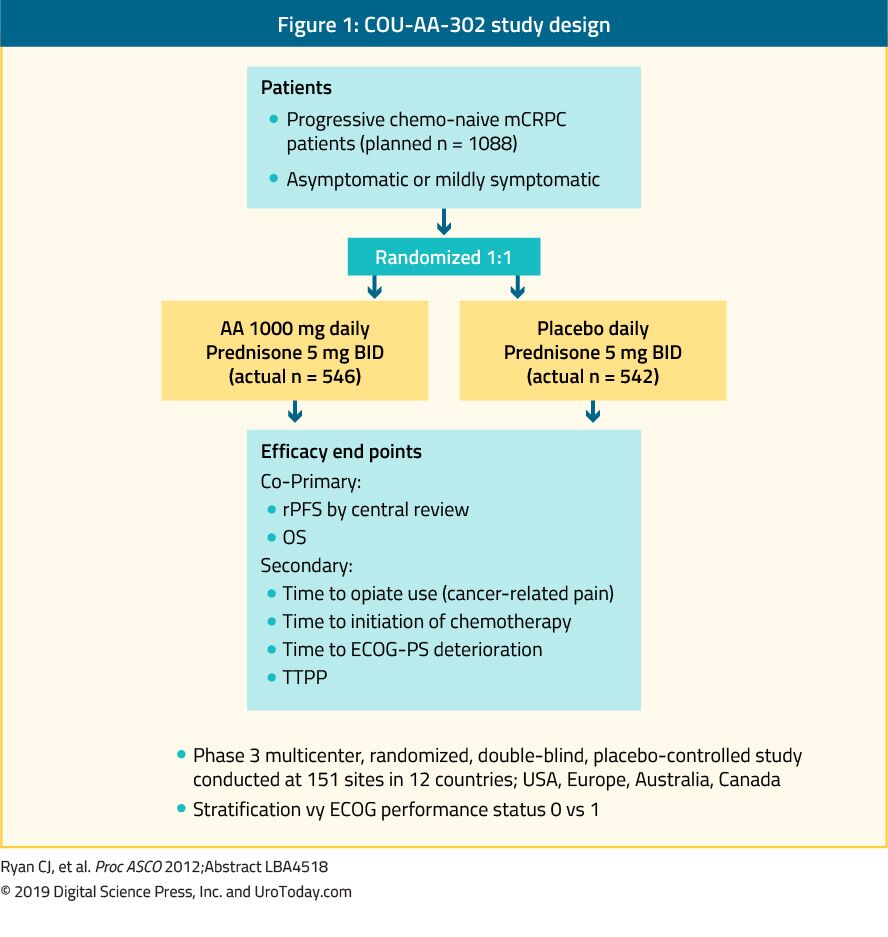
Figur 1. COU-AA – 302 studiedesign
Entalutamid
entalutamid er et nonsteroidalt antiandrogen. PREVAIL-undersøgelsen, som er et randomiseret fase III-forsøg, omfattede 1.717 chemo-na-karrustve mCRPC-patienter, og patienter med viscerale metastaser var også kvalificerede.39 dette forsøg sammenlignede entalutamid med placebo (figur 2). RPFS (HR: 0,186; CI: 0,15-0,23, p < 0,0001) og OS (HR: 0,706; CI: 0,6-0,84, p < 0,001). Udvidet opfølgning og endelig analyse bekræftede en fordel i OS og rPFS for acalutamid.40 hos 78% af patienterne blev der rapporteret et fald i PSA på mere end 50%. De mest almindelige klinisk relevante bivirkninger var træthed og hypertension. Det var også lige så effektivt og veltolereret hos ældre mænd (> 75 år)41 og hos dem med eller uden viscerale metastaser.42 for mænd med levermetastaser syntes der imidlertid ikke at være nogen mærkbar fordel.43 TERRÆNUNDERSØGELSEN sammenlignede bicalutamid med bicalutamid, et ældre antiandrogen, i en randomiseret dobbeltblind fase II-undersøgelse, der viste en signifikant forbedring i PFS (15.7 months vs. 5.8 months, HR: 0.44, p < 0.0001) in favor of enzalutamide.44
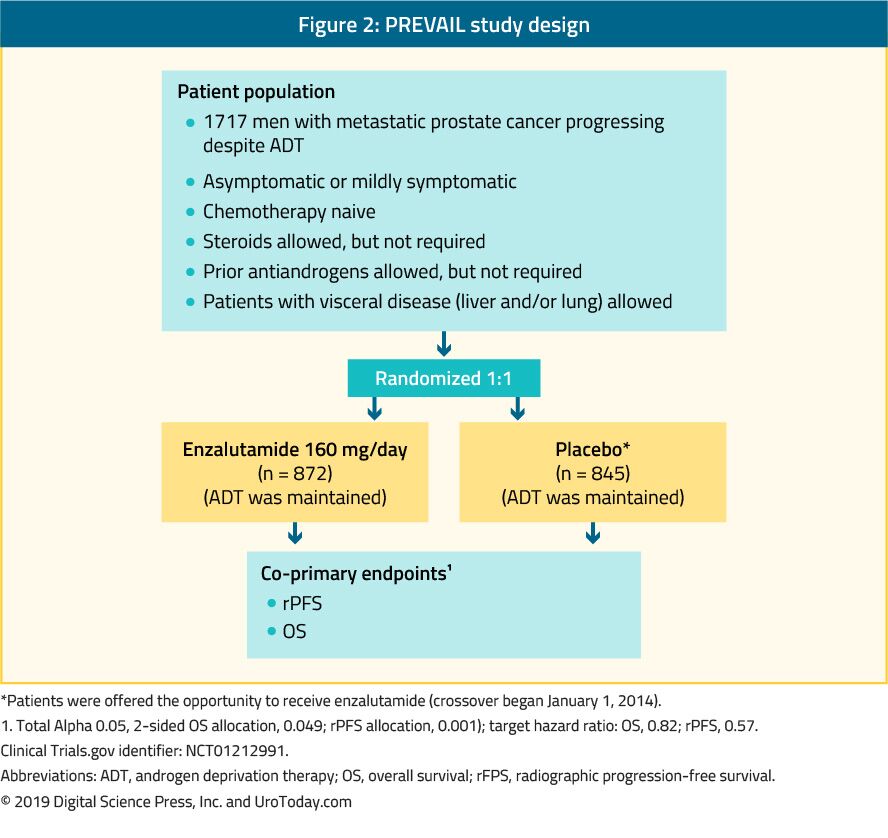
Figure 2. PREVAIL study design
Docetaxel
The landmark trial TAX 327 showed a significant improvement in median OS of 2-2.9 months in mCRPC patients treated with docetaxel-based chemotherapy when compared to patients who were treated with mitoxantrone plus prednisone therapy.22 The SWOG 9916 trial compared mitoxantrone to docetaxel and showed similar results23 (Figure 3). Standard førstelinjekemoterapi er docetaksel 75 mg / m2 i tre ugentlige doser kombineret med prednison 5 mg to gange dagligt, op til ti cyklusser. Der er flere vigtige prognostiske faktorer, der skal overvejes ved administration af docetaksel: viscerale metastaser, smerte, anæmi (Hb < 13 g/dL), knoglescanningsprogression og tidligere estramustinbehandling. Disse prognostiske faktorer kan bidrage til at stratificere respons på docetaksel. Ved hjælp af disse prognostiske faktorer kan sygdommen kategoriseres i lav, mellemliggende og høj risiko med signifikant forskellige tilsvarende median os-estimater på 25.Henholdsvis 7, 18, 7 og 12, 8 måneder.45 selv om alder i sig selv ikke er en kontraindikation for behandling med docetaksel, skal patienterne være egnede nok til at udholde denne type behandling, og comorbiditeter bør vurderes inden behandlingsstart. Hos mænd, der menes at være ude af stand til at tolerere standarddosis og tidsplan for docetaksel, kan dette reduceres fra 75 til 50 mg/m2 hver anden uge, hvilket viser mindre grad 3-4 bivirkninger og længere tid til behandlingssvigt.46
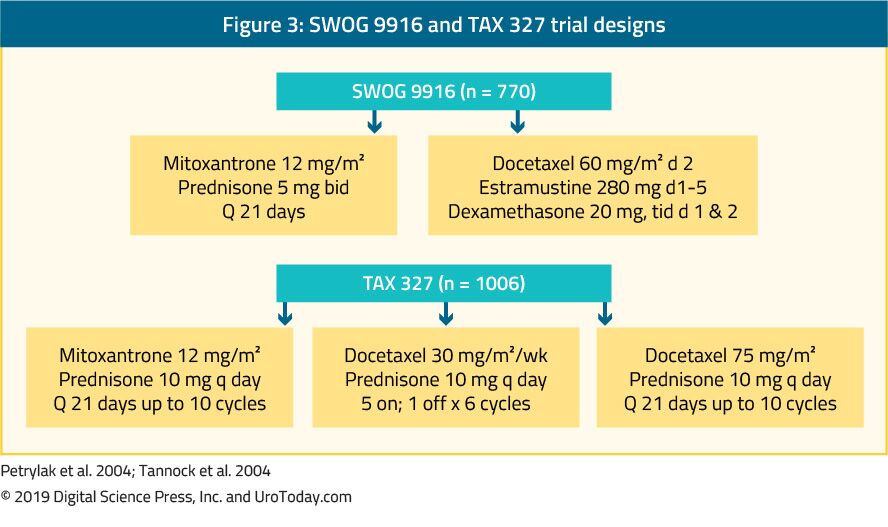
figur 3. 9916 og skat 327 forsøgsdesign
Sipuleucel-t
Sipuleucel-t, en autolog aktiv cellulær immunterapi, blev vist i et fase III-forsøg (IMPACT-forsøg) for at give en overlevelsesfordel hos 512 asymptomatiske eller minimalt symptomatiske mCRPC-patienter sammenlignet med placebo24 (figur 4). Efter en median opfølgning på 34 måneder var medianoverlevelsen signifikant højere i sipuleucel-t-gruppen (25,8 vs. 21,7 måneder med en HR på 0,78, p = 0,03).24 Det er vigtigt, at der ikke blev observeret PSA-tilbagegang under eller efter behandlingen, og PFS var ens i begge arme. Den samlede tolerance over for sipuleucel-T var meget god, med for det meste grad 1-2 bivirkninger. I øjeblikket er denne behandling kun tilgængelig i USA og er ikke længere tilgængelig i Europa.
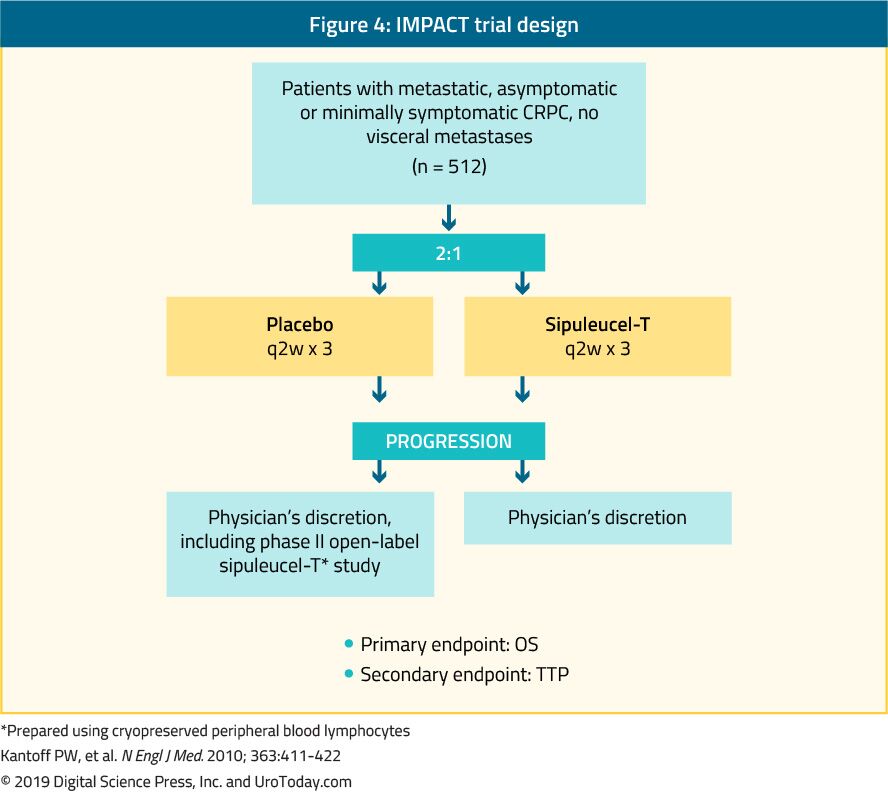
figur 4. IMPACT trial design
konklusioner
i de sidste 15 år har der været betydelige videnskabelige fremskridt og investeringer i lægemiddeludvikling for patienter med mCRPC. Dette har resulteret i FDA godkendelse af flere linjer af systemiske terapier på grund af smertelindring, minimering af sygdomsskadelige virkninger og OS forlængelse. Hidtil er den rapporterede indvirkning på OS hos mCRPC-patienter fra hver af disse individuelle midler stadig beskeden, hvilket resulterer i en tilføjelse på kun få måneder. Det er nødvendigt at forbedre vores forståelse af mCRPC ‘ s sygdomsbiologi, integrere en omfattende molekylær forståelse af kastrationsresistens og analysere mekanismer for resistens over for nuværende terapier for at forbedre den fremtidige behandlingsudvikling. Det er også afgørende at investere og udvikle prædiktive biomarkører til at hjælpe med personalisering af terapi. Endelig, på en mere praktisk note, er der behov for flere data om passende anden-og tredjelinjeterapier og sekventering og kombination af tilgængelige medicin, diskuteret mere detaljeret i den næste gennemgangsartikel (“ud over førstelinjebehandling af metastatisk kastratresistent prostatacancer”).
offentliggjort dato: 19. November 2019
Leave a Reply