Comparación de Fortalezas de Oxidantes y Reductores
Objetivos de aprendizaje
- Identificar cómo ver los Potenciales de Reducción Estándar desde la perspectiva de agentes reductores y oxidantes viables en reacciones REDOX.
Podemos medir los potenciales estándar para una amplia variedad de sustancias químicas, algunas de las cuales se enumeran en la Tabla P2. Estos datos nos permiten comparar las fuerzas oxidativas y reductoras de una variedad de sustancias. La media reacción para el electrodo de hidrógeno estándar (SHE) se encuentra más de la mitad de la lista en la Tabla \(\pageIndex{1}\). Todos los reactivos que se encuentran debajo del SHE en la tabla son oxidantes más fuertes que el H+, y todos los que se encuentran por encima del SHE son más débiles. El oxidante más fuerte en la tabla es F2, con un potencial de electrodo estándar de 2,87 V. Este alto valor es consistente con la alta electronegatividad del flúor y nos dice que el flúor tiene una tendencia más fuerte a aceptar electrones (es un oxidante más fuerte) que cualquier otro elemento.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g) + 2e−\(\rightleftharpoons\) 2F−(aq) | 2.87 |
No todos los agentes oxidantes y reductores son creados iguales. Los potenciales de reducción estándar de la tabla \(\pageIndex{1}\) pueden interpretarse como una clasificación de sustancias de acuerdo con su poder oxidante y reductor. Los agentes oxidantes fuertes son típicamente compuestos con elementos en altos estados de oxidación o con alta electronegatividad, que ganan electrones en la reacción redox (Figura \(\pageIndex{1}\)). Ejemplos de oxidantes fuertes incluyen peróxido de hidrógeno, permanganato y tetróxido de osmio. Los agentes reductores son típicamente elementos electropositivos como hidrógeno, litio, sodio, hierro y aluminio, que pierden electrones en reacciones redox. Los hidruros (compuestos que contienen hidrógeno en el estado de oxidación formal -1), como el hidruro de sodio, el borohidruro de sodio y el hidruro de aluminio y litio, se usan a menudo como agentes reductores en reacciones orgánicas y organometálicas.
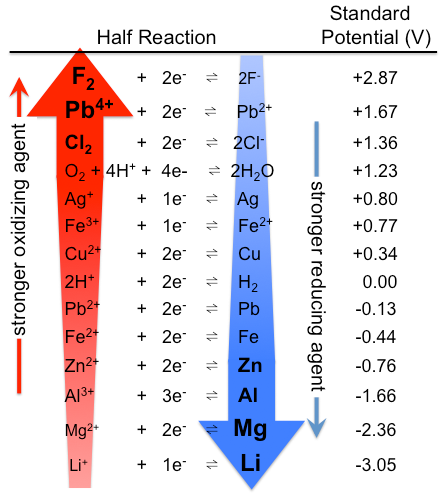
Figura \(\pageIndex{1}\): Tabla de potenciales de electrodos estándar. Tenga en cuenta que la clasificación es la opuesta aquí, con agentes oxidantes fuertes en la parte superior y agentes reductores fuertes en la parte inferior, que en la Tabla \(\pageIndex{1}\). Los potenciales estándar actuales son los mismos, por supuesto. (CC BY-SA 3.0; Tem5psu).
De manera similar, todas las especies de la Tabla \(\pageIndex{1}\) que se encuentran por encima de H2 son reductores más fuertes que H2, y las que se encuentran por debajo de H2 son más débiles. El reductor más fuerte de la tabla es, por lo tanto, el litio metálico, con un potencial de electrodo estándar de -3,04 V. Este hecho podría ser sorprendente porque el cesio, no el litio, es el elemento menos electronegativo. La anomalía aparente puede explicarse por el hecho de que los potenciales de electrodos se miden en solución acuosa, donde las interacciones intermoleculares son importantes, mientras que los potenciales de ionización y las afinidades electrónicas se miden en la fase gaseosa. Debido a su pequeño tamaño, el ion Li+ se estabiliza en solución acuosa mediante fuertes interacciones electrostáticas con el extremo dipolar negativo de las moléculas de agua. Estas interacciones resultan en una δhidratación significativamente mayor para Li + en comparación con Cs+. Por lo tanto, el metal de litio es el reductor más fuerte (más fácilmente oxidado) de los metales alcalinos en solución acuosa.
Los potenciales de reducción estándar se pueden interpretar como una clasificación de sustancias de acuerdo con su poder oxidante y reductor. Las especies de la tabla \(\pageIndex{1}\) que se encuentran por encima de H2 son agentes reductores más fuertes (más fácilmente oxidados) que H2. Las especies que se encuentran por debajo de H2 son agentes oxidantes más fuertes.
Debido a que las semirreacciones que se muestran en la Tabla \(\pageIndex{1}\) están ordenadas por sus valores de E°, podemos usar la tabla para predecir rápidamente las fuerzas relativas de varios oxidantes y reductores. Cualquier especie en el lado izquierdo de una media reacción oxidará espontáneamente cualquier especie en el lado derecho de otra media reacción que se encuentre debajo de ella en la tabla. Por el contrario, cualquier especie en el lado derecho de una media reacción reducirá espontáneamente cualquier especie en el lado izquierdo de otra media reacción que se encuentre por encima de ella en la tabla. Podemos usar estas generalizaciones para predecir la espontaneidad de una amplia variedad de reacciones redox (E°cell > 0), como se ilustra en el Ejemplo \(\pageIndex{1}\).
Ejemplo \(\pageIndex{1}\): Sulfuro de plata
El deslustre negro que se forma en los objetos de plata es principalmente Ag2S. La media reacción para revertir el proceso de deslustre es la siguiente:
- En referencia a la tabla \(\pageIndex{1}\), predice qué especies—H2O2(aq), Zn(s), I−(aq), Sn2+(aq)—pueden reducir Ag2S a Ag en condiciones estándar.
- De estas especies-H2O2 (aq), Zn(s), I−(aq), Sn2+(aq), identifican cuál es el agente reductor más fuerte en solución acuosa y, por lo tanto, el mejor candidato para un producto comercial.
- De los datos de la tabla \(\pageIndex{1}\), sugiera un agente reductor alternativo que esté fácilmente disponible, sea económico y posiblemente más efectivo para eliminar el deslustre.

Dado: media reacción de reducción, potencial de electrodo estándar y lista de posibles reductores
Solicitado: reductores para Ag2S, reductor más fuerte y agente reductor potencial para eliminar el deslustre
Estrategia:
A Desde sus posiciones en la Tabla \(\pageIndex{1}\), decida qué especie puede reducir Ag2S. Determine qué especie es el reductor más fuerte.
B Utilice la tabla \(\pageIndex{1}\) para identificar un reductor para Ag2S que es un producto doméstico común.
Solución
podemos resolver el problema en una de dos maneras: (1) compare las posiciones relativas de los cuatro posibles reductores con la de la pareja Ag2S/Ag en la Tabla \(\Índice de página{1}\) o (2) compare E° para cada especie con E° para la pareja Ag2S/Ag (-0,69 V).
- A Las especies de la tabla \(\pageIndex{1}\) están dispuestas de arriba a abajo en orden de aumentar la resistencia reductora. De las cuatro especies dadas en el problema, I-(aq), Sn2+(aq) y H2O2 (aq) se encuentran por encima de Ag2S, y una se encuentra por debajo de ella. Por lo tanto, podemos concluir que Zn(s) puede reducir Ag2S(s) en condiciones estándar, mientras que I−(aq), Sn2+(aq) y H2O2(aq) no pueden. Sn2+(aq) y H2O2(aq) aparecen dos veces en la tabla: en el lado izquierdo (oxidante) en una media reacción y en el lado derecho (reductor) en otro.
- El reductor más fuerte es Zn (s), la especie en el lado derecho de la media reacción que se encuentra más cerca de la parte inferior de la Tabla \(\pageIndex{1}\) que las medias reacciones que involucran I-(aq), Sn2+(aq) y H2O2 (aq). (Los productos comerciales que usan una pieza de zinc a menudo se comercializan como un «producto milagroso» para eliminar el deslustre de la plata. Todo lo que se requiere es agregar agua tibia y sal para la conductividad eléctrica.)
- B De los reductores que se encuentran debajo de Zn (s) en la Tabla \(\pageIndex{1}\), y por lo tanto son reductores más fuertes, solo uno está comúnmente disponible en productos para el hogar: Al(s), que se vende como papel de aluminio para envolver alimentos.
Ejemplo \(\pageIndex{2}\):
Utilice los datos de la Tabla \(\Índice de página{1}\) para determinar si es probable que cada reacción ocurra espontáneamente en condiciones estándar:
- Sn(s) + Be2+(aq) → Sn2+(aq) + Be(s)
- MnO2(s) + H2O2(aq) + 2H+(aq) → O2(g) + Mn2+(aq) + 2H2O(l)
Dado: reacción redox y lista de potenciales de electrodos estándar (Tabla P2 )
Solicitado: espontaneidad de la reacción
Estrategia:
- Identificar las semirreacciones en cada ecuación. Usando la tabla \(\pageIndex{1}\), determine los potenciales estándar para las semirreacciones en la dirección apropiada.
- Utilice la ecuación \(E_{cell}=E^o_{srp}(cátodo) – E^o_{srp}(ánodo)\) para calcular el potencial de celda estándar para la reacción general. A partir de este valor, determine si la reacción general es espontánea.
Solución
- Un estaño metálico se oxida a Sn2+(aq), y Be2+(aq) se reduce a berilio elemental. Podemos encontrar los potenciales de electrodo estándar para esta última (reducción) media reacción (-1.85 V) y para la primera reacción de oxidación (-0,14 V) directamente de la Tabla \(\pageIndex{1}\).
B la Adición de las dos medias reacciones da la reacción global:
|
\(\textrm{cátodo:} \; \mathrm{Ser^{2+}(aq)} +\mathrm{2e^-} \rightarrow \mathrm{Be(s)}\) \(\textrm{ánodo:} \; \mathrm{Sn(s) \rightarrow \mathrm{Sn^{2+}}(s)} +\mathrm{2e^-} \) \(\textrm{total:} \; \mathrm{Sn(s)+ \mathrm{Be^{2+}(aq)} \rightarrow \mathrm{Sn^{2+}}(aq)} + \mathrm{Be(s)}\) |
\(E^\circ_{\textrm{cátodo}}=\textrm{-1.99 V} \\ E^\circ_{\textrm{ánodo}}=\textrm{-0.14 V} \\ E^\circ_{\textrm{cell}}=E^\circ_{\textrm{cátodo}}-E^\circ_{\textrm{ánodo}} \\ \hspace{5mm} =-\textrm{1.85 V}\) |
El potencial celular estándar es bastante negativo, por lo que la reacción no se producirá espontáneamente tal como está escrita. Es decir, el estaño metálico no puede reducir Be2+ a berilio metálico en condiciones estándar. En cambio, el proceso inverso, la reducción de iones estannosos (Sn2+) por berilio metálico, que tiene un valor positivo de célula E°, ocurrirá espontáneamente.
- Un MnO2 es el oxidante (Mn4 + se reduce a Mn2+), mientras que H2O2 es el reductor (O2− se oxida a O2). Podemos obtener los potenciales de electrodo estándar para las semi-reacciones de reducción y oxidación directamente de la Tabla \(\pageIndex{1}\).
B Las dos semirreacciones y sus potenciales correspondientes son los siguientes:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ E^\circ_{\textrm{ánodo}}=\textrm{0.70 V} \\ E^\circ_{\textrm{celda}}=E^\circ_{\textrm{cátodo}}-E^\circ_{\textrm{ánodo}} \\ \hspace{5mm} =-\textrm{0.53 V}\) |
El potencial estándar de la reacción es positiva, lo que indica que bajo condiciones estándar, se producirá de manera espontánea, como por escrito. El peróxido de hidrógeno reducirá el MnO2, y el gas oxígeno evolucionará a partir de la solución.
Ejercicio \(\pageIndex{2}\)
Utilice los datos de la Tabla \(\pageIndex{1}\) para determinar si es probable que cada reacción ocurra espontáneamente en condiciones estándar:
- 2Ce4+(aq) + 2Cl−(aq) → 2Ce3+(aq) + Cl2(g)
- 4MnO2(s) + 3O2(g) + 4OH−(aq) → 4MnO4−(aq) + 2H2O
Respuesta
- espontánea (E°célula = 0,36 V)
- no espontánea (E°célula = -0.20 V)
Aunque el signo de célula E°nos dice si una reacción redox en particular ocurrirá espontáneamente en condiciones estándar, no nos dice en qué medida la reacción continúa, y no nos dice qué sucederá en condiciones no estándar. Para responder a estas preguntas se requiere una comprensión más cuantitativa de la relación entre el potencial electroquímico de las células y la termodinámica química.
Resumen
Las fuerzas relativas de varios oxidantes y reductores se pueden predecir utilizando valores de E°. Las fuerzas oxidativas y reductoras de una variedad de sustancias se pueden comparar utilizando potenciales de electrodos estándar. Las anomalías aparentes se pueden explicar por el hecho de que los potenciales de electrodos se miden en solución acuosa, lo que permite interacciones electrostáticas intermoleculares fuertes, y no en la fase gaseosa.
Problemas conceptuales
- El orden de los potenciales de electrodos no siempre se puede predecir mediante potenciales de ionización y afinidades electrónicas. ¿Por qué? ¿Espera que el metal de sodio tenga un potencial de electrodo mayor o menor que el predicho por su potencial de ionización? ¿Cuál es su potencial aproximado de electrodos?
- Sin hacer referencia a datos tabulados, de Br2 / Br -, Ca2+ / Ca, O2/OH− y Al3+/Al, ¿cuál esperaría que tuviera el menor potencial de electrodo negativo y cuál el más negativo? ¿Por qué?
- Debido a los aminoácidos que contienen azufre presentes en las claras de huevo, comer huevos con un tenedor de plata empañará el tenedor. Como químico, tiene todo tipo de productos de limpieza interesantes en su gabinete, incluida una solución de 1 M de ácido oxálico (H2C2O4). ¿Elegirías esta solución para limpiar el tenedor que has manchado de comer huevos revueltos?
- El potencial de electrodo para la reacción Cu2+(aq) + 2e− → Cu (s) es de 0,34 V en condiciones estándar. Es el potencial de oxidación de 0.5 mol de Cu igual -0.34/2 V? Explica tu respuesta.
- Consulte la tabla \(\pageIndex{1}\) para predecir
- Qué especies—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) y/o H2O2(aq)—pueden oxidar MnO2(s) a MNO4− en condiciones estándar.
- Qué especie-Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) y/o H2O2(aq)—es el agente oxidante más fuerte en solución acuosa.
Conceptual Respuesta
- No; E° = -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply