Stärken von Oxidationsmitteln und Reduktionsmitteln vergleichen
Lernziele
- Identifizieren Sie, wie Standardreduktionspotentiale aus der Perspektive lebensfähiger Reduktions- und Oxidationsmittel in REDOXREAKTIONEN betrachtet werden können.
Wir können die Standardpotentiale für eine Vielzahl chemischer Substanzen messen, von denen einige in Tabelle P2 aufgeführt sind. Diese Daten ermöglichen es uns, die oxidativen und reduktiven Stärken einer Vielzahl von Substanzen zu vergleichen. Die Halbreaktion für die Standard-Wasserstoffelektrode (SHE) liegt mehr als zur Hälfte der Liste in Tabelle \(\pageIndex{1}\). Alle Reaktanten, die unterhalb der SHE in der Tabelle liegen, sind stärkere Oxidationsmittel als H+, und alle, die oberhalb der SHE liegen, sind schwächer. Das stärkste Oxidationsmittel in der Tabelle ist F2 mit einem Standardelektrodenpotential von 2,87 V. Dieser hohe Wert steht im Einklang mit der hohen Elektronegativität von Fluor und sagt uns, dass Fluor eine stärkere Tendenz hat, Elektronen aufzunehmen (es ist ein stärkeres Oxidationsmittel) als jedes andere Element.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g) + 2e−\(\rightleftharpoons\) 2F−(aq) | 2,87 |
Nicht alle Oxidationsmittel und Reduktionsmittel sind gleich. Die standardmäßigen Reduktionspotentiale in der Tabelle \(\pageIndex{1}\) können als eine Rangfolge von Substanzen nach ihrer oxidierenden und reduzierenden Kraft interpretiert werden. Starke Oxidationsmittel sind typischerweise Verbindungen mit Elementen in hohen Oxidationsstufen oder mit hoher Elektronegativität, die in der Redoxreaktion Elektronen gewinnen (Abbildung \(\pageIndex{1}\)). Beispiele für starke Oxidationsmittel umfassen Wasserstoffperoxid, Permanganat und Osmiumtetroxid. Reduktionsmittel sind typischerweise elektropositive Elemente wie Wasserstoff, Lithium, Natrium, Eisen und Aluminium, die bei Redoxreaktionen Elektronen verlieren. Hydride (Verbindungen, die Wasserstoff in der formalen Oxidationsstufe -1 enthalten), wie Natriumhydrid, Natriumborhydrid und Lithiumaluminiumhydrid, werden häufig als Reduktionsmittel in organischen und metallorganischen Reaktionen verwendet.
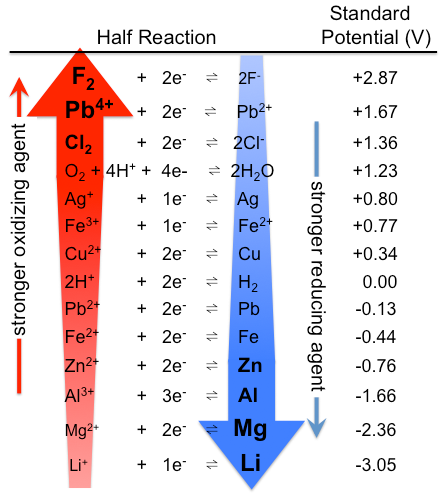
Abbildung \(\pageIndex{1}\): Tabelle der Standardelektrodenpotentiale. Beachten Sie, dass die Rangfolge hier mit starken Oxidationsmitteln oben und starken Reduktionsmitteln unten umgekehrt ist als in Tabelle \(\pageIndex{1}\). Die tatsächlichen Standardpotentiale sind natürlich die gleichen. (CC BY-SA 3.0; Tem5psu).
In ähnlicher Weise sind alle Spezies in Tabelle \(\pageIndex{1}\), die über H2 liegen, stärkere Reduktionsmittel als H2, und diejenigen, die unter H2 liegen, sind schwächer. Das stärkste Reduktionsmittel in der Tabelle ist somit metallisches Lithium mit einem Standardelektrodenpotential von -3,04 V. Diese Tatsache könnte überraschend sein, da Cäsium, nicht Lithium, das am wenigsten elektronegative Element ist. Die scheinbare Anomalie kann dadurch erklärt werden, dass Elektrodenpotentiale in wässriger Lösung gemessen werden, wo intermolekulare Wechselwirkungen wichtig sind, während Ionisationspotentiale und Elektronenaffinitäten in der Gasphase gemessen werden. Aufgrund seiner geringen Größe wird das Li + -Ion in wässriger Lösung durch starke elektrostatische Wechselwirkungen mit dem negativen Dipolende von Wassermolekülen stabilisiert. Diese Wechselwirkungen führen zu einer signifikant größeren Δhhydratation für Li + im Vergleich zu Cs +. Lithiummetall ist daher das stärkste Reduktionsmittel (am leichtesten oxidiert) der Alkalimetalle in wässriger Lösung.
Die Standardreduktionspotentiale können als eine Rangfolge von Substanzen nach ihrer oxidierenden und reduzierenden Kraft interpretiert werden. Spezies in der Tabelle \(\pageIndex{1}\), die über H2 liegen, sind stärkere Reduktionsmittel (leichter oxidierbar) als H2. Spezies, die unter H2 liegen, sind stärkere Oxidationsmittel.
Da die in Tabelle \(\pageIndex{1}\) gezeigten Halbreaktionen in der Reihenfolge ihrer E° -Werte angeordnet sind, können wir die Tabelle verwenden, um die relativen Stärken verschiedener Oxidationsmittel und Reduktionsmittel schnell vorherzusagen. Jede Spezies auf der linken Seite einer Halbreaktion oxidiert spontan jede Spezies auf der rechten Seite einer anderen Halbreaktion, die in der Tabelle darunter liegt. Umgekehrt reduziert jede Spezies auf der rechten Seite einer Halbreaktion spontan jede Spezies auf der linken Seite einer anderen Halbreaktion, die in der Tabelle darüber liegt. Wir können diese Verallgemeinerungen verwenden, um die Spontaneität einer Vielzahl von Redoxreaktionen vorherzusagen (E°cell > 0), wie in Beispiel \(\pageIndex{1}\) .
Beispiel \(\pageIndex{1}\): Silbersulfid
Der schwarze Anlauf, der sich auf Silberobjekten bildet, ist primär Ag2S. Die Halbreaktion zur Umkehrung des Anlaufprozesses ist wie folgt:
- Sagen Sie anhand der Tabelle \(\pageIndex{1}\) voraus, welche Spezies — H2O2(aq), Zn(s), I−(aq), Sn2+(aq) — Ag2S unter Standardbedingungen zu Ag reduzieren kann.
- Dieser Spezies—H2O2(aq), Zn(s), I− (aq), Sn2+(aq), identifizieren, welches das stärkste Reduktionsmittel in wässriger Lösung und damit der beste Kandidat für ein kommerzielles Produkt ist.
- Schlagen Sie aus den Daten in Tabelle \(\pageIndex{1}\) ein alternatives Reduktionsmittel vor, das leicht verfügbar, kostengünstig und möglicherweise wirksamer beim Entfernen von Anlaufen ist.

Gegeben: Reduktionshalbreaktion, Standardelektrodenpotential und Liste möglicher Reduktionsmittel
Gefragt: Reduktionsmittel für Ag2S, stärkstes Reduktionsmittel und potenzielles Reduktionsmittel zum Entfernen von Anlaufen
Strategie:
A Entscheiden Sie anhand ihrer Positionen in Tabelle \ (\pageIndex{1}\), welche Spezies Ag2S reduzieren kann. Bestimmen Sie, welche Spezies das stärkste Reduktionsmittel ist.
B Verwenden Sie die Tabelle \(\pageIndex{1}\), um ein Reduktionsmittel für Ag2S zu identifizieren, das ein gängiges Haushaltsprodukt ist.
Lösung
Wir können das Problem auf zwei Arten lösen: (1) vergleichen Sie die relativen Positionen der vier möglichen Reduktionsmittel mit denen des Ag2S / Ag-Paares in Tabelle \(\pageIndex{1}\) oder (2) vergleichen Sie E ° für jede Spezies mit E ° für das Ag2S / Ag-Paar (-0,69 V).
- A Die Arten in der Tabelle \(\pageIndex{1}\) sind von oben nach unten in der Reihenfolge zunehmender reduzierender Stärke angeordnet. Von den vier im Problem angegebenen Spezies liegen I− (aq), Sn2 + (aq) und H2O2 (aq) über Ag2S und eine darunter. Wir können daher den Schluss ziehen, dass Zn (s) AG reduzieren2s (s) unter Standardbedingungen, während I− (aq), Sn2 + (aq) und H2O2 (aq) nicht. Sn2 + (aq) und H2O2(aq) erscheinen zweimal in der Tabelle: auf der linken Seite (Oxidationsmittel) in einer Halbreaktion und auf der rechten Seite (Reduktionsmittel) in einer anderen.Das stärkste Reduktionsmittel ist Zn(s), die Spezies auf der rechten Seite der Halbreaktion, die näher am Ende der Tabelle \(\pageIndex{1}\) liegt als die Halbreaktionen mit I-(aq), Sn2+(aq) und H2O2(aq). (Kommerzielle Produkte, die ein Stück Zink verwenden, werden oft als „Wunderprodukt“ zum Entfernen von Anlaufen von Silber vermarktet. Alles, was benötigt wird, ist warmes Wasser und Salz für die elektrische Leitfähigkeit hinzuzufügen.)
- B Von den Reduktionsmitteln, die in der Tabelle \(\pageIndex{1}\) unterhalb von Zn(s) liegen und daher stärkere Reduktionsmittel sind, ist in Haushaltsprodukten üblicherweise nur eines erhältlich: Al(s), das als Aluminiumfolie zum Einwickeln von Lebensmitteln verkauft wird.
Beispiel \(\pageIndex{2}\):
Verwenden Sie die Daten in Tabelle \(\pageIndex{1}\), um zu bestimmen, ob jede Reaktion unter Standardbedingungen wahrscheinlich spontan auftritt:
- Sn(s) + Be2+(aq) → Sn2+(aq) + Be(s)
- MnO2(s) + H2O2(aq) + 2H+(aq) → O2(g) + Mn2+(aq) + 2H2O(l)
Gegeben: Redoxreaktion und Liste der Standardelektrodenpotentiale (Tabelle P2)
Gefragt nach: Reaktion Spontaneität
Strategie:
- Identifizieren Sie die Halbreaktionen in jeder Gleichung. Bestimmen Sie anhand der Tabelle \(\pageIndex{1}\) die Standardpotentiale für die Halbreaktionen in der entsprechenden Richtung.
- Verwenden Sie die Gleichung \(E_{cell}=E^o_{srp}(Kathode) – E^o_{srp}(Anode)\), um das Standardzellpotential für die Gesamtreaktion zu berechnen. Bestimmen Sie anhand dieses Wertes, ob die Gesamtreaktion spontan ist.
Lösung
- Ein metallisches Zinn wird zu Sn2+(aq) oxidiert und Be2+(aq) wird zu elementarem Beryllium reduziert. Wir können die Standardelektrodenpotentiale für die letztere (Reduktions-) Halbreaktion (-1.85 V) und für die erstere (Oxidations-)Halbreaktion (-0,14 V) direkt aus Tabelle \(\pageIndex{1}\).
B Die Addition der beiden Halbreaktionen ergibt die Gesamtreaktion:
|
\(\textrm{Kathode:} \; \mathrm{Be^{2+}(aq)} +\ mathrm{2e^-} \rightarrow \mathrm{Be(s)}\) \(\textrm{total:} \; \mathrm{Sn(s) \rightarrow \mathrm{Sn^{2+}}(s)} +\mathrm{2e^-} \) \(\textrm{total:} \; \mathrm{Sn(s)+ \mathrm{Be^{2+}(aq)} \rightarrow \mathrm{Sn^{2+}}(aq)} + \mathrm{Be(s)}\) |
\(E^\circ_{\textrm{Kathode}}=\textrm{-1,99 V} \\ E^\circ_{\textrm{Anode}}=\textrm{ -0,14 V} \\ E ^\circ_ {\textrm {zelle}} = E ^\circ_ {\textrm {kathode}}-E ^\circ_ {\textrm {anode}} \\ \hspace {5mm} =-\textrm {1,85 V}\) |
Das Standardzellenpotential ist ziemlich negativ, so dass die Reaktion nicht spontan wie geschrieben abläuft. Das heißt, metallisches Zinn kann Be2 + unter Standardbedingungen nicht zu Berylliummetall reduzieren. Stattdessen tritt der umgekehrte Prozess, die Reduktion von Zinnionen (Sn2 +) durch metallisches Beryllium, das einen positiven Wert von E ° c hat, spontan auf.
- A MnO2 ist das Oxidationsmittel (Mn4+ wird zu Mn2+ reduziert), während H2O2 das Reduktionsmittel ist (O2− wird zu O2 oxidiert). Wir können die Standardelektrodenpotentiale für die Reduktions- und Oxidationshalbreaktionen direkt aus Tabelle \(\pageIndex{1}\) erhalten.
B Die beiden Halbreaktionen und ihre entsprechenden Potentiale sind wie folgt:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ E^\circ_{\textrm {anode}} = \textrm {0,70 V} \\ E^\circ_ {\textrm {zelle}}=E^\circ_ {\textrm {kathode}}-E^\circ_ {\textrm {anode}} \\ \hspace {5mm} =-\textrm {0,53 V}\) |
Das Standardpotential für die Reaktion ist positiv, was darauf hinweist, dass sie unter Standardbedingungen spontan wie geschrieben auftritt. Wasserstoffperoxid reduziert MnO2 und Sauerstoffgas entwickelt sich aus der Lösung.
Übung \(\pageIndex{2}\)
Verwenden Sie die Daten in Tabelle \(\pageIndex{1}\), um zu bestimmen, ob jede Reaktion unter Standardbedingungen wahrscheinlich spontan auftritt:
- 2Ce4+(aq) + 2Cl−(aq) → 2Ce3+(aq) + Cl2(g)
- 4MnO2(s) + 3O2(g ) + 4OH−(aq) → 4MnO4−(aq) + 2H2O
Antwort
- spontan (E ° Zelle = 0,36 V)
- nicht spontan (E ° Zelle = -0.20 V)
Obwohl das Vorzeichen von E °cell uns sagt, ob eine bestimmte Redoxreaktion unter Standardbedingungen spontan abläuft, sagt es uns nicht, in welchem Ausmaß die Reaktion abläuft, und es sagt uns nicht, was unter nicht standardmäßigen Bedingungen passieren wird. Die Beantwortung dieser Fragen erfordert ein quantitativeres Verständnis der Beziehung zwischen dem elektrochemischen Zellpotential und der chemischen Thermodynamik.
Zusammenfassung
Die relativen Stärken verschiedener Oxidations- und Reduktionsmittel können anhand von E° -Werten vorhergesagt werden. Die oxidativen und reduktiven Stärken einer Vielzahl von Substanzen können mit Standardelektrodenpotentialen verglichen werden. Scheinbare Anomalien können durch die Tatsache erklärt werden, dass Elektrodenpotentiale in wässriger Lösung gemessen werden, was starke intermolekulare elektrostatische Wechselwirkungen ermöglicht, und nicht in der Gasphase.
Konzeptionelle Probleme
- Die Reihenfolge der Elektrodenpotentiale kann nicht immer durch Ionisationspotentiale und Elektronenaffinitäten vorhergesagt werden. Warum? Erwarten Sie, dass Natriummetall ein höheres oder ein niedrigeres Elektrodenpotential hat als von seinem Ionisationspotential vorhergesagt? Was ist das ungefähre Elektrodenpotential?
- Ohne sich auf tabellarische Daten zu beziehen, von Br2/ Br−, Ca2+/ Ca, O2/ OH- und Al3+/Al, welches würden Sie erwarten, das am wenigsten negative Elektrodenpotential und welches das negativste zu haben? Warum?
- Aufgrund der schwefelhaltigen Aminosäuren im Eiweiß trübt das Essen von Eiern mit einer Silbergabel die Gabel. Als Chemiker haben Sie alle Arten von interessanten Reinigungsprodukten in Ihrem Schrank, einschließlich einer 1 M Lösung von Oxalsäure (H2C2O4). Würden Sie diese Lösung wählen, um die Gabel zu reinigen, die Sie vom Verzehr von Rührei getrübt haben?
- Das Elektrodenpotential für die Reaktion Cu2+(aq) + 2e− → Cu(s) beträgt unter Standardbedingungen 0,34 V. Ist das Potential für die Oxidation von 0,5 Mol Cu gleich -0,34 / 2 V? Erklären Sie Ihre Antwort.
- Siehe Tabelle \(\pageIndex{1}\), um
- vorherzusagen, welche Spezies — Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) und / oder H2O2(aq) — unter Standardbedingungen MnO2(s) zu MNO4 oxidieren können.
- Welche Spezies – Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) und/ oder H2O2(aq) — ist das stärkste Oxidationsmittel in wässriger Lösung.
Konzeptionelle Antwort
- Nein; E° = -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply