CIMAVAKS-EGF: en ny terapeutisk vaccine mod fremskreden lungekræft
rapport
CIMAVAKS-EGF: en ny terapeutisk vaccine mod fremskreden lungekræft
Gisela Gones1, Agustin Lage1, Tania Crombet1, Gryssel Rodr Roses1, Beatrice Garcas1, Ariadna Cuevas1, Lisel vi Roses1, Norkis Arteaga1, Elia neninger2
1center for molekylær immunologi, cimave. 216 hjørne 15, Atabey, Playa, postkasse 16 040, Havana, Cuba
2hermanos Ameijeiras HospitalSan L Largo # 701 e / Belasco Largo, Centro Habana, Havana City, Cuba.resultaterne, der gør det muligt for det cubanske reguleringsagentur (CECMED) at give Sundhedsregistreringen til cimavaks-EGF-kræftvaccine til avanceret ikke-småcellet lungekræft (NSCLC) er vist. Dette var den første registrering af en terapeutisk vaccine på Cuba og også den første registrering af en lungekræftvaccine i verden. Derfor tilbydes en unik terapeutisk vaccine til lungekræftpatienter, hvilket vil øge overlevelsen og deres livskvalitet. Til dette formål skulle der stilles betydelige prækliniske, kliniske, lovgivningsmæssige, produktive og forhandlingsudfordringer. Resultaterne opnået på disse områder førte til 18 videnskabelige artikler offentliggjort i high impact tidsskrifter og 4 opfindelsesobjekter, der genererede flere patenter i Cuba og andre lande. I prækliniske omgivelser blev immunogenicitet, sikkerhed og antitumorale virkninger påvist hos forskellige dyrearter. Den kliniske erfaring begyndte i 1995. Indtil nu er fem fase I-II kliniske forsøg afsluttet på Cuba, to fase II er også afsluttet, et på Cuba og et andet i Canada og Storbritannien, og et fase II-III-forsøg med en optimeret tidsplan samt et fase III-forsøg er i øjeblikket i gang på Cuba. På det lovgivningsmæssige område blev der designet og udført en fast track-registreringsstrategi. Det krævede nye lovgivningsmæssige forestillinger for at udvikle dette unikke produkt. En skalerbar, reproducerbar og kontrolleret produktiv proces blev udført sammen med et kvalitetssystem, der sikrede fuld GMP-overholdelse. Midler til produktudvikling kom fra implementering af en ny forhandlingsstrategi: forhandling af immaterielle aktiver.
nøgleord: kræftvaccine, NSCLC, hurtig registrering, Cimavaks-EGF, Fase II-III klinisk forsøg
introduktion
forholdet mellem systemet dannet af Epidermal vækstfaktorreceptor (EGFR) og dets ligander med kræftudvikling er velkendt. I epidermoid Oprindelse tumorer er der en overekspression af EGFR, der vedrører dårlige prognoser og tidlige tilbagefald efter operationen. Derfor er dette system blevet et vigtigt mål for antitumorbehandlinger.
celleproliferationsmekanismer initieres med binding af EGF til EGFR. Vores terapeutiske tilgang består af en vaccine med en EGF-formulering, der gør den immunogen og inducerer et humoralt immunrespons. Produktionen af specifikke anti-EGF-antistoffer, der binder til den autologe EGF, forhindrer det i at binde til EGFR og derved udløse celleproliferationsmekanismerne afledt af denne interaktion (1-4).
Her rapporterer vi resultaterne af registreringen i Cuba af denne vaccine (Cimavaks-EGF). Dette var en del af en global strategi bestående af nye kliniske, lovgivningsmæssige og teknologiske og forretningsmæssige bidrag og understøttes af 18 internationale videnskabelige artikler og intellektuel ejendomsret over hele verden. Vi beskriver også innovationer inden for forskellige områder, der muliggjorde registrering af EGF i Cuba og Peru.
resultater og diskussion
Vaccination med EGF er sikker, immunogen og øger overlevelsen med en god livskvalitet hos patienter i fremskredne stadier lungekræft
den kliniske erfaring med Cimavaks-EGF i behandlingen af ikke-småcellet lungekræft (NSCLC) i avancerede stadier begyndte i 1995. Indtil nu er der afsluttet fem fase I-II kliniske forsøg på Cuba; 2 randomiserede fase II kliniske forsøg blev afsluttet, et på Cuba og et andet i Canada og Storbritannien, og der er et fase III-forsøg i gang på Cuba. Mere end 800 avancerede kræftpatienter er blevet behandlet med EGF, hvilket viser, at det er sikkert, immunogent og i stand til at øge overlevelsen med en god livskvalitet.
hovedformålet med Fase I-II-forsøgene var at bestemme den bedste vaccineformulering (bærerprotein og adjuvans), dosis og den terapeutiske tidsplan. Disse resultater viste fordelene ved p64k-proteinet som bærerproteinet og Montanid ISA51 som adjuvans. Den øgede immunogenicitet ved opskalering af dosis blev også påvist (5-7).
analysen af de samlede data fra alle Fase I-II-forsøg viste en signifikant stigning i overlevelse hos de patienter med bedre antistofrespons eller gode antistofresponser (GAR) og hos patienter med mere udtalt fald i SERA EGF-koncentrationer () som følge af vaccination. En signifikant stigning i overlevelse hos alle vaccinerede patienter blev også påvist sammenlignet med en samtidig historisk kontrol (7). et klinisk fase II-forsøg blev udført hos 80 patienter, som blev randomiseret til at modtage cimavaks-EGF og den bedste understøttende behandling (BSC) (40 patienter) eller BSC alene (40 patienter) efter afslutning af første linje kemoterapi. De tidligere resultater blev bekræftet i dette forsøg. Cirka 50% af de vaccinerede patienter var GAR og overlevede signifikant mere end patienter, der ikke nåede GAR-klassificeringen (som blev klassificeret som dårlige antistofresponsere, PAR). Tilsvarende overlevede patienter med det største fald i signifikant mere end patient, der ikke viste dette fald (tabel 1). Der blev observeret en signifikant invers korrelation mellem anti-EGF-antistoftitere og , som forekom hos vaccinerede patienter, men ikke i kontrollerne, hvilket viste, at det var forårsaget af vaccination (Figur 1).
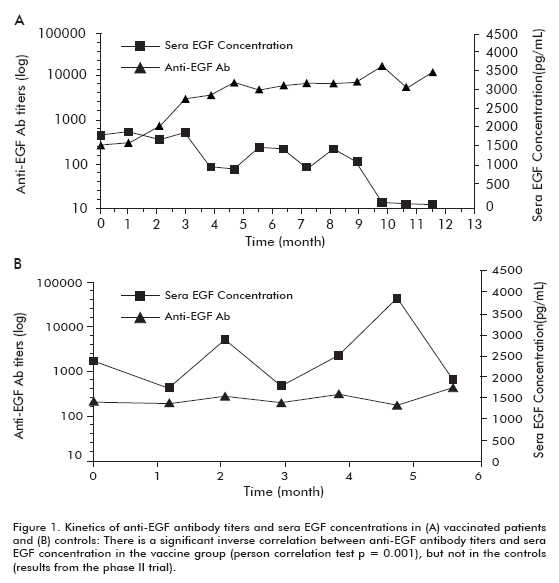
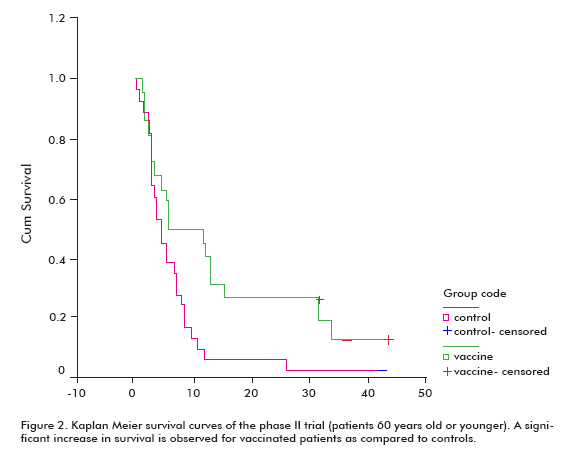
Der var en øget tendens i overlevelse hos alle vaccinerede patienter (18, 53 purpur 11, 47; gennemsnitlig purpur median) sammenlignet med de ikke-vaccinerede kontroller (7, 55 purpur 5.33), hvilket var signifikant i gruppen af patienter, der var 60 år eller yngre (Log rank test; p < 0,05) (figur 2) (8).
som det fremgår af en in vitro-konkurrenceanalyse, hæmmede sera fra vaccinerede patienter bindingen af EGF til EGFR. Denne bindingshæmning var proportional med antistoftitere og overlevelse. Derudover hæmmede sera fra vaccinerede patienter EGFR-phosphorylering i forhold til dets anti-EGF-antistoftitere.
præferencegenkendelsen af EGF / EGFR-bindingsstedet (loop B i EGF-molekylet) blev undersøgt. Patienter, hvis sera fortrinsvis genkender loop B, overlevede signifikant mere end patienter, der ikke genkendte denne epitop (9).
et dosis- / tidsplanoptimeringsforsøg blev for nylig afsluttet i Cuba (fase I-II). I sit design blev alle elementer, der øgede immunogeniciteten i tidligere forsøg, overvejet, hvilket omfattede: Montanide ISA51 som adjuvans øgede doser, fire injektionssteder og administration af to vaccinedoser før første linje kemoterapi efterfulgt af vaccination. Resultater fra dette forsøg viste en signifikant stigning i immunogenicitet, hvor en 95% af GAR nåede ti gange de tidligere maksimale antistoftitere. Alle vaccinerede patienter overlevede betydeligt mere end kontroller fra fase II-forsøget (10).
en øget kapacitet af Sera hos patienter til at hæmme EGF / EGFR-binding og EGFR-phosphorylering blev også fundet. I måned syv, efter afslutning af kemoterapi, skiftede antistofresponsen mod loop B i EGF-molekylet, hvilket kunne indikere en forbedring af kvaliteten af immunresponset. Resultaterne fra dette forsøg viste, at der er en forbedringsmargin i responsen på CIMAVAKS-EGF, som kan nås ved at manipulere dosis og den terapeutiske tidsplan (10).
resultaterne af disse forsøg valideres i et fase III-forsøg, der i øjeblikket er i gang på Cuba. Design og implementering af en regulerende strategi for vaccineregistrering for at gøre den tilgængelig for alle avancerede ikke-småcellede lungekræftpatienter
EGF er en terapeutisk vaccine mod lungekræft, der er unik i verden. En global strategi blev designet og implementeret; den blev styret af lovgivningsmæssige krav til Fast track-registrering i Cuba. Et tæt forhold mellem sponsoren (CIM) og det cubanske reguleringsagentur (CECMED) havde til formål at fastlægge kravene til opnåelse af et produkt og dets hurtige anvendelse til fordel for avancerede kræftpatienter uden noget andet terapeutisk alternativ. Denne strategi omfattede design af et kvalitetssystem, kvalitetskontrol og specifikationer samt GMP-krav til at dække de forskellige trin i produktudviklingen. Denne globale strategi kan bruges til udvikling af andre lignende produkter.
den akkumulerede lovgivningsmæssige erfaring og dokumentation førte til godkendelse af kliniske forsøg i forskellige lande. Dossieret med alle oplysninger gjorde det muligt at registrere EGF i Cuba og Peru. Vi kan derfor sige, at vi har en defineret strategi for narkotikaregistrering i forskellige lande.
GMP-produktionsprocessen, der genererer et produkt, der er skalerbart, konsistent og overholder specifikationerne
den første udfordring med at designe en produktionsproces for EGF var at have et immunogent EGF-præparat. Det blev opnået ved den kemiske konjugation af det humane rekombinante EGF til det rekombinante membranprotein, P64k (fra Neisseria meningitidis). Konjugatet injiceres sammen med en passende adjuvans (i øjeblikket Montanide ISA 51 Fra Seppic, Frankrig).
en proces i laboratorieskala blev oprindeligt designet. En opskalering (og skalerbar) sanitær og reproducerbar proces blev senere designet og implementeret i overensstemmelse med GMP-retningslinjerne. In vitro og in vivo analytiske analyser blev også designet og implementeret for at evaluere kvaliteten af råmaterialerne og mellem-og slutprodukterne.
alle ændringer blev vurderet og understøttet af den nuværende reguleringsstrategi. Resultater fra ækvivalensundersøgelsen, for at sammenligne begge produkter, modtog cecmeds godkendelse af den skalerede procesansøgning og godkendelsen af det produkt, der blev opnået i denne proces til dets kliniske anvendelse. Opskalering og optimering af produktionsprocessen gav plads til en publikation (11) og et nyt opfindelsesobjekt med patenter efterfølgende præsenteret i forskellige lande.
forhandling af immaterielle aktiver gav os midler til projektudvikling og også læringserfaring i vores fælles arbejde med regulerende myndigheder fra forskellige lande
Dette projekt blev forhandlet med udenlandske kolleger på grundlag af det nye koncept “forhandling af immaterielle aktiver”, støttet hovedsageligt gennem den intellektuelle ejendomsret til vores produkt, der var under udvikling. Denne forhandlingsstrategi bestod i at licensere projektet til dets fælles udvikling med andre lande, hvilket betyder, at de udenlandske kolleger dækkede udgifterne til lovgivningsmæssige handlinger og kliniske forsøg på deres territorier. Som et resultat af disse forhandlinger modtog Cuba betalinger for milepæle. Denne forhandlingsmodalitet gjorde det også muligt for os at have en konstant udveksling med specialister her og i udlandet og derved øge vores erfaring. Vores positive resultater med denne forhandlingsmodalitet kunne anvendes på andre produkter, der er i gang i vores land.
undersøgelsens relevans
CIMAVAKS-EGF er den første terapeutiske vaccine til kræftbehandling registreret i Cuba og den første registreret i verden til lungekræftbehandling. Lungekræft er et uløst sundhedsproblem med mere end 1,3 millioner tilfælde diagnosticeret hvert år og det samme antal dødsfald i hele verden. I Cuba er det den vigtigste dødsårsag på grund af kræft hos begge køn med en forekomst på mere end 4000 afdøde om året. Den valgte terapi til patienter, der er diagnosticeret i avancerede stadier, er førstelinjekemoterapi, som kan administreres samtidig med strålebehandling. Dette er en palliativ, ikke-kurativ behandling, hvor fuldstændig respons på kemoterapi er meget sjælden, og objektive reaktioner (fuldstændig eller delvis) forekommer hos kun 25% af patienterne.
EGF tilbyder en alternativ behandling til disse patienter, der allerede har modtaget kemoterapi i første linje. De alvorlige bivirkninger ved kemoterapi og / eller strålebehandling er velkendte og forværrer livskvaliteten alvorligt. I stedet genererer vaccination kun milde eller moderate, snarere end alvorlige, bivirkninger, der kan løses med konventionel understøttende pleje, samtidig med at overlevelsen af avancerede lungekræftpatienter forbedres og giver en god livskvalitet.
indtil nu er mere end 800 cubanere blevet behandlet med CIMAVAKS-EGF på mere end 20 hospitaler over hele landet. Registreringen af CIMAVAKS-EGF gør det muligt at udvide det til alle patienter i landet, der blev diagnosticeret med avanceret lungekræft; således gør Cuba til det første land i verden med et nationalt program ved hjælp af dette terapeutiske alternativ.
Med hensyn til økonomiske fordele har vi gennem forhandlingerne om dette projekt opnået 6.346 millioner USD. Forhandlingsstrategien for projektet er for dets fælles udvikling med andre lande, hvilket betyder, at den udenlandske modpart dækker udgifterne til de kliniske forsøg i deres eget land, hvilket gør det overkommeligt. Disse forsøg kræver investeringer på millioner af USD, og det er kun muligt, hvis det understøttes af udenlandske kolleger. Samtidig tilbyder denne strategi flere kliniske data til Cuba uden udgifter til at gennemføre forsøgene her. Indtil nu er der udført kliniske forsøg i Canada, Storbritannien og Malaysia. I den nærmeste fremtid vil kliniske forsøg begynde i Kina og Europa.
som en del af denne licensstrategi er de udenlandske kolleger også ansvarlige for produktregistrering i de regioner, hvor de har kommercielle rettigheder. Under registrerings-og marketingprocesserne vil Cuba modtage betalinger for milepæle og senere, som salgs royalties.
verdensmarkedet for kræftvacciner anses for at være i størrelsesordenen milliarder USD. Det faktum, at Cuba har et unikt produkt til avanceret lungekræftbehandling, kan give os et eksportpotentiale, der kan finansiere brugen af dette produkt i vores nationale sundhedssystem.
konklusioner
Vaccination med Cimavaks-EGF er sikker, immunogen og fører til en stigning i overlevelse med en god livskvalitet hos patienter med lungetumorer i avancerede stadier. Udformningen og implementeringen af en reguleringsstrategi til registrering af denne vaccine gjorde den tilgængelig
for alle tilfælde af avancerede ikke-småcellede lungekræftpatienter i Cuba. Denne positive erfaring kunne være gældende for andre lignende produkter i gang. Der blev udviklet en produktionsproces, som var skalerbar, konsistent og reproducerbar og overholdt GMP-retningslinjerne for at generere et produkt, der overholder specifikationerne. Erfaringerne med forhandling af immaterielle aktiver har været meget positive og har givet os midler til projektudvikling, samtidig med at de understøtter den læringserfaring, der stammer fra fælles arbejde med de regulerende myndigheder i forskellige lande.
anerkendelser
forfatterne vil gerne takke følgende specialister fra Center for Molekylær Immunologi for deres bidrag til dette arbejde: Det er en af de mest populære og mest populære måder at gøre dette på, men det er ikke en god ide at gøre det på, og det er en god måde at gøre det på, men det er ikke en god ide at gøre det på en måde, der gør det muligt for dig at gøre det på en eller anden måde alle af dem fra centrum af Molekylær Immunologi, og også til Daniel, er en af de mest populære måder at gøre dette på Vivian Pujol, Dinorah Torres fra Center for genteknologi og Bioteknologi.
1. En af de mest almindelige årsager til denne sygdom er, at en person er i stand til at bestemme, om han eller hun er i stand til at bestemme, om han eller hun skal være i stand til at udføre en sådan handling. Autoimmun Rev 2002; 1: 89-95.
2. Målretning mod epidermal vækstfaktorreceptor signalering: tidlige resultater og fremtidige tendenser inden for onkologi. Ann Med 2003;5(35):327-36.
3. Kræftvacciner mod hormon-immun-Deprivation: EGF-Vaccinemetoden: førende emner inden for Kræftforskning, Kapitel 11, Ed Nova Publishers, 2007.
4. Kræftvacciner til hormon / vækstfaktor immun deprivation: en gennemførlig tilgang til kræftbehandling. Curr Kræft Drug Mål 2007; 7: 229-41.
5. G, Crombet T, Torres F, Catala M, Alfonso L, Osorio M, et al. Epidermal Vækstfaktorbaseret kræftvaccine til ikke-småcellet lungekræftbehandling. Ann Oncol 2003; 14: 461-6.
6. Crombet T, Neninger E, Catalyst m, Garcia B, Leonard i, Martinus L, et al. Behandling af NSCLC-patienter med en EGF-baseret kræftvaccine. Rapport om et fase i-forsøg. Kræft Biol Ther 2006; 5 (2): 136-41.
7. Terapeutisk vaccination med epidermal vækstfaktor (EGF) i avanceret lungekræft: analyse af poolede data fra tre kliniske forsøg. Hum Vacciner 2007;3(1):8-13.
8. Neninger E, De La Torre A, Osorio M, Catald M, Bravo I, m, Et Al. Fase II randomiseret kontrolleret forsøg med en epidermal vækstfaktorvaccine i avanceret ikke-småcellet lungekræft. J Clin Oncol 2008; 26: 1452-8.
9. Garca B, Neninger E, De La Torre A, Leonard I, Martinus R, Viada C, et al. Effektiv hæmning af Epidermal vækstfaktor/Epidermal Vækstfaktorreceptorbinding af anti-Epidermal Vækstfaktorantistoffer er relateret til bedre overlevelse hos avancerede ikke-småcellede lungecancerpatienter behandlet med Epidermal Vækstfaktorvaccine. Clin Kræft Res 2008; 14(3):840-6.
10. Neninger E, Verdecia BG, Crombet T, Viada C, Pereda S, Leonard i, et al. Kombination af en EGF – baseret kræftvaccine med kemoterapi i avanceret ikke-småcellet lungekræft. J Immunother 2009;32: 92-9.
11. A, A, A, A, A, A, A, A, A, A, A, et al. Fremstillingsproces udvikling for en epidermal vækstfaktor baseret kræftvaccine. Bio-pharm Int, vacciner Suppl, okt 2008.
Leave a Reply