Carbon: det væsentlige
Carbon er et Gruppe 14-element og distribueres meget bredt i naturen. Det findes i overflod i solen, stjerner, kometer og atmosfærer på de fleste planeter. Kulstof er til stede som kulsyre i atmosfæren og opløst i alle naturlige farvande. Det er en bestanddel af sten som carbonater af calcium (kalksten), magnesium og jern. Atmosfæren i Mars er meget tynd, men hvad der er Indeholder omkring 95% CO2.
kul, råolie og naturgas er hovedsagelig kulbrinter. Kulstof er unikt blandt elementerne i det store antal forskellige forbindelser, det kan danne. Organisk kemi, en 1 / 112.delmængde af uorganisk kemi, er undersøgelsen af kulstof og dets forbindelser. Mens silicium kan træde i stedet for kulstof ved dannelse af en række beslægtede forbindelser, er det i øjeblikket ikke muligt at danne stabile forbindelser med meget lange kæder af siliciumatomer.kulstof findes frit i naturen i tre allotrope former: amorf, grafit og diamant. Grafit er et af de blødeste kendte materialer, mens diamant er et af de sværeste. Kulstof, som mikroskopiske diamanter, findes i nogle meteoritter. Naturlige diamanter findes i gamle vulkanske ” rør ” som findes i Sydafrika. Diamanter udvindes også fra havbunden ud for Kap Det Gode Håb.

en diamantring.
for nylig blev en anden form for kulstof, Buckminsterfulleren, C60, opdaget. Denne form for kulstof er genstand for stor interesse i forskningslaboratorier i dag.
rent kulstof er tilgængeligt i en række forskellige former (allotroper). Den mest almindelige form for rent kulstof er kur-grafit. Dette er også den termodynamisk mest stabile form. Diamant er en anden form for kulstof, men er meget mindre almindelig. Andre former for kulstof inkluderer fullerenerne. Mens diamant og grafit er uendelige gitter, fullerener såsom Buckminsterfulleren, C60, er en diskret molekylær Art. Amorfe former for kulstof, såsom sod og lampesort, er materialer, der består af meget små partikler af grafit.
de fleste grafit er Kris-grafit og det besidder en lagstruktur, hvor hver carbon er direkte bundet til tre andre carbonatomer i en afstand af 141,5 pm. Delokalisering i bindingen er tydelig, da C-C-afstandene er ens og kortere end normale carbon-carbon-enkeltbindinger (typisk 154 pm). Afstanden mellem lagene af carbonatomer er 335,4 pm. I de fleste grafit (Kurt-grafit) er lagene af atomer arrangeret i en ABABAB… gentag mode, men den kroatiske form (rhombohedral) stablingen er ABCABCABC… selvom kulstof-kulstofafstandene og mellemlagsafstanden forbliver den samme som i LARP-formen. Enthalpi-forskellen mellem Kurt-og Kurt-grafit er mindre end 1 kJ mol-1 (0,59 Kurt 0,17 kJ mol-1. Former af de tungere grundstoffer, der svarer til grafit, er ikke kendt, og strukturerne af silicium, germanium og grå tin er relateret til diamantstrukturen (nedenfor).

atomarrangementer i de mest almindelige tildelinger af kulstof: kur-grafit.
da diamant har en lidt mere kompakt struktur, er dens densitet større end grafit. Udseendet af diamant er velkendt, og det er også et af de hårdeste materialer, der er kendt. Ligesom grafit er det relativt ureaktivt, men brænder i luft ved 600-800 liter C. Hvert carbonatom er bundet til fire naboer i en afstand af 154.45 pm på en tetrahedral måde, og derfor er hver diamantkrystal en enkelt kæmpe gitterstruktur. I princippet (og i praksis!) grafit kan omdannes til diamant ved anvendelse af varme og tryk. Enhedscellen af diamant er kubisk med a = 356,68 pm. Næsten alle diamanter besidder denne struktur, men en meget lille procentdel viser en sekskantet struktur relateret til lonsdaleite, og disse kaldes lonsdaleite.

krystal strucutres af diamant.
for nylig blev en anden allotrope af kulstof karakteriseret. Mens diamant og grafit er uendelige gitter, buckminsterfullerene, C60, er en diskret molekylær Art. Buckminsterfullerene molekylet er et net af 12 pentagoner og 20 sekskanter foldet ind i en kugle. Effekten ligner meget kludetæppet på 12 femkantede og 20 sekskantede stykker læder, der sys sammen, udgør en foreningsfodbold (fodbold). Navnet buckminsterfullerene (eller buckyball blev opfundet på grund af forholdet mellem strukturen af C60 og R. Buckminster Fullers geodesiske kuppeldesign. Buckminsterfullerene er nu kommercielt tilgængelig og er også blevet identificeret i interstellært rum og sod.
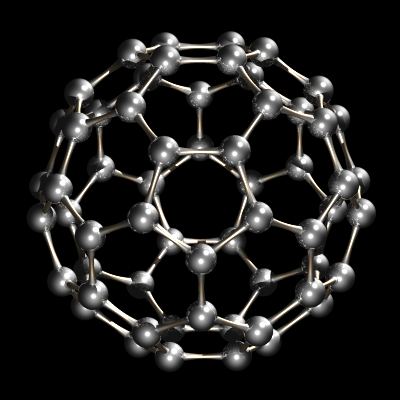
C60, Buckminsterfullerene.
andre fullerener (lukkede kulstofbure) såsom C60 og C84 er også kendt og inded tilgængelige kommercielt. Den mindste fulleren muligt er dodecahedral C20, bestående af 12 pentagoner og ingen sekskanter overhovedet. Nanorør er relateret til fullerener. De er rør, der giver udseendet af rullet grafit, selvom de er lavet af grafit. De er åbne, mens fullerener er lukkede strukturer.
et interessant træk ved fullerener er deres evne til at omslutte atomer såsom kalium og andre alkalimetaller for at fremstille endohedrale strukturer betegnet som K@C60.
i 1961 vedtog International Union of Pure and Applied Chemistry (IUPAC) isotopen 12c som grundlag for atomvægte. Carbon-14, 14C, en isotop med en halveringstid på 5730 år, bruges til at datere sådanne materialer som træ, arkæologiske prøver osv. Carbon-13, 13C, er især nyttig til isotopiske mærkningsundersøgelser, da den ikke er radioaktiv, men er en spin I = 1/2 kerne og derfor en god NMR kerne.
Leave a Reply