biologi for Majors i
læringsresultater
- Identificer komponenterne i enkle kemiske reaktioner
alle elementer er mest stabile, når deres yderste skal er fyldt med elektroner i henhold til oktetreglen. Dette skyldes, at det er energisk gunstigt for atomer at være i den konfiguration, og det gør dem stabile. Men da ikke alle elementer har nok elektroner til at fylde deres yderste skaller, danner atomer kemiske bindinger med andre atomer og derved opnår de elektroner, de har brug for for at opnå en stabil elektronkonfiguration. Når to eller flere atomer binder kemisk med hinanden, er den resulterende kemiske struktur et molekyle. Det velkendte vandmolekyle, H2O, består af to hydrogenatomer og et iltatom; disse binder sammen for at danne vand, som illustreret i Figur 1. Atomer kan danne molekyler ved at donere, acceptere eller dele elektroner for at fylde deres ydre skaller.
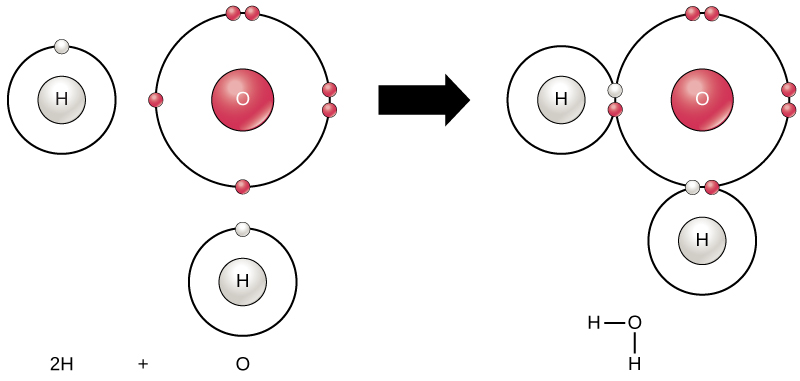
Figur 1. To eller flere atomer kan binde sig til hinanden for at danne et molekyle. Når to hydrogener og et ilt deler elektroner via kovalente bindinger, dannes et vandmolekyle.
kemiske reaktioner opstår, når to eller flere atomer binder sammen for at danne molekyler, eller når bundne atomer brydes fra hinanden. De stoffer, der anvendes i begyndelsen af en kemisk reaktion kaldes reaktanterne (normalt findes på venstre side af en kemisk ligning), og de stoffer, der findes i slutningen af reaktionen, er kendt som produkterne (normalt findes på højre side af en kemisk ligning). En pil trækkes typisk mellem reaktanterne og produkterne for at indikere retningen for den kemiske reaktion; denne retning er ikke altid en “envejsgade.”For oprettelsen af vandmolekylet vist ovenfor ville den kemiske ligning være:
2H + O liter H2O
et eksempel på en simpel kemisk reaktion er nedbrydning af brintoverilte molekyler, som hver består af to hydrogenatomer bundet til to iltatomer (H2O2). Reaktanten brintoverilte nedbrydes i vand, der indeholder et iltatom bundet til to brintatomer (H2O) og ilt, der består af to bundne iltatomer (O2). I ligningen nedenfor omfatter reaktionen to brintoverilte-molekyler og to vandmolekyler. Dette er et eksempel på en afbalanceret kemisk ligning, hvor antallet af atomer i hvert element er det samme på hver side af ligningen. Ifølge loven om bevarelse af stof skal antallet af atomer før og efter en kemisk reaktion være ens, således at ingen atomer under normale omstændigheder skabes eller ødelægges.
2h2o2 (brintoverilte) liter 2H2O(vand) + O2 (ilt)
selvom alle reaktanter og produkter fra denne reaktion er molekyler (hvert atom forbliver bundet til mindst et andet atom), er kun brintoverilte og vand i denne reaktion repræsentative for en underklasse af molekyler kendt som forbindelser: de indeholder atomer af mere end en type element. Molekylært ilt består derimod som vist i figur 2 af to dobbeltbundne iltatomer og klassificeres ikke som en forbindelse, men som et element.
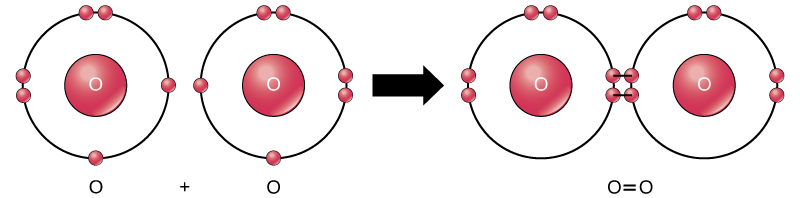
figur 2. Iltatomerne i et O2-molekyle er forbundet med en dobbeltbinding.
nogle kemiske reaktioner, såsom den ovenfor viste, kan fortsætte i en retning, indtil reaktanterne alle er opbrugt. Ligningerne, der beskriver disse reaktioner, indeholder en ensrettet pil og er irreversible. Reversible reaktioner er dem, der kan gå i begge retninger. I reversible reaktioner omdannes reaktanter til produkter, men når koncentrationen af produktet går ud over en bestemt tærskel (karakteristisk for den særlige reaktion), omdannes nogle af disse produkter tilbage til reaktanter; på dette tidspunkt vendes betegnelserne for produkter og reaktanter. Dette frem og tilbage fortsætter, indtil der opstår en vis relativ balance mellem reaktanter og produkter—en tilstand kaldet ligevægt. Disse situationer med reversible reaktioner betegnes ofte ved en kemisk ligning med en dobbeltpil, der peger mod både reaktanterne og produkterne.
for eksempel binder overskydende hydrogenioner (H+) i humant blod til bicarbonationer (HCO3–), der danner en ligevægtstilstand med kulsyre (H2CO3). Hvis kulsyre blev tilsat til dette system, ville noget af det blive omdannet til bicarbonat og hydrogenioner.
HCO3– + h+ liter H2CO3
i biologiske reaktioner opnås imidlertid ligevægt sjældent, fordi koncentrationerne af reaktanterne eller produkterne eller begge ændrer sig konstant, ofte med et produkt af en reaktion som en reaktant for en anden. For at vende tilbage til eksemplet med overskydende hydrogenioner i blodet vil dannelsen af kulsyre være hovedretningen af reaktionen. Kulsyren kan dog også forlade kroppen som kulsyre (via udånding) i stedet for at blive omdannet tilbage til bicarbonation og dermed drive reaktionen til højre ved den kemiske lov kendt som lov om massehandling. Disse reaktioner er vigtige for at opretholde homeostasen af vores blod.
HCO3 – + H + liter H2CO3 liter CO2 + H2O
i Sammendrag: Kemiske reaktioner og molekyler
den ydre elektronskal dikterer, hvor let og hvilken type kemiske bindinger et bestemt atom vil danne. Dannelsen af forbindelser er ofte visuelt skitseret i kemiske ligninger, der viser de reaktanter, der deltager i kemiske reaktioner for at danne produkter.
prøv det
bidrage!
forbedre denne sidelær mere
Leave a Reply