1.14: skelne mellem pH og pKa
relativ surhed og pKa værdier
en anvendelse af Henderson-Hasselbach ligningen er evnen til at bestemme den relative surhed af forbindelser ved at sammenligne deres pKa værdier. Jo stærkere en syre, jo større ionisering, jo lavere pKa, og jo lavere pH forbindelsen vil producere i opløsning. Nogle udvalgte pKa-værdier for forbindelser i undersøgelsen af organisk kemi er vist nedenfor. Da organiske reaktioner kan udføres i ikke-vandige miljøer, kan pH overstige 14, og organiske forbindelser kan have pKa-værdier over 16. Det er en variation på denne linje fra guiden af OSE, ” vi lever ikke længere i vand.”





det er en meget god ide at forpligte sig til at huske de omtrentlige pKa-intervaller for Forbindelserne ovenfor. Et ord af forsigtighed: når du bruger PKA-tabellen, skal du være helt sikker på, at du overvejer det korrekte konjugatsyre/basepar. Hvis du bliver bedt om at sige noget om ammoniakens basicitet (NH3) sammenlignet med ethyl-ion (CH3CH2O -), er de relevante pKa-værdier, der skal overvejes, 9,2 (PKA af ammoniumion) og 16 (PKA af ethanol). Fra disse tal ved du, at ætsilte er den stærkere base. Gør ikke fejlen ved at bruge pKa-værdien på 38: Dette er PKA af ammoniak, der virker som en syre, og fortæller dig, hvor grundlæggende NH2 – ion er (meget grundlæggende!)
* en note om PKA af vand: PKa af vand er 14. Biokemi og organiske kemitekster angiver ofte værdien som 15,7. Disse tekster har fejlagtigt indregnet den molære værdi for koncentrationen af vand i ligevægtskonstanten. Den korrekte afledning af ligevægtskonstanten involverer vandets aktivitet, som har en værdi på 1.
eksempel
mens dette kursus begynder med enkeltfunktionelle grupper, vil vi til sidst arbejde med interessante forbindelser, der indeholder flere funktionelle grupper. At anerkende hvilke hydrogener der kan ioniseres som sure protoner, og hvilke hydrogener ikke kan, er en nyttig færdighed. Bemærk i dette eksempel, at vi skal evaluere den potentielle surhed på fire forskellige steder på molekylet.
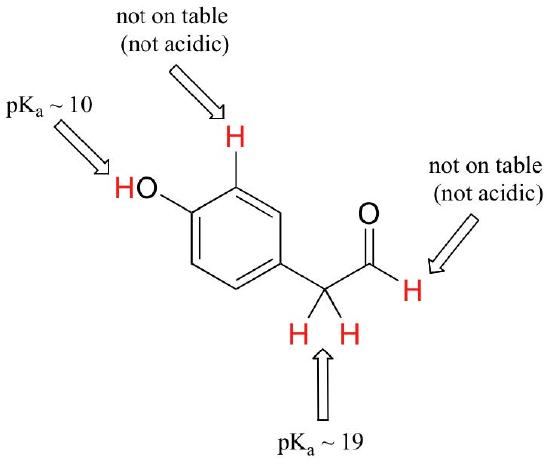
aldehyd og aromatiske protoner er slet ikke sure (pkavaluer er over 40 – ikke på vores bord). De to protoner på kulstoffet ved siden af carbonylen er let sure med pKa-værdier omkring 19-20 ifølge tabellen. Den mest sure proton er på phenolgruppen, så hvis forbindelsen skulle udsættes for en enkelt molær ækvivalent med stærk base, er dette protonen, der ville blive doneret.
Acid& grundlæggende miljøer – alt er relativt i reaktivitet
fordi vores mål er at forstå dynamisk kemisk reaktivitet, behøver vi ikke at kende den specifikke mængde af de protonerede og uprotonerede former for en forbindelse. Vi skal blot vide, hvilken form der dominerer. Når miljøets pH er mindre end forbindelsens pKa, betragtes miljøet som surt, og forbindelsen vil overvejende eksistere i sin protonerede form. Når miljøets pH er større end forbindelsens pKa, betragtes miljøet som basisk, og forbindelsen vil overvejende eksistere i sin deprotonerede form.
for eksempel er PKA af eddikesyre omkring 5. Ved en pH på 1, miljøet betragtes som surt, og eddikesyre findes overvejende i sin protonerede form. Ved pH 8 betragtes miljøet som basisk, og eddikesyre deprotoneres til dannelse af acetat (CH3CO2-). Omvendt er PKA af phenol 10. Ved pH 8 betragtes miljøet som surt for phenol, og det forbliver primært protoneret.
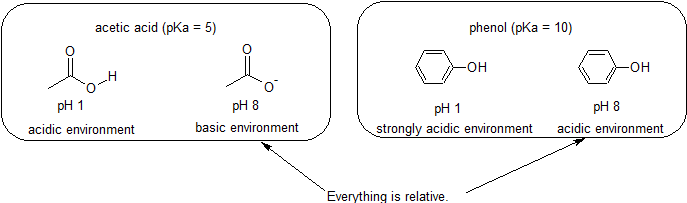
det er også vigtigt at huske, at organisk kemi ikke behøver at forekomme i vand, så pKa-værdier kan være så høje som 50.
øvelse
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
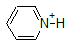 |
 |
 |
 |
 |
 |
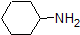 |
 |
 |
 |
 |
 |
 |
 |
 |
Leave a Reply