jämföra styrkor av oxidanter och reduktionsmedel
inlärningsmål
- identifiera hur man ser Standard Reduktionspotentialer ur perspektivet av livskraftiga reducerande och oxidationsmedel i redoxreaktioner.
Vi kan mäta standardpotentialerna för en mängd olika kemiska ämnen, av vilka några är listade i tabell P2. Dessa data tillåter oss att jämföra de oxidativa och reduktiva styrkorna hos en mängd olika ämnen. Halvreaktionen för standardväteelektroden (SHE) ligger mer än halvvägs ner i listan i tabell \(\PageIndex{1}\). Alla reaktanter som ligger under She i tabellen är starkare oxidanter än H+, och alla de som ligger ovanför SHE är svagare. Den starkaste oxidanten i tabellen är F2, med en standardelektrodpotential på 2,87 V. Detta höga värde överensstämmer med fluorens höga elektronegativitet och berättar att fluor har en starkare tendens att acceptera elektroner (det är en starkare oxidant) än något annat element.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g) + 2e−\(\rightleftharpuner\) 2F−(aq) | 2.87 |
inte alla oxidationsmedel och reduktionsmedel skapas lika. Standardreduktionspotentialerna i tabell \(\PageIndex{1}\) kan tolkas som en rangordning av ämnen enligt deras oxiderande och reducerande effekt. Starka oxidationsmedel är vanligtvis föreningar med element i höga oxidationstillstånd eller med hög elektronegativitet, som får elektroner i redoxreaktionen (figur \(\PageIndex{1}\)). Exempel på starka oxidationsmedel innefattar väteperoxid, permanganat och osmiumtetroxid. Reduktionsmedel är vanligtvis elektropositiva element såsom väte, litium, natrium, järn och aluminium, som förlorar elektroner i redoxreaktioner. Hydrider (föreningar som innehåller väte i det formella oxidationstillståndet -1), såsom natriumhydrid, natriumborhydrid och litium aluminiumhydrid, används ofta som reduktionsmedel i organiska och organometalliska reaktioner.
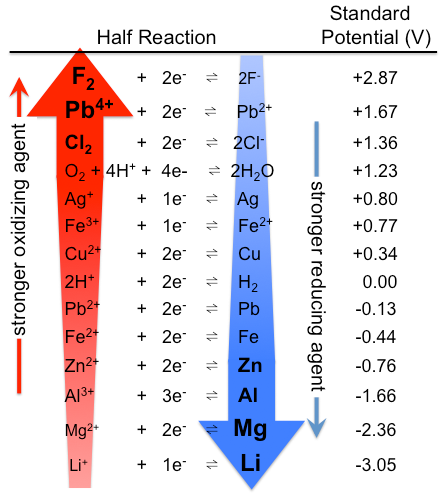
figur \(\PageIndex{1}\): Tabell över standardelektrodpotentialer. Observera att rankningen är motsatt här, med starka oxidationsmedel längst upp och starka reduktionsmedel längst ner, än i tabell \(\PageIndex{1}\). De faktiska standardpotentialerna är naturligtvis desamma. (CC BY-SA 3.0; Tem5psu).
På samma sätt är alla arter i tabell \(\PageIndex{1}\) som ligger över H2 starkare reduktionsmedel än H2, och de som ligger under H2 är svagare. Det starkaste reduktionsmedlet i tabellen är således metalliskt litium, med en standardelektrodpotential på -3,04 V. detta faktum kan vara överraskande eftersom cesium, inte litium, är det minst elektronegativa elementet. Den uppenbara anomali kan förklaras av det faktum att elektrodpotentialer mäts i vattenlösning, där intermolekylära interaktioner är viktiga, medan joniseringspotentialer och elektronaffiniteter mäts i gasfasen. På grund av sin lilla storlek stabiliseras Li+ – Jonen i vattenlösning genom starka elektrostatiska interaktioner med den negativa dipoländen av vattenmolekyler. Dessa interaktioner resulterar i en signifikant större Acihhydrering för Li+ jämfört med Cs+. Litiummetall är därför det starkaste reduktionsmedlet (lättast oxiderat) av alkalimetallerna i vattenlösning.
standardreduktionspotentialerna kan tolkas som en rangordning av ämnen enligt deras oxiderande och reducerande effekt. Arter i tabell \(\PageIndex{1}\) som ligger över H2 är starkare reduktionsmedel (lättare oxiderade) än H2. Arter som ligger under H2 är starkare oxidationsmedel.
eftersom de halvreaktioner som visas i tabell \(\PageIndex{1}\) är ordnade i ordning efter deras e-värden kan vi använda tabellen för att snabbt förutsäga de relativa styrkorna hos olika oxidanter och reduktionsmedel. Alla arter på vänster sida av en halvreaktion oxiderar spontant alla arter på höger sida av en annan halvreaktion som ligger under den i tabellen. Omvänt kommer alla arter på höger sida av en halvreaktion spontant att minska alla arter på vänster sida av en annan halvreaktion som ligger ovanför den i tabellen. Vi kan använda dessa generaliseringar för att förutsäga spontaniteten hos ett brett utbud av redoxreaktioner (e kubi cell > 0), som illustreras i exempel \(\PageIndex{1}\).
exempel \(\PageIndex{1}\): silversulfid
den svarta tarnishen som bildas på silverobjekt är främst Ag2S. halvreaktionen för att vända tarnishing-processen är som följer:
- med hänvisning till tabell \(\PageIndex{1}\), förutsäga vilka arter—H2O2(aq), Zn(s), I−(aq), Sn2+(aq)—kan minska Ag2S till Ag under normala förhållanden.
- av dessa arter-H2O2(aq), Zn(s), I−(aq), Sn2+(aq), identifiera vilket är det starkaste reduktionsmedlet i vattenlösning och därmed den bästa kandidaten för en kommersiell produkt.
- från data i tabell \(\PageIndex{1}\), föreslå ett alternativt reduktionsmedel som är lättillgängligt, billigt och eventuellt mer effektivt för att ta bort tarnish.
givet: reduktionshalvreaktion, standardelektrodpotential och lista över möjliga reduktionsmedel
bad om: reduktionsmedel för Ag2S, starkaste reduktionsmedel och potentiellt reduktionsmedel för att ta bort tarnish
strategi:
A från sina positioner i tabell \(\PageIndex{1}\), Bestäm vilka arter som kan minska Ag2S. Bestäm vilken art som är den starkaste reduktionsmedlet.
B använd tabell \(\PageIndex{1}\) för att identifiera ett reduktionsmedel för Ag2S som är en vanlig hushållsprodukt.
lösning
vi kan lösa problemet på ett av två sätt: (1) jämför de relativa positionerna för de fyra möjliga reduktionsmedlen med den för Ag2S/Ag-paret i tabell \(\PageIndex{1}\) eller (2) jämför e cu för varje art med e cu för Ag2S/Ag-paret (-0,69 V).
- a arten i tabell \(\PageIndex{1}\) är ordnade från topp till botten för att öka reducerande styrka. Av de fyra arter som anges i problemet ligger I−(aq), Sn2+(aq) och H2O2(aq) ovanför Ag2S, och en ligger under den. Vi kan därför dra slutsatsen att Zn (s) kan minska Ag2S(s) under standardvillkor, medan I−(aq), Sn2+(aq) och H2O2(aq) inte kan. Sn2+(aq) och H2O2(aq) visas två gånger i tabellen: på vänster sida (oxidant) i en halvreaktion och på höger sida (reduktant) i en annan.
- den starkaste reduktionsmedlet är Zn( s), arten på höger sida av halvreaktionen som ligger närmare botten av tabellen \(\PageIndex{1}\) än halvreaktionerna som involverar I-(aq), Sn2+(aq) och H2O2(aq). (Kommersiella produkter som använder en bit zink marknadsförs ofta som en” mirakelprodukt ” för att ta bort smuts från silver. Allt som krävs är att tillsätta varmt vatten och salt för elektrisk ledningsförmåga.)
- b av reduktionsmedlen som ligger under Zn (s) i tabell \(\PageIndex{1}\), och därför är starkare reduktionsmedel, är endast en allmänt tillgänglig i hushållsprodukter: Al(s), som säljs som aluminiumfolie för förpackning av livsmedel.
exempel \(\PageIndex{2}\):
använd data i tabell \(\PageIndex{1}\) för att avgöra om varje reaktion sannolikt kommer att inträffa spontant under standardvillkor:
- Sn(s) + Be2+(aq) resp.SN2+(aq) + Be(s)
- MnO2(s) + H2O2(aq) + 2h+(aq) O2(g) + MN2+(aq) + 2H2O(l)
given: redoxreaktion och lista över standardelektrodpotentialer (tabell P2)
bad om: reaktionssontanitet
strategi:
- identifiera halvreaktionerna i varje ekvation. Använd tabell \(\PageIndex{1}\) och bestäm standardpotentialerna för halvreaktionerna i lämplig riktning.
- använd ekvationen \(E_{cell}=e^o_{srp}(katod) – e^o_{srp}(anod)\) för att beräkna standardcellspotentialen för den totala reaktionen. Från detta värde bestämmer du om den totala reaktionen är spontan.
lösning
- en metallisk tenn oxideras till Sn2+(aq) och Be2+(aq) reduceras till elementärt beryllium. Vi kan hitta standardelektrodpotentialerna för den senare (reduktion) halvreaktionen (-1.85 V) och för den tidigare (oxidation) halvreaktionen (-0,14 V) direkt från tabell \(\PageIndex{1}\).
b Att lägga till de två halvreaktionerna ger den totala reaktionen:
|
\(\textrm{katod:} \; \mathrm{be^{2+}(aq)} +\mathrm{2e^ -} \rightarrow \mathrm{be(S)}\) \(\textrm{anod:} \; \mathrm{sn(s) \rightarrow \mathrm{SN^{2+}}(s)} +\mathrm{2E^ -}\) \(\textrm{totalt:} \; \mathrm{Sn(s)+ \mathrm{Be^{2+}(aq)} \rightarrow \mathrm{Sn^{2+}}(aq)} + \mathrm{Be(s)}\) |
\(E^\circ_{\textrm{katod}}=\textrm{-1.99 V} \\ E^\circ_{\textrm{anod}}=\textrm{-0.14 v} \\ e^\Circ_{\textrm{cell}}=e^\circ_{\textrm{katod}}-e^\circ_{\textrm{anod}} \\ \hspace{5mm} =-\textrm{1.85 v}\) |
standardcellspotentialen är ganska negativ, så reaktionen kommer inte att ske spontant som skrivet. Det vill säga metalliskt tenn kan inte reducera Be2+ till berylliummetall under standardförhållanden. Istället kommer den omvända processen, reduktionen av stannösa joner (Sn2+) med metalliskt beryllium, som har ett positivt värde av e-jacobcellen, att ske spontant.
- A MnO2 är oxidationsmedlet (Mn4+ reduceras till Mn2+), medan H2O2 är reduktionsmedlet (O2− oxideras till O2). Vi kan få standardelektrodpotentialerna för reduktions-och oxidationshalvreaktioner direkt från tabell \(\PageIndex{1}\) .
b de två halvreaktionerna och deras motsvarande potentialer är följande:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ E^\circ_{\textrm{anod}}=\textrm{0,70 V} \\ E^\circ_{\textrm{cell}}=E^\circ_{\textrm{katod}}-E^\circ_{\textrm{anod}} \\ \hspace{5mm} =-\textrm{0,53 v}\) |
Standardpotentialen för reaktionen är positiv, vilket indikerar att det under normala förhållanden kommer att ske spontant som skrivet. Väteperoxid kommer att minska MnO2, och syrgas kommer att utvecklas från lösningen.
övning \(\PageIndex{2}\)
använd data i tabell \(\PageIndex{1}\) för att avgöra om varje reaktion sannolikt kommer att inträffa spontant under standardvillkor:
- 2Ce4+(aq) + 2Cl−(aq) 2ce3+(aq) + Cl2(g)
- 4MnO2(s) + 3O2(g) + 4oh−(aq) 6mno4−(aq) + 2H2O
svar
- spontan (e 0,36 v = 0,36 v)
- nonspontan (e 0,0.20 V)
även om tecknet på e-cellen säger oss om en viss redoxreaktion kommer att ske spontant under normala förhållanden, berättar den inte i vilken utsträckning reaktionen fortskrider, och den berättar inte vad som kommer att hända under icke-standardiserade förhållanden. För att besvara dessa frågor krävs en mer kvantitativ förståelse av förhållandet mellan elektrokemisk cellpotential och kemisk termodynamik.
sammanfattning
de relativa styrkorna hos olika oxidanter och reduktionsmedel kan förutsägas med användning av e-värden. De oxidativa och reduktiva styrkorna hos en mängd olika ämnen kan jämföras med hjälp av standardelektrodpotentialer. Uppenbara anomalier kan förklaras av det faktum att elektrodpotentialer mäts i vattenlösning, vilket möjliggör starka intermolekylära elektrostatiska interaktioner och inte i gasfasen.
konceptuella problem
- ordningen på elektrodpotentialer kan inte alltid förutsägas av joniseringspotentialer och elektronaffiniteter. Varför? Förväntar du dig att natriummetall har en högre eller en lägre elektrodpotential än vad som förutses från dess joniseringspotential? Vad är dess ungefärliga elektrodpotential?
- utan att hänvisa till tabelldata, av Br2 / Br -, Ca2+ / Ca, O2 / OH – och Al3+ / Al, vilken skulle du förvänta dig att ha minst negativ elektrodpotential och vilken mest negativ? Varför?
- på grund av de svavelinnehållande aminosyrorna som finns i äggvita, äter ägg med en silvergaffel gaffeln. Som kemist har du alla typer av intressanta rengöringsprodukter i ditt skåp, inklusive en 1 M lösning av oxalsyra (H2C2O4). Skulle du välja den här lösningen för att rengöra gaffeln som du har tarnished från att äta äggröra?
- elektrodpotentialen för reaktionen Cu2 + (aq) + 2e− CU(s) är 0,34 V under normala förhållanden. Är potentialen för oxidation av 0,5 mol Cu lika med -0,34/2 V? Förklara ditt svar.
- se tabell \(\PageIndex{1}\) för att förutsäga
- vilka arter—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) och/eller H2O2(aq)—kan oxidera MnO2(s) till MNO4− under normala förhållanden.
- vilka arter-Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) och/eller H2O2(aq)—är det starkaste oxidationsmedlet i vattenlösning.
konceptuellt svar
- nej; e691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply