Compararea punctelor forte ale oxidanților și Reductanților
obiective de învățare
- identificați modul de vizualizare a potențialelor de reducere Standard din perspectiva agenților viabili de reducere și oxidare în reacțiile REDOX.
putem măsura potențialele standard pentru o mare varietate de substanțe chimice, dintre care unele sunt enumerate în tabelul P2. Aceste date ne permit să comparăm punctele forte oxidative și reductive ale unei varietăți de substanțe. Jumătate de reacție pentru electrodul standard de hidrogen (ea) se află mai mult de jumătate în jos lista din tabelul \(\PageIndex{1}\). Toți reactanții care se află sub SHE în tabel sunt oxidanți mai puternici decât H+ și toți cei care se află deasupra SHE sunt mai slabi. Cel mai puternic oxidant din tabel este F2, cu un potențial standard de electrod de 2,87 V. Această valoare ridicată este în concordanță cu electronegativitatea ridicată a fluorului și ne spune că fluorul are o tendință mai puternică de a accepta electroni (este un oxidant mai puternic) decât orice alt element.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g) + 2e−\(\rightleftharpoons\) 2F−(aq) | 2.87 |
nu toți oxidanții și reductorii sunt creați egali. Potențialele de reducere standard din tabelul \(\PageIndex{1}\) pot fi interpretate ca o clasificare a substanțelor în funcție de puterea lor de oxidare și reducere. Agenții oxidanți puternici sunt de obicei compuși cu elemente în stări de oxidare ridicate sau cu electronegativitate ridicată, care câștigă electroni în reacția redox (figura \(\PageIndex{1}\)). Exemple de oxidanți puternici includ peroxid de hidrogen, permanganat și tetroxid de osmiu. Agenții reducători sunt de obicei elemente electropozitive precum hidrogen, litiu, sodiu, fier și aluminiu, care pierd electroni în reacțiile redox. Hidrurile (compuși care conțin hidrogen în starea formală de oxidare -1), cum ar fi hidrura de sodiu, borohidrura de sodiu și hidrura de litiu aluminiu, sunt adesea utilizate ca agenți reducători în reacțiile organice și organometalice.
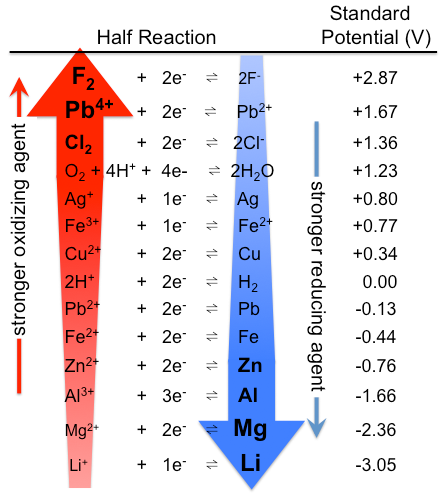
figura \(\PageIndex{1}\): Tabelul potențialelor electrodului standard. Rețineți că clasamentul este opus aici, cu agenți oxidanți puternici în partea de sus și agenți reducători puternici în partea de jos, decât în tabelul \(\PageIndex{1}\). Potențialele de fapt standard sunt aceleași, desigur. (CC BY-SA 3.0; Tem5psu).
în mod similar, toate speciile din tabelul \(\PageIndex{1}\) care se află deasupra H2 sunt reductanți mai puternici decât H2, iar cele care se află sub H2 sunt mai slabe. Cel mai puternic reductant din tabel este astfel litiul metalic, cu un potențial standard de electrod de -3,04 V. acest fapt ar putea fi surprinzător, deoarece cesiul, nu litiul, este cel mai puțin electronegativ element. Anomalia aparentă poate fi explicată prin faptul că potențialele electrodului sunt măsurate în soluție apoasă, unde interacțiunile intermoleculare sunt importante, în timp ce potențialele de ionizare și afinitățile electronilor sunt măsurate în faza gazoasă. Datorită dimensiunilor mici, ionul Li+ este stabilizat în soluție apoasă prin interacțiuni electrostatice puternice cu capătul dipol negativ al moleculelor de apă. Aceste interacțiuni au ca rezultat o Urihidratare semnificativ mai mare pentru Li+ comparativ cu Cs+. Litiul metalic este, prin urmare, cel mai puternic reductant (cel mai ușor oxidat) al metalelor alcaline în soluție apoasă.
potențialele de reducere standard pot fi interpretate ca o clasificare a substanțelor în funcție de puterea lor de oxidare și reducere. Speciile din tabelul \(\PageIndex{1}\) care se află deasupra H2 sunt agenți reducători mai puternici (mai ușor oxidați) decât H2. Speciile care se află sub H2 sunt agenți oxidanți mai puternici.
deoarece semireacțiile prezentate în tabelul \(\PageIndex{1}\) sunt aranjate în ordinea valorilor lor e, putem folosi tabelul pentru a prezice rapid puterea relativă a diferiților oxidanți și reductanți. Orice specie din partea stângă a unei jumătăți de reacție va oxida spontan orice specie din partea dreaptă a unei alte jumătăți de reacție care se află sub ea în tabel. În schimb, orice specie din partea dreaptă a unei jumătăți de reacție va reduce spontan orice specie din partea stângă a unei alte jumătăți de reacție care se află deasupra acesteia în tabel. Putem folosi aceste generalizări pentru a prezice spontaneitatea unei mari varietăți de reacții redox (e celula de la numărul unu > 0), așa cum este ilustrat în exemplul \(\PageIndex{1}\).
Example \(\PageIndex{1}\): sulfură de argint
pata neagră care se formează pe obiectele de argint este în primul rând Ag2S. semi-reacția pentru inversarea procesului de defăimare este următoarea:
- referindu—se la tabelul \(\PageIndex{1}\), prezice care specii−H2O2(aq), Zn(s), I—(aq), Sn2+(AQ) – poate reduce Ag2S la Ag în condiții standard.
- din aceste specii-H2O2(aq), Zn(s), I−(aq), Sn2+(AQ), identifică care este cel mai puternic agent reducător în soluție apoasă și, prin urmare, cel mai bun candidat pentru un produs comercial.
- din datele din tabelul \(\PageIndex{1}\), sugerează un agent de reducere alternativă, care este ușor disponibil, ieftin, și, eventual, mai eficient la eliminarea tarnish.

dat: jumătate de reacție de reducere, potențialul electrodului standard și lista posibililor reductanți
solicitat: reductanți pentru Ag2S, cel mai puternic reductant și potențial agent reducător pentru îndepărtarea murdăriei
strategie:
A din pozițiile lor din tabelul \(\PageIndex{1}\), decideți ce specie poate reduce Ag2S. determinați care specie este cel mai puternic reductant.
B utilizați tabelul \(\PageIndex{1}\) pentru a identifica un reductor pentru Ag2S care este un produs obișnuit de uz casnic.
soluție
putem rezolva problema într-unul din cele două moduri: (1) se compară pozițiile relative ale celor patru posibili reductanți cu cele ale cuplului Ag2S/Ag din tabelul \(\PageIndex{1}\) sau (2) se compară e pentru fiecare specie cu e pentru cuplul Ag2S/Ag (-0,69 V).
- a speciile din tabelul \(\PageIndex{1}\) sunt aranjate de sus în jos în ordinea creșterii rezistenței de reducere. Dintre cele patru specii date în problemă, I−(aq), Sn2+(aq) și H2O2(aq) se află deasupra Ag2S, iar una se află sub ea. Prin urmare, putem concluziona că Zn(s) poate reduce Ag2S(s) în condiții standard, în timp ce i−(aq), Sn2+(aq) și H2O2(aq) nu pot. Sn2+(aq) și H2O2(aq) apar de două ori în tabel: pe partea stângă (oxidant) într-o jumătate de reacție și pe partea dreaptă (reductant) în alta.
- cel mai puternic reductant este Zn(s), Specia din partea dreaptă a jumătății de reacție care se află mai aproape de partea de jos a tabelului \(\PageIndex{1}\) decât jumătățile de reacție care implică I-(aq), Sn2+(aq) și H2O2(aq). (Produsele comerciale care utilizează o bucată de zinc sunt adesea comercializate ca un „produs miracol” pentru îndepărtarea murdăriei din argint. Tot ce este necesar este să adăugați apă caldă și sare pentru conductivitatea electrică.)
- B dintre reductanții care se află sub Zn (s) în tabelul \(\PageIndex{1}\) și, prin urmare, sunt reductanți mai puternici, doar unul este disponibil în mod obișnuit în produsele de uz casnic: Al(S), care este vândut ca folie de aluminiu pentru ambalarea alimentelor.
exemplu \(\PageIndex{2}\):
Utilizare date în Tabelul \(\PageIndex{1}\) pentru a determina dacă fiecare reacție este probabil să apară în mod spontan în condiții standard:
- Sn(s) + Be2+(aq) → Sn2+(aq) + Fi(s)
- MnO2(s) + H2O2(aq) + 2H+(aq) → O2(g) + Mn2+(aq) + 2H2O(l)
Având în vedere: reacție redox și listă de potențiale de electrod standard (Tabelul P2 )
Cerut: reacție spontaneitate
Strategie:
- Identifica jumătate-reacții în fiecare ecuație. Folosind tabelul \(\PageIndex{1}\), determinați potențialele standard pentru jumătățile de reacție în direcția corespunzătoare.
- utilizați ecuația \(e_{cell}=e^o_{srp}(catod) – e^o_{srp}(anod)\) pentru a calcula potențialul celulei standard pentru reacția globală. Din această valoare, determinați dacă reacția generală este spontană.
soluție
- un staniu metalic este oxidat la Sn2+(aq), iar Be2+(aq) este redus la beriliu elementar. Putem găsi potențialele standard ale electrodului pentru ultima jumătate de reacție (reducere) (-1.85 V) și pentru prima jumătate de reacție (oxidare) (-0,14 V) direct din tabelul \(\PageIndex{1}\).
B adăugarea celor două jumătăți de reacție dă reacția generală:
|
\(\textrm{catod:} \; \mathrm{Be^{2+}(aq)} +\mathrm{2e^ -} \rightarrow \mathrm{be(S)}\) \(\textrm{anod:} \; \mathrm{SN(s) \rightarrow \mathrm{SN^{2+}}(s)} +\mathrm{2E^ -}\) \(\textrm{total:} \; \mathrm{Sn(s)+ \mathrm{Be^{2+}(aq)} \rightarrow \mathrm{SN^{2+}}(aq)} + \mathrm{Be(S)}\) |
\(e^\circ_{\textrm{catod}}=\textrm{-1.99 V} \\ e^\circ_{\textrm{anod}}=\textrm{-0.14 v} \\ e^\circ_{\textrm{cell}}=e^\circ_{\textrm{catod}}-e^\circ_{\textrm{anod}} \\ \HSpace{5mm} =-\textrm{1.85 v}\) |
potențialul celulei standard este destul de negativ, astfel încât reacția nu va avea loc spontan așa cum este scris. Adică, staniul metalic nu poate reduce Be2+ la metalul beriliu în condiții standard. În schimb, procesul invers, reducerea ionilor stanoși (Sn2+) de către beriliul metalic, care are o valoare pozitivă a celulei e-e, se va produce spontan.
- un MnO2 este oxidantul (Mn4+ este redus la Mn2+), în timp ce H2O2 este reductantul (O2− este oxidat la O2). Putem obține potențialele electrodului standard pentru semi-reacțiile de reducere și oxidare direct din tabelul \(\PageIndex{1}\).
B cele două jumătăți de reacție și potențialele lor corespunzătoare sunt următoarele:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ e^\circ_{\textrm{anod}}=\textrm{0.70 v} \\ e^\circ_{\textrm{cell}}=E^\circ_{\textrm{catod}}-E^\circ_{\textrm{anod}} \\ \hspace{5mm} =-\textrm{0.53 v}\) |
potențialul standard pentru reacție este pozitiv, indicând faptul că, în condiții standard, va apărea spontan așa cum este scris. Peroxidul de hidrogen va reduce MnO2, iar gazul de oxigen va evolua din soluție.
exercițiu \(\PageIndex{2}\)
utilizați datele din tabelul \(\PageIndex{1}\) Pentru a determina dacă fiecare reacție este probabil să apară spontan în condiții standard:
- 2ce4+(aq) + 2CL−(aq) 2ce3+(aq) + Cl2(g)
- 4MnO2(s) + 3O2(g) + 4OH−(AQ) 4mno4−(AQ) + 2H2O
răspuns
- spontane (e celulă de la 0,36 V)
- nespontanată (e celulă de la 0.20 V)
deși semnul celulei e-xq ne spune dacă o anumită reacție redox va avea loc spontan în condiții standard, nu ne spune în ce măsură se desfășoară reacția și nu ne spune ce se va întâmpla în condiții nestandardizate. Pentru a răspunde la aceste întrebări necesită o înțelegere mai cantitativă a relației dintre potențialul celulelor electrochimice și termodinamica chimică.
rezumat
concentrațiile relative ale diferiților oxidanți și reductanți pot fi prezise folosind valorile e. Punctele forte oxidative și reductive ale unei varietăți de substanțe pot fi comparate folosind potențialele standard ale electrodului. Anomaliile aparente pot fi explicate prin faptul că potențialele electrodului sunt măsurate în soluție apoasă, ceea ce permite interacțiuni electrostatice intermoleculare puternice și nu în faza gazoasă.
probleme conceptuale
- ordinea potențialelor electrodului nu poate fi întotdeauna prezisă de potențialele de ionizare și de afinitățile electronilor. De ce? Vă așteptați ca metalul de sodiu să aibă un potențial de electrod mai mare sau mai mic decât cel prevăzut din potențialul său de ionizare? Care este potențialul său aproximativ de electrod?
- fără a face referire la datele tabelate, de Br2/Br−, Ca2+/Ca, O2/OH− și Al3+/Al, care v-ați aștepta să aibă cel mai puțin potențial negativ de electrod și care cel mai negativ? De ce?
- din cauza aminoacizilor care conțin sulf prezenți în albușurile de ou, consumul de ouă cu o furculiță de argint va păta furculița. Ca chimist, aveți tot felul de produse de curățare interesante în dulapul dvs., inclusiv o soluție de acid oxalic de 1 M (H2C2O4). Ați alege această soluție pentru a curăța furculița pe care ați pătat-o de la consumul de ouă amestecate?
- potențialul electrodului pentru reacția Cu2+(aq) + 2e− cu(S) de la 0,34 V în condiții standard. Potențialul de oxidare a 0,5 mol de Cu este egal cu -0,34/2 V? Explică-ți răspunsul.
- consultați tabelul \(\PageIndex{1}\) pentru a prezice
- care specii—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) și / sau H2O2(aq)—pot oxida MnO2(s) la MNO4− în condiții standard.
- care specie-Sn4+(aq), Cl−(aq), Ag+(aq), Cr3 + (aq) și/sau H2O2 (aq)—este cel mai puternic agent oxidant în soluție apoasă.
răspuns Conceptual
- nu; e-0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply