Epigenética – não são apenas os genes que nos tornam
então o que é a epigenética?
outra forma de olhar para a epigenética é assim; enquanto a genética tradicional descreve a forma como as sequências de ADN nos nossos genes são passadas de uma geração para a seguinte, a epigenética descreve a transmissão da forma como os genes são usados. Para fazer uma analogia computacional, pense na epigenética como metadados, informações descrevendo e ordenando os dados subjacentes. Se você possui um MP3 player, por exemplo, ele irá conter um monte de dados, os arquivos MP3. Pense nisto como análogo aos genes. Mas você também provavelmente terá listas de reprodução ou você pode tocar faixas por artista ou gênero. Esta informação, lista de reprodução, artista, género, etc. é metadados. Determina quais faixas são tocadas e em que ordem, e isso é o que a epigenética é para a genética. É um conjunto de processos que os efeitos que os genes são ligados, ou “expressos”, como os biólogos moleculares diriam.como funciona a epigenética? a epigenética é sobre como os genes são expressos e usados, ao invés da sequência de DNA dos próprios genes, mas como isso funciona? Muitos pesquisadores têm estudado epigenética ao longo das últimas décadas, e é atualmente uma área de intensa atividade de pesquisa. Sabemos que uma parte de como a epigenética funciona é Adicionando e removendo pequenas etiquetas químicas ao ADN. Você pode pensar nestas tags como post-it observa que destaca genes particulares com informações sobre se eles devem ser ligados ou desligados. Na verdade, a etiqueta química em questão é chamada de grupo metil (ver diagrama 1) e é usada para modificar uma das quatro bases ou “letras químicas”, A, C, T e G, que compõem o código genético do nosso DNA. A letra que é marcada é C ou citosina e quando é modificada, ou metilada é chamada citosina 5-metil. Os grupos metila são adicionados ao DNA por enzimas chamadas DNA metil transferases (DNMTs).
-
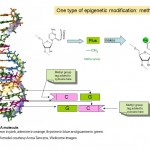
Figura 1. Dois grupos químicos, metil e acetilo, que são centrais para fenômenos epigenéticos e a estrutura química da citosina e citosina 5-metil no DNA. A parte pentagonal da molécula forma a “espinha dorsal” contínua do DNA . Apenas uma das duas cadeias de DNA que compõem a conhecida dupla hélice é mostrada.
abelha rainha é parcialmente determinada por menos marcas de metilo
na maioria dos casos, uma Cs mais metilada no ADN de um gene resulta na interrupção do gene. As abelhas fornecem-nos um bom exemplo de como isto pode funcionar. As abelhas operárias e a rainha têm corpos muito diferentes; a rainha é muito maior, tem uma vida mais longa, tem um abdômen ampliado e põe muitos milhares de ovos, enquanto os trabalhadores menores são estéreis, mas têm habilidades complexas de alimentação e comunicação. Apesar disso, a rainha e os trabalhadores de uma colmeia são fêmeas e geneticamente idênticos. A pista de como isso acontece está na geleia real, uma secreção que é alimentada por algumas larvas em desenvolvimento, e que resulta nestas larvas se tornando rainhas ao invés de trabalhadores. Voltaremos à geleia real e às suas propriedades de rainha mais tarde, mas uma pesquisa fascinante mostrou que se a quantidade de enzima DNMT adicionada ao grupo metil foi artificialmente reduzida em larvas de abelhas, então as larvas se desenvolveram em rainhas, mesmo que não fossem alimentadas com geleia real. Assim, a troca entre rainha e trabalhador pode ser invertida pela abundância de marcas de metilo no DNA das larvas de abelha. Menos marcas de metilo leva a ligar um gene especial ou genes nas larvas em desenvolvimento que resulta no desenvolvimento das larvas em rainhas e não Trabalhadores.
Tags on tails also operate gene switches
DNA methyl tags are only one part of the story though. Nas células de todas as plantas e Animais, o ADN é embalado ou embrulhado em nucleossomas onde a dupla hélice de ADN é enrolada em torno de um núcleo central de proteína (ver Figura 2). Cerca de 150 letras de DNA (ou pares de bases) é enrolado em torno de cada nucleossomo, e isso ajuda a empacotar os 3 bilhões de pares de base de código genético em cada uma das nossas células. Nucleosomes são demasiado pequenos para ver usando microscópios convencionais, mas os biólogos usam uma técnica chamada de difração de raios X para trabalhar a forma e a organização dos objetos como nucleosomes, e, em 1997, esta técnica revelou a bela estrutura de nucleosomes em alta resolução – ver (http://www.rcsb.org/pdb/explore/explore.do?structureId=1aoi).
-
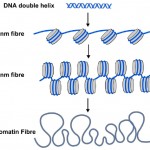
Figura 2. A conhecida dupla hélice de DNA (azul) é enrolada em torno de nucleossomas (cilindros cinzentos) em células. A cadeia de nucleossomas pode ser enrolada em um filamento mais espesso, chamado de fibra de 30 nm e isso pode ser mais enrolado em uma ainda mais espessa fibra de cromatina. Quando os genes são ligados aos seus nucleossomas são mais não enrolados como a fibra de 10nm.
nucleossomas são compactos, mas as extremidades ou “caudas” das proteínas que compõem o nucleossoma, que são chamadas histonas, sobressaem da estrutura nucleosoma compacta. Como as marcas de metilo no ADN, pequenas marcas químicas também podem ser adicionadas a estas caudas de histona (ver Figura 3). Duas das etiquetas químicas que são adicionadas a estas caudas são grupos acetilo e grupos metil. Metil, acetil e alguns outros tipos de tags podem ser adicionados às caudas em um grande número de combinações e isso afeta se um gene subjacente é ligado ou desligado. Na verdade, os genes podem ser desligados (isto é chamado de silenciamento), completamente, ou em algum lugar no meio por DNA metil tags e histone cauda tags. A combinação de marcas de ADN e histona também pode afectar a facilidade com que um gene é ligado ou desligado.
-
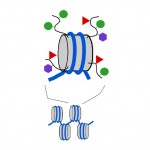
Figura 3. As etiquetas químicas podem ser adicionadas às” caudas ” das proteínas histonas que compõem os nucleossomas. Cilindro cinzento, nucleossomo; linhas pretas curvas, caudas de histona; círculos verdes, marcas de metilo; triângulos vermelhos, acetil; hexágonos mauve, outros tipos de marcas.
quando as células se dividem
Quando as células se dividem, toda a sequência de ADN da célula original (3 mil milhões de pares de base contidos em 23 pares de cromossomas numa célula humana) é duplicada de modo a que ambas as células-filhas recebam uma cópia exacta. O que acontece com todas aquelas etiquetas epigenéticas? Sabemos há algum tempo que as etiquetas de ADN-metilo também são copiadas, de modo que ambas as células-filhas têm o mesmo padrão de metilação de ADN. Agora sabemos que o padrão de tags histone também é duplicado principalmente como divisão de células, embora este seja atualmente menos bem compreendido. No entanto, a divisão celular também é um momento em que tags epigenéticos podem ser mudados mais facilmente.
o Retorno de mais longa vida, worm
logo no início nos deparamos com a história de vida longa vermes microscópicos thatpassed em sua longevidade aos seus filhos, mesmo se o indivíduo prole não herdam a variante do gene (mutação) que originalmente causou a vida útil estendida. Estamos agora em posição de explicar este resultado aparentemente estranho. Na maioria dos casos, os genes contêm as informações para fazer uma molécula de proteína, e a moléculas de proteína podem ser enzimas que realizam reações químicas na célula, ou partes da estrutura da própria célula. Acontece que os genes que foram mutados no estudo do worm fazem proteínas que trabalham juntas para adicionar uma marca de metila aos nucleossomas. Esta etiqueta é um interruptor. Quando um ou mais dos genes foram mutados esta etiqueta estava ausente e vários genes que deveriam estar ligados, incluindo alguns envolvidos no envelhecimento, foram desligados e os vermes tiveram uma vida útil mais longa. A coisa inesperada é que os tags epigenéticos foram pensados para ser completamente apagados ou reiniciados durante a formação de esperma e óvulo, e assim ao contrário dos próprios genes eles não devem ser passados para a próxima geração. Mas este resultado e outras pesquisas que mostram que este nem sempre é o caso e que, às vezes, o padrão de tags epigenéticos são passados adiante.como fazer uma rainha se uma abelha larva se torna uma trabalhadora ou uma rainha depende de um interruptor epigenético, e este interruptor parece ser “desligado” pela geleia real. Mas o que tem a geleia real que leva uma larva que de outra forma cresceria para ser uma trabalhadora, para se tornar uma rainha? A resposta está em compreender que as etiquetas químicas individuais que são adicionadas às caudas histonas dos nucleossomas estão constantemente sendo revisadas pela célula. As marcas acetil são adicionadas por enzimas chamadas histona acetil transferases e elas são removidas ou apagadas por um segundo grupo de enzimas chamadas histone deacetilases (HDACs). Ambas as enzimas estão presentes na maioria das células e isso permite que os genes sejam ligados ou desligados ao longo do tempo.
Mais acetil tags ajudam a obter o estatuto de abelha rainha
recentemente, os investigadores estabeleceram-se para identificar compostos na geleia real que poderiam alterar este processo, e o que eles encontraram foi algo conhecido como um inibidor de HDAC. Este era um composto químico relativamente simples que está presente na geleia real e que impede a ação das enzimas HDAC que normalmente removem acetil tags das histonas. Isto resulta em uma acumulação de acetil tags nas células dos embriões de abelhas, e como a redução nos grupos DNA-metil descritos anteriormente, pensa-se que isso liga os genes-chave necessários para o desenvolvimento de uma rainha. Sem o inibidor HDAC na geleia real, as larvas seguem um conjunto “padrão” de instruções genéticas e se desenvolvem em trabalhadores.os inibidores HDAC não são apenas importantes para as abelhas rainhas, mas também fazem parte de um pequeno mas crescente número de medicamentos medicamente úteis que visam etiquetas epigenéticas e que são úteis no tratamento de alguns tipos de câncer. Além disso, os HDACs também têm um papel na forma como o nosso cérebro forma memórias, e novos medicamentos que afetam a acetilação de histona pode ter um papel no futuro no tratamento da deficiência de memória em pacientes idosos.o ambiente e a epigenética vimos como a diferença entre uma abelha rainha e uma abelha trabalhadora é determinada pela exposição a um produto químico que altera directamente as marcas epigenéticas, tais como os grupos acetilo; mas existem exemplos em que a nutrição ou outros aspectos do ambiente afectam as populações humanas de uma forma que pode ser explicada pela epigenética? Obviamente não podemos fazer experimentos em populações humanas como podemos em vermes microscópicos ou abelhas, mas às vezes a história humana ou fenômenos naturais fazem isso por nós. Um desses exemplos é o que é conhecido como o inverno da fome Holandês. No último ano da Segunda Guerra Mundial na Europa, um embargo alimentar imposto pelas forças de ocupação alemãs à população civil dos Países Baixos resultou numa grave fome, que coincidiu com um inverno particularmente rigoroso. Cerca de 20.000 pessoas morreram de fome, com rações caindo para menos de 1000 quilocalorias por dia. Apesar do caos da guerra, os cuidados médicos e registros permaneceram intactos, permitindo que os cientistas posteriormente estudassem o efeito da fome na saúde humana. O que eles descobriram foi que as crianças que estavam no útero durante a fome experimentaram um aumento de vida em suas chances de desenvolver vários problemas de saúde em comparação com as crianças concebidas após a fome. O período mais sensível para este efeito foi os primeiros meses de gravidez. Assim, algo parece acontecer no início do desenvolvimento no útero que pode afetar o indivíduo para o resto de suas vidas.os efeitos epigenéticos podem, por vezes, passar para os netos ainda mais surpreendentemente, alguns dados parecem sugerir que os netos de mulheres grávidas durante o inverno da fome experimentam alguns destes efeitos. Pelo que já discutimos, isto sugere fortemente um mecanismo epigenético. Na verdade, a pesquisa com as famílias holandesas de Inverno Fome continua, e um estudo recente olhando para um gene galado IGF2 encontrou níveis mais baixos da marca de metil no DNA deste gene em indivíduos expostos à fome antes do nascimento. Embora o IGF2 possa não estar envolvido no aumento do risco de saúde destas pessoas, ele mostra que os efeitos epigenéticos (ou seja, a redução do número de marcas de metilo em genes específicos) que são produzidos antes do nascimento pode durar por muitas décadas. Estudos em animais também descobriram que a dieta da mãe pode ter efeitos sobre a sua descendência. Por exemplo, alimentar ovinos com uma dieta sem os tipos de alimentos necessários para fazer grupos de metilo leva à descendência com padrões alterados de metilação do ADN e que têm taxas mais elevadas do que o esperado de certos problemas de saúde.epigenética e imprinting, porque é que os genes da mãe e do Pai nem sempre são equivalentes
Todos temos 23 pares de cromossomas nas nossas células. Para cada par, um veio da mãe e outro do Pai. Assim, nós herdamos uma cópia de cada gene de cada pai e nós geralmente assumimos que a função do gene não depende de qual pai ele veio. No entanto, para genes impressos coisas são diferentes. Para estes genes, a cópia materna ou paterna do gene é ativa, enquanto o outro é mantido em silêncio. Existem pelo menos 80 genes impressos em humanos e ratos, muitos dos quais estão envolvidos no crescimento do embrião ou da placenta. Como é que uma cópia de um gene pode ser desligada, enquanto a outra cópia na mesma célula está ligada? A resposta é epigenética. Provavelmente o gene com impressão mais estudado é o IGF2(ver acima). Uma parte do IGF2 funciona como um interruptor. Se o ADN for metilado aqui, o gene IGF2 pode ser expresso. O interruptor é apenas metilado na cópia do gene do Pai e só esta cópia é expressa, enquanto a cópia materna é silenciosa. Pensa-se que este interruptor seja instalado nos gâmetas (óvulos e espermatozóides) de modo que, desde o início, os genes recebidos da mãe e os do Pai são rotulados de forma diferente com etiquetas epigenéticas e por isso não são equivalentes.as síndromes de Angelmann e de Prader-Willi são duas condições genéticas distintas com sintomas diferentes, ambas causadas pela perda de uma parte do cromossoma 15. As crianças que herdam uma cópia deste cromossoma defeituoso desenvolvem a síndrome de Angelmann ou Prader-Willi, apesar de terem uma cópia normal do cromossoma do outro progenitor. Então como é que a mesma mutação (perda de parte do cromossoma 15) leva a estas duas condições diferentes? A resposta encontra-se na descoberta de que esta parte específica do cromossoma 15 contém um número de genes que são impressos, de modo que apenas a paterna ou materna cópia destes genes são expressos; qual das duas síndromes aparece depende se a exclusão foi no maternal ou paternal herdadas cromossomo. Quando o cromossoma defeituoso é herdado do Pai, não há cópia funcional dos genes impressos que são desligados no cromossomo materno 15 e o resultado é a síndrome de Angelmann e vice-versa para a síndrome de Prader-Willi. Isto é muito diferente da maioria das condições genéticas, como a fibrose cística, onde um efeito sobre o desenvolvimento ou saúde só é visto quando um gene ou genes mutantes são herdados de ambos os pais.Rapazes versus Raparigas, como desligar um cromossoma inteiro um pouco de genética que a maioria de nós conhece é o que faz de um rapaz um rapaz, e de uma rapariga uma rapariga. São os cromossomas X e Y. No início da nossa existência cada um de nós recebeu um cromossoma X das nossas mães através do óvulo, e enquanto as raparigas receberam outro cromossoma X dos seus pais, através do esperma, os rapazes receberam um cromossoma Y. O cromossomo Y nas células de um embrião masculino direciona-o para se desenvolver em um menino, enquanto com dois cromossomos X e nenhum Y o embrião feminino se desenvolve em uma menina. Agora, você pode notar que há um desequilíbrio aqui. Todos nós temos dois cromossomos cada um dos outros, mas para os cromossomos sexuais (X e Y) as meninas têm dois Xs, enquanto os meninos têm apenas um X (e um Y). Enquanto o cromossomo Y contém poucos genes, a maioria envolvidos na” maleabilidade”, o cromossomo X contém alguns genes envolvidos em processos importantes como visão de cor, coagulação sanguínea e função muscular. A fim de nivelar a “dosagem” dos genes do cromossoma X entre as células masculinas e femininas, um cromossoma X inteiro é desligado nas células femininas. Isto é chamado de inactivação do cromossoma X e acontece muito cedo no útero. Neste processo, as células desligam aleatoriamente o cromossoma X paterno ou materno, de modo que quando uma menina nasce o seu corpo é uma mistura ou quimera de células onde o cromossoma X materno ou paterno é desligado. A forma como isso acontece envolve o tipo de tags epigenéticos que temos discutido e tem sido sabido por décadas que as células femininas contêm um cromossomo X muito compacto chamado corpo Barr que pode ser visto sob o microscópio, e este é o cromossomo X inativo.o caso do Gato de tortoiseshell provavelmente todos nós estamos familiarizados com gatos de tortoiseshell e seus casacos manchados com manchas de pele laranja e preta. O que você pode não saber é que quase todos os gatos com este tipo de Casaco são fêmeas! A razão para isso é que um gene para a cor da pelagem está localizado no cromossomo X do gato. Existem duas versões deste gene, chamado ” O “e” o”; uma dá pele de gengibre e a outra preta. Duas cópias da mesma versão em um gato fêmea resulta em pele de gengibre ou preto, respectivamente, mas uma cópia de cada um dá um efeito tortoiseshell. Isto deve-se à inactivação do cromossoma X. A pele destes gatos é composta por manchas de células onde o cromossoma X materno ou paterno está inactivado. Isto resulta em pele com o gene o ligado e o silenciado em algumas manchas (pele laranja) e o gene ligado e o silenciado em outras manchas (pele negra), daí o padrão tortoiseshell. Uma vez que os gatos machos têm apenas um cromossomo X, e sem inativação do cromossomo X, eles são cor-de-laranja ou preto por todo o lado.herança epigenética, podem os Estados epigenéticos ser passados de uma geração para a seguinte?
Como vimos a partir do exemplo do dirofilário, os efeitos epigenéticos (neste caso, longo tempo de vida) podem, por vezes, ser passados de uma geração para a seguinte, embora os efeitos pareçam durar apenas por algumas gerações. Existem exemplos em que os efeitos epigenéticos se repercutem nas gerações seguintes em seres humanos ou outros mamíferos? Há algumas evidências de que os efeitos do inverno de fome Holandês afetaram netos de mulheres que estavam grávidas durante a fome. Da mesma forma, em um estudo de uma população do Norte da Suécia do século XIX que passou por ciclos de fome e abundância, a quantidade de alimentos disponíveis parece ter afetado a saúde e longevidade da próxima geração.
A cor do cabelo no rato pode ser determinada por um efeito epigenético
talvez o melhor exemplo conhecido de efeitos epigenéticos transgeneracionais seja fornecido pelo gene Agouti do rato. Este gene controla a cor do cabelo, e é ligado no momento certo nas células foliculares do cabelo para produzir uma faixa amarela nos cabelos escuros, resultando no que é chamado de casaco agouti. Mas ratos com uma variante particular do gene Agouti chamado Avy têm casacos que estão em qualquer lugar entre o amarelo e o padrão escuro normal (agouti) de ratos de tipo selvagem. Os ratos amarelos também se tornam obesos e sofrem de outros problemas de saúde. Assim, o gene Avy parece ter um efeito variável (na verdade o Avy significa amarelo Avariável). Como isso funciona tem intrigado os geneticistas por anos, mas agora podemos reconhecer isso como um efeito epigenético. A pele amarela ocorre porque a versão Avy do gene Agouti tem controles defeituosos e é ligada o tempo todo. No entanto, as marcas de metilo são frequentemente adicionadas à sequência de controlo de ADN defeituoso e isto tende a desligar o gene, resultando em pele de agouti motorizada ou escura em ratos individuais. As crias nascidas de progenitoras com a cor do gene Avy do amarelo ao escuro, mas a proporção depende da cor do casaco da mãe; as ninhadas de fêmeas escuras (agouti) são mais susceptíveis de conter crias escuras. Além disso, uma maior proporção de descendentes escuros é observada se tanto a mãe como a avó têm a coloração escura. Assim, a coloração de agouti, que é determinada epigeneticamente (pelo número de marcas de metilo no gene Avy) pode, em certa medida, levar de uma geração para a seguinte.
os Ovos e o esperma geralmente não ‘carry over’ efeitos epigenéticos
Embora possamos encontrar casos onde epigenéticos efeitos, aparentemente, passado de pais para filhos, este não é geralmente o caso, e quase toda a epigenética interruptores ou marcas de reposição de células germinativas (óvulos e espermatozóides) e nos primeiros estágios de desenvolvimento de um embrião. De fato, se não fosse esse o caso, o incrível desenvolvimento de um ovo fertilizado em uma criatura totalmente formada seria impossível.
Chegando a partir de um óvulo fertilizado para um ser completamente formado, humanos, é tudo na (epi) genoma
até aqui foram descritos alguns casos específicos de regulação epigenética, mas agora sabemos que epigenética em seu sentido amplo, (como os genes são expressos e usados, em vez de a sequência de DNA dos genes em si) é central como um ovo fertilizado pode, eventualmente, dar origem a um organismo inteiro e como células de, digamos que a sua pele, permanecem as células da pele e são diferentes as células do seu cérebro, apesar de conter exatamente os mesmos genes. Pouco depois da fertilização, um embrião humano em desenvolvimento consiste numa bola de células chamadas células estaminais embrionárias. Cada uma destas células tem a capacidade de dar origem a qualquer um dos tipos de células no corpo, como o embrião cresce (por exemplo, células do cérebro, pele, células ou células do sangue). Em contraste, 9 meses depois, quando um bebê nasce, a maioria das células que compõem seu corpo estão comprometidas a ser um tipo específico de célula com funções específicas. Assim, à medida que as células se dividem, a bola de células-tronco embrionárias gradualmente se desenvolve em todos os tipos de células e estruturas do bebê no termo. Para que isso aconteça, milhares de genes devem ser ligados ou desligados na hora certa e nas células certas como um embrião cresce. Por exemplo, genes que fazem a proteína fibrosa de queratina que dá a nossa pele sua força, só são ligados em células da pele e não no cérebro em desenvolvimento e genes necessários para que as células do cérebro para desenvolver e fazer suas interconexões estão no cérebro, mas não na pele.
durante o desenvolvimento, os genes têm de ser ligados ” e “desligados”. As etiquetas epigenéticas ajudam com este
uma área muito grande de pesquisa hoje diz respeito a como todo este gene que liga um desligado funciona, e uma grande parte deste processo usa as etiquetas químicas epigenéticas, especialmente acetil e metil histona. Para que as células estaminais embrionárias possam dar origem a todos os outros tipos de células, os seus interruptores epigenéticos são (quase) completamente reinicializados em comparação com as células adultas. Eu coloquei “Quase” entre parênteses como sabemos a partir de genes impressos e herança epigenética transgeneracional que há exceções.em fevereiro de 1997, uma ovelha chamada Dolly tornou-se o exemplo mais famoso da sua espécie, tornando-se brevemente uma celebridade da TV. A razão para sua fama é que ela foi o primeiro mamífero a ser “criado” por um processo chamado transferência nuclear de células somáticas, ou em outras palavras, o primeiro clone feito pelo homem (feito pelo homem para ser distinto de gêmeos idênticos, que são clones naturais). O processo que levou ao seu nascimento exigiu um oócito Maduro (um ovo não esterilizado) de uma ovelha fêmea e uma célula comum do úbere de uma segunda ovelha. Primeiro o núcleo (a parte que contém o ADN) foi removido do oócito. Isto foi feito usando um microscópio especial, pois embora os oócitos sejam bastante grandes em comparação com outras células, eles ainda são muito pequenos para ver a olho nu. Em seguida, o núcleo da célula úbere foi inserido em oócito enucleado. Assim, Dolly tinha três “mães”: o doador do oócito, o doador da célula do úbere e as ovelhas que carregavam o embrião em desenvolvimento até o termo. Nenhum pai esteve envolvido. Embora este processo tenha sido, e permaneça, muito ineficiente, foi a primeira prova de que os genes de uma célula mamífera adulta podem ser “epigeneticamente reprogramados” de volta ao estado das células estaminais embrionárias que podem se desenvolver em qualquer outro tipo de célula. Subsequentemente, o mesmo processo foi aplicado a outras espécies e pode ter usos médicos na geração de células que podem reparar tecidos danificados por lesão ou doença.resumo: o epigenome e a CODIFICAR o projeto – o “Grande colisor de Hádrons” de Biologia
Considerando que o termo “genoma” refere-se a toda a sequência de DNA de um organismo (três bilhões de letras para os seres humanos), o epigenome refere-se a todo o padrão de modificações epigenéticas em todos os genes, incluindo metil DNA tags, metil histona tags, histona acetil tags e outros produtos químicos marcas que não foram mencionados, em cada tipo de célula de um organismo. Isso representa uma quantidade quase inimaginável de informação, superando até mesmo o Projeto Genoma Humano. No entanto, o conhecimento do epigenoma é essencial para responder plenamente a algumas das maiores questões da biologia, tais como: como nos desenvolvemos a partir de uma bola de células idênticas em um organismo inteiro? porque envelhecemos? e como podemos entender melhor doenças como o câncer? Não surpreendentemente, a epigenética e o epigenoma são uma grande área de pesquisa. Algumas das pesquisas neste campo são abrangidas pelo projeto ENCODE (Encode), um empreendimento em curso para identificar padrões de marcas epigenéticas em muitos tipos diferentes de células para todo o genoma humano (http://genome.ucsc.edu/ENCODE/). O projeto ENCODE é por vezes comparado ao Grande Colisor de Hádrons ou LHC na Suíça. O LHC é o maior equipamento científico jamais construído e os experimentos que o físico realiza com ele visam sondar os detalhes fundamentais da matéria que constitui o nosso universo. Embora os biólogos não tenham (ou necessitem) uma peça de kit tão espetacular para sua pesquisa, o esforço para examinar a complexidade do epigenoma humano foi comparado ao projeto LHC por causa de sua escala, complexidade e quantidade de informação sendo criada.erros epigenéticos a epigenética é uma área em que o nosso conhecimento científico está a aumentar rapidamente. Uma coisa que os cientistas descobriram é que os erros epigenéticos são comuns em doenças como o cancro e em células envelhecidas. Como resultado, os cientistas estão desenvolvendo medicamentos que visam epigenomas defeituosos e um dos primeiros exemplos é o uso de inibidores HDAC, semelhante ao composto encontrado na geleia real. A partir do estudo de padrões estranhos de herança, como o imprinting genético, o rato amarelo/agouti Avy, a população de gatos tortoiseshell de todas as mulheres e outros fenômenos relacionados biólogos descobriram uma nova camada de informação que está “em cima” da sequência de DNA de nossos genes. Estas novas descobertas explicam estas observações intrigantes anteriores, mas também têm grande potencial para novos conhecimentos e tratamentos para a doença humana.
Leitura Adicional:
- Bird, Adrian. Epigenética. Instant Expert No. 29′, New Scientist, 5 January 2013, No. 2898.Carey, Nessa. “The Epigenetics Revolution: How Modern Biology is Rewriting Our Understanding of Genetics, Disease and Inheritance”. Publisher: Icon Books. Paperback 1 de Março de 2012. ISBN-10: 1848313470. Preço RRP: £ 9-99.
influências epigenéticas e doenças no Sítio Web:
- http://www.nature.com/scitable/tpicpage/epigenetic-influences-and-disease-895
Leave a Reply