Comparando-Fortes, Oxidantes e Componente
os Objectivos de Aprendizagem
- Identificar como visualizar Potenciais de Redução Padrão a partir de uma perspectiva viável de redução e agentes oxidantes em reações REDOX.
podemos medir os potenciais padrão para uma grande variedade de substâncias químicas, algumas das quais estão listadas no quadro P2. Estes dados permitem-nos comparar os pontos fortes oxidativos e redutores de uma variedade de substâncias. A meia-reacção para o eléctrodo-padrão de hidrogénio (SHE) encontra-se a mais de metade da lista na tabela \(\PageIndex{1}\). Todos os reagentes que se encontram abaixo da ELA na mesa são oxidantes mais fortes do que H+, E todos aqueles que se encontram acima dela são mais fracos. O mais forte oxidante na tabela é F2, com um potencial de eletrodo padrão de 2,87 V. Este alto valor é consistente com a alta electronegativity de flúor e nos diz que o flúor tem uma forte tendência a aceitar elétrons (é um forte oxidante) do que qualquer outro elemento.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g) + 2e−\(\rightleftharpoons\) 2F−(aq) | 2.87 |
Nem todos os oxidantes e redutores são criados iguais. O potencial de redução padrão na tabela \(\PageIndex{1}\) pode ser interpretado como um ranking de substâncias de acordo com o seu poder oxidante e de redução. Agentes oxidantes fortes são tipicamente compostos com elementos em estados de oxidação elevados ou com alta eletronegatividade, que ganham elétrons na reação redox (figura \(\PageIndex{1}\)). Exemplos de oxidantes fortes incluem peróxido de hidrogênio, permanganato e tetróxido de ósmio. Agentes redutores são tipicamente elementos eletropositivos como hidrogênio, lítio, sódio, ferro e alumínio, que perdem elétrons em reações redox. Hidretos (compostos que contêm hidrogênio no estado de oxidação -1 formal), tais como hidreto de sódio, borohidreto de sódio e hidreto de alumínio de lítio, são frequentemente usados como agentes redutores em reações orgânicas e organometálicas.
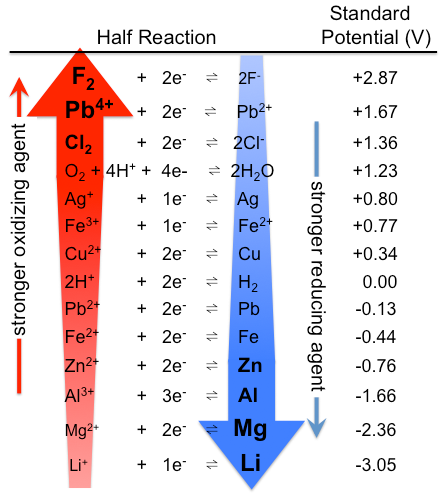
figura \(\PageIndex{1}\): Tabela dos potenciais de eléctrodos padrão. Note que o ranking é o oposto aqui, com agentes oxidantes fortes no topo e agentes redutores fortes no fundo, do que na tabela \(\PageIndex{1}\). Os potenciais padrão actualy são os mesmos naturalmente. (CC BY-SA 3.0; Tem5psu).
similarmente, todas as espécies na tabela \(\PageIndex{1}\) que se encontram acima de H2 são redutoras mais fortes do que H2, e as que se encontram abaixo de H2 são mais fracas. O redutor mais forte na tabela é, portanto, o lítio metálico, com um potencial de eletrodo padrão de -3.04 V. Este fato pode ser surpreendente porque césio, não lítio, é o elemento menos eletronegativo. A anomalia aparente pode ser explicada pelo fato de que potenciais de eletrodos são medidos em solução aquosa, onde interações intermoleculares são importantes, enquanto potenciais de ionização e Afinidades elétricas são medidas na fase gasosa. Devido ao seu pequeno tamanho, O íon Li+ é estabilizado em solução aquosa por fortes interações eletrostáticas com a extremidade dipolar negativa das moléculas de água. Estas interacções resultam numa Δhidratação significativamente maior para Li+ em comparação com Cs+. O metal lítio é, portanto, o redutor mais forte (mais facilmente oxidado) dos metais alcalinos em solução aquosa.
o potencial de redução padrão pode ser interpretado como um ranking de substâncias de acordo com o seu poder oxidante e redutor. As espécies da tabela \(\PageIndex{1}\) que se encontram acima de H2 são agentes redutores mais fortes (mais facilmente oxidados) do que H2. Espécies que se encontram abaixo de H2 são agentes oxidantes mais fortes.
porque as meias-reacções mostradas no quadro \(\PageIndex{1}\) estão dispostas por ordem dos seus valores de e°, podemos usar a tabela para prever rapidamente as dosagens relativas de vários oxidantes e redutantes. Qualquer espécie do lado esquerdo de uma meia-reacção irá oxidar espontaneamente qualquer espécie do lado direito de outra meia-reacção que se encontra abaixo dela na tabela. Inversamente, qualquer espécie do lado direito de uma meia-reacção irá reduzir espontaneamente qualquer espécie do lado esquerdo de outra meia-reacção que se encontra acima dela na tabela. Podemos usar estas generalizações para prever a espontaneidade de uma grande variedade de reações redox (e°cell > 0), como ilustrado no exemplo \(\PageIndex{1}\).
Exemplo de \(\PageIndex{1}\): Sulfeto de Prata
O preto manchar formas de prata objetos é principalmente Ag2S. A meia-reação para reverter a manchar o processo é o seguinte:
- Referindo-se a Tabela de \(\PageIndex{1}\), prever quais espécies—H2O2(aq), Zn(s), I−(aq), Sn2+(aq)—pode reduzir Ag2S para Ag em condições normais.
- destas espécies-H2O2( aq), Zn(s), I−(aq), Sn2+(aq), identificar qual é o agente redutor mais forte em solução aquosa e, portanto, o melhor candidato para um produto comercial.
- a partir dos dados da tabela \(\PageIndex{1}\), sugerir um agente redutor alternativo que está prontamente disponível, barato e, possivelmente, mais eficaz na remoção de alcatrão.

Dado: redução da meia-reação, potencial de eletrodo padrão, e a lista de possíveis componente
Perguntado: componente para Ag2S, mais forte reductant, e potencial agente redutor para a remoção de mancha
a Estratégia:
A Partir de suas posições na Tabela de \(\PageIndex{1}\), decidir que espécies pode reduzir Ag2S. Determinar qual espécie é a mais forte reductant.
B utilizar a tabela \(\PageIndex{1}\) para identificar um redutor de Ag2S que seja um produto doméstico comum.
solução
Podemos resolver o problema de uma de duas maneiras: (1) compare as posições relativas dos quatro redutantes possíveis com as do casal Ag2S/Ag na tabela \(\PageIndex{1}\) ou (2) compare e° para cada espécie com e° para o casal Ag2S/Ag (-0,69 V).
- A as espécies da tabela \(\PageIndex{1}\) são dispostas de cima para baixo, a fim de aumentar a força de redução. Das quatro espécies dadas no problema, I – (aq), Sn2+(aq), e H2O2 (aq) estão acima de Ag2S, e uma está abaixo dele. Podemos, portanto, concluir que Zn(s) pode reduzir Ag2S(s) em condições padrão, enquanto que I−(aq), Sn2+(aq), e H2O2(AQ) não pode. O Sn2+(aq) e o H2O2(aq) aparecem duas vezes na tabela: no lado esquerdo (oxidante) em uma meia reação e no lado direito (redutor) em outra.
- O mais forte reductant é Zn(s), a espécie do lado direito da meia-reação que se encontra mais perto da parte inferior da Tabela \(\PageIndex{1}\) do que a meia-reações que envolvem I−(aq), Sn2+(aq) e H2O2(aq). (Commercial products that use a piece of zinc are often marketed as a “miracle product” for removing tarnish from silver. Tudo o que é necessário é adicionar água quente e sal para a condutividade elétrica.)
- dos redutantes que se encontram abaixo de Zn (s) no quadro \(\PageIndex{1}\), e portanto são redutantes mais fortes, apenas um é comumente disponível em produtos domésticos: Al(s), que é vendido como folha de alumínio para alimentos de embalagem.
exemplo \(\PageIndex{2}\):
Use os dados na Tabela de \(\PageIndex{1}\) para determinar se cada reação é provável de ocorrer espontaneamente sob condições-padrão:
- Sn(s) + Be2+(aq) → Sn2+(aq) + Be(s)
- MnO2(s) + H2O2(aq) + 2H+(aq) → O2(g) + Mn2+(aq) + 2H2O(l)
Dado: reacção redox e lista de potenciais de eletrodo padrão (Tabela P2 )
Perguntado: reação espontaneidade
a Estratégia:
- Identificar as meia-reações em cada equação. Usando a tabela \(\PageIndex{1}\), determine os potenciais padrão para as meias-reações na direção apropriada.
- Use a equação \(E_{cell}=e^o_{srp} (cátodo) – e^o_{srp} (ânodo)\) para calcular o potencial da célula padrão para a reacção global. A partir deste valor, determinar se a reacção Global é espontânea.
solução
- um estanho metálico é oxidado a Sn2+(aq), e Be2+(AQ) é reduzido a berílio elementar. Podemos encontrar os potenciais de eletrodo padrão para a última (redução) semi-reação (-1.85 V) e para a primeira meia-reacção (oxidação) (-0,14 V) directamente do quadro \(\PageIndex{1}\).
B a Adição de duas meias-reações dá global da reação:
|
\(\textrm{cátodo:} \; \mathrm{Ser^{2+}(aq)} +\mathrm{2e^-} \rightarrow \mathrm{Estar(s)}\) \(\textrm{ânodo:} \; \mathrm{Sn(s) \rightarrow \mathrm{Sn^{2+}}(s)} +\mathrm{2e^-} \) \(\textrm{total:} \; \mathrm{Sn(s)+ \mathrm{Ser^{2+}(aq)} \rightarrow \mathrm{Sn^{2+}}(aq)} + \mathrm{Estar(s)}\) |
\(E^\circ_{\textrm{cátodo}}=\textrm{-1.99 V} \\ E^\circ_{\textrm{ânodo}}=\textrm{-0.14 V} \\ E^\circ_{\textrm{celular}}=E^\circ_{\textrm{cátodo}}-E^\circ_{\textrm{ânodo}} \\ \hspace{5mm} =-\textrm{de 1,85 V}\) |
O padrão de célula potencial é bastante negativa, portanto, a reação não ocorrerá espontaneamente, como está escrito. Ou seja, o estanho metálico não pode reduzir Be2+ ao metal berílio em condições normais. Em vez disso, o processo inverso, a redução de íons estânicos (Sn2+) por berílio metálico, que tem um valor positivo de e°célula, ocorrerá espontaneamente.
- A MnO2 is the oxidant (Mn4+ is reduced to Mn2+), while H2O2 is the reductant (O2− is oxidized to O2). Nós podemos obter os potenciais de eletrodo padrão para a redução e oxidação de meias-reações diretamente da tabela \(\PageIndex{1}\) .
B as duas meias-reacções e os seus potenciais correspondentes são os seguintes::
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ E^\circ_{\textrm{ânodo}}=\textrm{de 0,70 V} \\ E^\circ_{\textrm{celular}}=E^\circ_{\textrm{cátodo}}-E^\circ_{\textrm{ânodo}} \\ \hspace{5mm} =-\textrm{0.53 V}\) |
O potencial padrão para a reação é positiva, indicando que, em condições normais, vai ocorrer espontaneamente, como está escrito. O peróxido de hidrogénio reduzirá o MnO2, e o gás de oxigénio evoluirá a partir da solução.
Exercício de \(\PageIndex{2}\)
Use os dados na Tabela de \(\PageIndex{1}\) para determinar se cada reação é provável de ocorrer espontaneamente sob condições-padrão:
- 2Ce4+(aq) + 2Cl−(aq) → 2Ce3+(aq) + Cl2(g)
- 4MnO2(s) + 3O2(g) + 4OH−(aq) → 4MnO4−(aq) + 2H2O
Resposta
- espontânea (E°célula = 0.36 V)
- nonspontaneous (E°célula = -0.20 V)
embora o sinal da célula E°nos diga se uma determinada reacção redox irá ocorrer espontaneamente em condições normais, não nos diz em que medida a reacção prossegue, e não nos diz o que irá acontecer em condições não normalizadas. Para responder a estas questões requer um entendimento mais quantitativo da relação entre potencial celular eletroquímico e termodinâmica química.
resumo
as dosagens relativas de vários oxidantes e redutantes podem ser previstas utilizando valores de e°. As forças oxidativas e redutoras de uma variedade de substâncias podem ser comparadas usando potenciais de eletrodos padrão. Anomalias aparentes podem ser explicadas pelo fato de que os potenciais de eletrodos são medidos em solução aquosa, o que permite fortes interações eletrostáticas intermoleculares, e não na fase gasosa.
problemas conceptuais
- A Ordem dos potenciais de eléctrodos nem sempre pode ser prevista pelos potenciais de ionização e Afinidades dos electrões. Por quê? Espera que o metal sódico tenha um potencial de eletrodo maior ou menor do que o previsto pelo seu potencial de ionização? Qual é o potencial aproximado do eletrodo?
- sem se referir a dados tabulados, de Br2 / Br -, Ca2+ / Ca, O2/OH−, e Al3+/Al, que você esperaria ter o menor potencial de eletrodo negativo e qual o mais negativo? Por quê?devido aos aminoácidos contendo enxofre presentes nas claras dos ovos, comer ovos com um garfo de prata irá manchar o garfo. Como químico, você tem todos os tipos de produtos de limpeza interessantes em seu armário, incluindo uma solução de 1 M de ácido oxálico (H2C2O4). Escolheria esta solução para limpar o garfo que manchou por comer ovos mexidos?
- o potencial de eletrodo para a reação Cu2+(aq) + 2e− → Cu(s) é 0,34 V sob condições padrão. O potencial de oxidação de 0,5 mol de Cu é igual a -0,34/2 v? Explique a sua resposta.
- Consulte a Tabela de \(\PageIndex{1}\) para predizer
- Que espécies—Sn4+(aq), Cl−(aq) Ag+(aq), Cr3+(aq), e/ou H2O2(aq)—pode oxidar MnO2(s) para MNO4− em condições normais.
- que espécie—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq), e/ou H2O2 (AQ)—é o agente oxidante mais forte em solução aquosa.
resposta Conceptual
- No; e° = -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply