porównanie mocy utleniaczy i Reduktantów
cele nauki
- Określ, jak spojrzeć na standardowe potencjały redukcji z perspektywy żywotnych czynników redukujących i utleniających w reakcjach redoks.
możemy zmierzyć standardowe potencjały dla szerokiej gamy substancji chemicznych, z których niektóre są wymienione w tabeli P2. Dane te pozwalają nam porównać moc utleniającą i redukcyjną różnych substancji. Połowa reakcji dla standardowej elektrody wodorowej (SHE) znajduje się ponad połowę listy w tabeli \(\PageIndex{1}\). Wszystkie reagenty, które leżą poniżej SHE w tabeli, są silniejszymi utleniaczami niż h+, a wszystkie te, które leżą powyżej SHE, są słabsze. Najsilniejszym utleniaczem w tabeli jest F2, ze standardowym potencjałem elektrody 2,87 V. Ta wysoka wartość jest zgodna z wysoką elektroujemnością fluoru i mówi nam, że fluor ma silniejszą tendencję do przyjmowania elektronów (jest silniejszym utleniaczem) niż jakikolwiek inny element.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(G) + 2e−\(\rightleftharpoons\) 2F−(aq) | 2.87 |
nie wszystkie utleniacze i reduktory są sobie równe. Standardowe potencjały redukcji w tabeli \(\PageIndex{1}\) można interpretować jako ranking substancji według ich mocy utleniającej i redukującej. Silne środki utleniające to zazwyczaj związki o pierwiastkach w wysokich stanach utlenienia lub o wysokiej elektroujemności, które zyskują elektrony w reakcji redoks (rysunek \(\PageIndex{1}\)). Przykłady silnych utleniaczy obejmują nadtlenek wodoru, nadmanganian i tetroksyd osmu. Środki redukujące są zwykle pierwiastkami elektropozytywnymi, takimi jak wodór, lit, sód, żelazo i aluminium, które tracą elektrony w reakcjach redoks. Wodorki (związki, które zawierają wodór w formalnym stanie utleniania -1), takie jak wodorek sodu, borowodorek sodu i wodorek glinu litu, są często stosowane jako środki redukujące w reakcjach organicznych i metaloorganicznych.
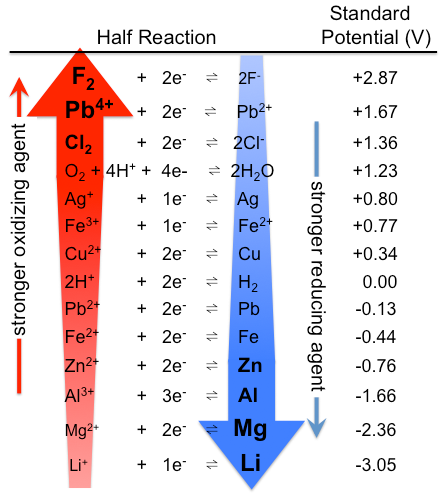
rysunek \(\PageIndex{1}\): Tabela potencjałów elektrody standardowej. Zauważ, że ranking jest tutaj odwrotny, z silnymi utleniaczami na górze i silnymi środkami redukującymi na dole, niż w tabeli \(\PageIndex{1}\). W rzeczywistości standardowe potencjały są oczywiście takie same. (CC BY-SA 3.0; Tem5psu).
podobnie wszystkie gatunki w tabeli \(\PageIndex{1}\) leżące powyżej H2 są silniejszymi reduktorami niż H2, A te leżące poniżej H2 są słabsze. Najsilniejszym reduktorem w tabeli jest zatem metaliczny lit, o potencjale elektrody standardowej -3,04 V. fakt ten może być zaskakujący, ponieważ CEZ, a nie lit, jest pierwiastkiem najmniej elektroujemnym. Pozorna anomalia może być wyjaśniona przez fakt, że potencjały elektrody są mierzone w roztworze wodnym, gdzie interakcje międzycząsteczkowe są ważne, podczas gdy potencjały jonizacji i powinowactwa elektronów są mierzone w fazie gazowej. Ze względu na niewielkie rozmiary jon Li+ jest stabilizowany w roztworze wodnym poprzez silne oddziaływania elektrostatyczne z ujemnym końcem dipolowym cząsteczek wody. Interakcje te skutkują znacznie większym Δhhydratacją dla Li+ w porównaniu z Cs+. Lit metal jest zatem najsilniejszym reduktorem (najłatwiej utlenionym) metali alkalicznych w roztworze wodnym.
standardowe potencjały redukcji można interpretować jako ranking substancji według ich mocy utleniającej i redukującej. Gatunki w tabeli \(\PageIndex{1}\) leżące powyżej H2 są silniejszymi środkami redukującymi (łatwiej utleniającymi się) niż H2. Gatunki leżące poniżej H2 są silniejszymi utleniaczami.
ponieważ pół-reakcje przedstawione w tabeli \(\PageIndex{1}\) są ułożone w kolejności ich wartości E°, możemy użyć tabeli do szybkiego przewidywania względnych mocy różnych utleniaczy i reduktantów. Każdy gatunek po lewej stronie pół-reakcji spontanicznie utlenia każdy gatunek po prawej stronie innej pół-reakcji, która znajduje się poniżej w tabeli. Odwrotnie, każdy gatunek po prawej stronie pół-reakcji spontanicznie zmniejszy każdy gatunek po lewej stronie innej pół-reakcji, która znajduje się nad nią w tabeli. Możemy użyć tych uogólnień, aby przewidzieć spontaniczność wielu różnych reakcji redoks (E°cell > 0), Jak pokazano w przykładzie \(\PageIndex{1}\).
przykład \(\PageIndex{1}\): siarczek srebra
Czarne zmatowienie, które tworzy się na przedmiotach srebrnych, to przede wszystkim Ag2S. reakcja połowiczna odwrócenia procesu zmatowienia jest następująca:
- odnosząc się do tabeli \(\PageIndex{1}\), przewidzieć, które gatunki—H2O2(aq), Zn(s), I−(AQ), Sn2+(AQ)—mogą zmniejszyć Ag2S do Ag w standardowych warunkach.
- tych gatunków—H2O2(aq), Zn(s), I−(AQ), Sn2+(AQ), określić, który jest najsilniejszym środkiem redukującym w roztworze wodnym, a tym samym najlepszym kandydatem do produktu komercyjnego.
- z danych w tabeli \(\PageIndex{1}\), zasugeruj alternatywny środek redukujący, który jest łatwo dostępny, niedrogi i prawdopodobnie bardziej skuteczny w usuwaniu zmatowienia.
podano: półreakcję redukcji, potencjał elektrody standardowej i listę możliwych reduktantów
zapytano o: reduktanty dla Ag2S, najsilniejszy reduktant i potencjalny środek redukujący do usuwania zmatowienia
strategia:
a z pozycji w tabeli \(\PageIndex{1}\), Zdecyduj, które gatunki mogą zmniejszyć Ag2S. określ, który gatunek jest najsilniejszym reduktantem.
b użyj Table \(\PageIndex{1}\), aby zidentyfikować środek redukujący dla Ag2S, który jest powszechnym produktem gospodarstwa domowego.
rozwiązanie
możemy rozwiązać problem na jeden z dwóch sposobów: (1) porównaj względne pozycje czterech możliwych reduktorów z pozycjami pary Ag2S/Ag w tabeli \(\PageIndex{1}\) lub (2) porównaj E° dla każdego gatunku z E° dla pary Ag2S/Ag (-0,69 V).
- a gatunki w tabeli \(\PageIndex{1}\) są ułożone od góry do dołu w kolejności zwiększania siły redukującej. Z czterech gatunków podanych w problemie, I−(AQ), Sn2+(AQ) i H2O2(AQ) leżą powyżej Ag2S, a jeden leży poniżej niego. Możemy zatem stwierdzić, że Zn(s) może zmniejszyć Ag2S(S) w standardowych warunkach, podczas gdy I−(AQ), Sn2+(AQ) i H2O2(AQ) nie mogą. Sn2+(AQ) i H2O2(AQ) pojawiają się dwa razy w tabeli: po lewej stronie (utleniacz) w jednej pół-reakcji i po prawej stronie (reduktor) w drugiej.
- najsilniejszym reduktorem jest Zn (s), gatunek po prawej stronie pół-reakcji, który leży bliżej dna tabeli \(\PageIndex{1}\) niż pół-reakcji obejmujących I−(AQ), Sn2+(AQ) i H2O2 (AQ). (Komercyjne produkty, które używają kawałka cynku, są często sprzedawane jako” cudowny produkt ” do usuwania zmatowienia ze srebra. Wszystko, co jest wymagane, to dodanie ciepłej wody i soli dla przewodności elektrycznej.)
- B z reduktorów, które leżą poniżej Zn (s) W tabeli \(\PageIndex{1}\), a zatem są silniejszymi reduktorami, tylko jeden jest powszechnie dostępny w produktach gospodarstwa domowego: Al (s), który jest sprzedawany jako folia aluminiowa do pakowania żywności.
przykład \(\PageIndex{2}\):
Użyj danych z tabeli \(\PageIndex{1}\), aby określić, czy każda reakcja może wystąpić spontanicznie w warunkach standardowych:
- Sn(s) + Be2+(AQ) → Sn2+(AQ) + Be(S)
- MnO2(s) + H2O2(aq) + 2h+(AQ) → O2(g) + MN2+(AQ) + 2H2O(L)
podano: reakcję redoks i listę potencjałów elektrody wzorcowej (tabela P2 )
zapytano o: spontaniczność reakcji
strategia:
- Zidentyfikuj pół-reakcje w każdym równaniu. Używając Table \(\PageIndex{1}\), Określ standardowe potencjały dla pół-reakcji w odpowiednim kierunku.
- użyj równania \(e_{cell}=e^o_{srp}(katoda) – e^o_{srp}(anoda)\), aby obliczyć standardowy potencjał komórki dla ogólnej reakcji. Na podstawie tej wartości określ, czy ogólna reakcja jest spontaniczna.
roztwór
- metaliczna cyna jest utleniana do Sn2+(AQ), a Be2+(AQ) jest redukowana do pierwiastkowego berylu. Możemy znaleźć standardowe potencjały elektrody dla tej drugiej (redukcji) pół-reakcji (-1.85 V) i dla poprzedniej (utleniania) pół-reakcji (-0,14 V) bezpośrednio z tabeli \(\PageIndex{1}\).
B dodanie dwóch pół-reakcji daje ogólną reakcję:
|
\(\textrm{katoda:} \; \mathrm{Be^{2+}(AQ)} +\mathrm{2e^-} \rightarrow \mathrm{be(S)}\) \(\textrm{Anode:} \; \mathrm{SN(s) \rightarrow \mathrm{Sn^{2+}}(S)} +\mathrm{2E^-} \) \(\textrm{Total:} \; \mathrm{Sn(s)+ \mathrm{Be^{2+}(AQ)} \rightarrow \mathrm{Sn^{2+}}(AQ)} + \mathrm{Be(S)}\) |
\(e^\circ_{\textrm{katoda}}=\textrm{-1.99 V} \\ e^\circ_{\textrm{anoda}}=\textrm{-0.14 v} \\ e^\circ_{\textrm{cell}}=e^\circ_{\textrm{Cathode}}-e^\circ_{\textrm{Anode}} \\ \hspace{5mm} =-\textrm{1.85 V}\) |
standardowy potencjał komórkowy jest dość negatywny, więc reakcja nie zachodzi spontanicznie, jak napisano. Oznacza to, że cyna metaliczna nie może zredukować Be2+ do metalu berylowego w standardowych warunkach. Zamiast tego, proces odwrotny, redukcja jonów cynowych (Sn2+) przez metaliczny Beryl, który ma dodatnią wartość komórki E°, nastąpi samoistnie.
- a MnO2 jest utleniaczem (Mn4+ redukuje się do Mn2+), podczas gdy H2O2 jest reduktorem (O2− utlenia się do O2). Standardowe potencjały elektrody dla pół-reakcji redukcji i utleniania możemy uzyskać bezpośrednio z Table \(\PageIndex{1}\) .
B dwie pół-reakcje i odpowiadające im potencjały są następujące:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ e^\circ_{\textrm{anode}}=\textrm{0.70 V} \\ e^\circ_{\textrm{cell}}=e^\circ_{\textrm{cathode}}-E^\circ_{\textrm{anode}} \\ \hspace{5mm} =-\textrm{0.53 V}\) |
standardowy potencjał reakcji jest dodatni, co wskazuje, że w standardowych warunkach nastąpi spontanicznie, jak napisano. Nadtlenek wodoru zmniejszy MnO2, a tlen gazowy wyewoluuje z roztworu.
ćwiczenie \(\PageIndex{2}\)
Użyj danych z tabeli \(\PageIndex{1}\), aby określić, czy każda reakcja może wystąpić spontanicznie w standardowych warunkach:
- 2ce4+(aq) + 2CL−(AQ) → 2ce3+(AQ) + Cl2(g)
- 4MnO2(s) + 3O2(g) + 4oh−(AQ) → 4mno4−(AQ) + 2H2O
odpowiedź
- spontaniczna (E°Cell = 0,36 V)
- bezpostaciowa (e°cell = -0.20 V)
chociaż znak ogniwa e°mówi nam, czy konkretna reakcja redoks wystąpi spontanicznie w standardowych warunkach, nie mówi nam, w jakim stopniu reakcja przebiega i nie mówi nam, co stanie się w niestandardowych warunkach. Odpowiedź na te pytania wymaga bardziej ilościowego zrozumienia związku między potencjałem elektrochemicznym komórki a termodynamiką chemiczną.
podsumowanie
względne siły różnych utleniaczy i reduktantów można przewidzieć za pomocą wartości E°. Moc utleniającą i redukcyjną różnych substancji można porównać za pomocą standardowych potencjałów elektrody. Widoczne anomalie można wyjaśnić tym, że potencjały elektrody są mierzone w roztworze wodnym, co pozwala na silne międzycząsteczkowe oddziaływania elektrostatyczne, a nie w fazie gazowej.
problemy koncepcyjne
- kolejność potencjałów elektrody nie zawsze może być określona przez potencjały jonizacji i powinowactwa elektronów. Dlaczego? Czy spodziewasz się, że metal sodowy ma wyższy lub niższy potencjał elektrody niż przewidywał potencjał jonizacji? Jaki jest przybliżony potencjał elektrody?
- bez odwoływania się do danych tabelarycznych, Br2/Br−, Ca2+/Ca, O2/OH− i Al3+/Al, która miałaby najmniejszy ujemny potencjał elektrody, a która najbardziej ujemna? Dlaczego?
- ze względu na aminokwasy zawierające siarkę obecne w białkach jaj, jedzenie jaj srebrnymi widelcami zniszczy widelec. Jako chemik masz w swojej szafce wiele ciekawych środków czyszczących, w tym 1 M roztwór kwasu szczawiowego (H2C2O4). Czy wybrałbyś To rozwiązanie do czyszczenia widelca, który zmazałeś z jedzenia jajecznicy?
- potencjał elektrody dla reakcji Cu2 + (aq) + 2e – → Cu(s) wynosi 0,34 V w standardowych warunkach. Czy potencjał utleniania 0,5 mola Cu jest równy -0,34 / 2 V? Wyjaśnij swoją odpowiedź.
- patrz tabela \(\PageIndex{1}\), aby przewidzieć
- które gatunki—Sn4+(AQ), Cl−(AQ), Ag+(AQ), Cr3+(AQ) i / lub H2O2(AQ)—mogą utlenić MnO2(S) do MNO4− w standardowych warunkach.
- który gatunek−Sn4+(AQ), Cl—(AQ), Ag+(AQ), Cr3+(AQ) i/lub H2O2(AQ) – jest najsilniejszym środkiem utleniającym w roztworze wodnym.
- nie; E° = -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply