vergelijking van de sterktes van oxidanten en Reductanten
leerdoelstellingen
- identificeren hoe Standaard Reductiepotentialen kunnen worden bekeken vanuit het perspectief van levensvatbare reductiemiddelen en oxiderende stoffen in redoxreacties.
We kunnen het standaardpotentieel voor een grote verscheidenheid aan chemische stoffen meten, waarvan sommige in Tabel P2 zijn opgenomen. Deze gegevens stellen ons in staat om de oxidatieve en reductieve sterktes van verschillende stoffen te vergelijken. De halfreactie voor de standaard waterstofelektrode (SHE) ligt meer dan halverwege de lijst in Tabel \(\Paginindex{1}\). Alle reagentia die onder de SHE in de tabel liggen zijn sterkere oxidanten dan H+, en alle reagentia die boven de SHE liggen zijn zwakker. De sterkste oxidant in de tabel is F2, met een standaard elektrodepotentiaal van 2,87 V. Deze hoge waarde is consistent met de hoge elektronegativiteit van fluor en vertelt ons dat fluor een sterkere neiging heeft om elektronen te accepteren (het is een sterkere oxidant) dan enig ander element.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g) + 2e−\(\rightleftharpoons\) 2F−(aq) | 2.87 |
niet alle oxidatiemiddelen en reductoren zijn gelijk. Het standaard reductiepotentieel in Tabel \(\Paginindex{1}\) kan worden geïnterpreteerd als een rangorde van stoffen volgens hun oxiderende en reducerende vermogen. Sterke oxiderende stoffen zijn typisch verbindingen met elementen in hoge oxidatietoestanden of met hoge elektronegativiteit, die elektronen krijgen in de redoxreactie (figuur \(\Paginindex{1}\)). Voorbeelden van sterke oxidatiemiddelen zijn waterstofperoxide, permanganaat en osmiumtetroxide. De verminderende agenten zijn typisch elektropositieve elementen zoals Waterstof, lithium, natrium, ijzer, en aluminium, die elektronen in redoxreacties verliezen. Hydriden (verbindingen die waterstof in de formele -1 oxidatietoestand bevatten), zoals natriumhydride, natriumborohydride en lithiumaluminiumhydride, worden vaak gebruikt als reductiemiddelen in organische en organometaalreacties.
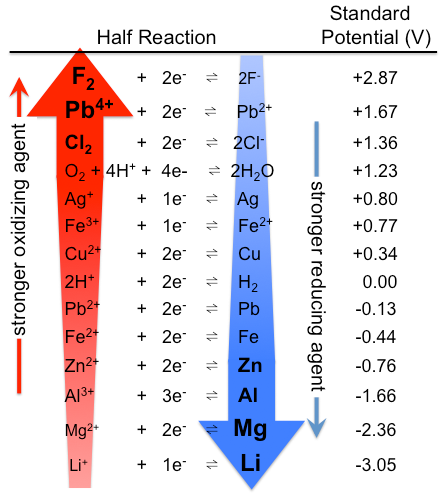
figuur \(\Paginindex{1}\): tabel van standaard elektrodepotentialen. Merk op dat de rangorde hier het tegenovergestelde is, met sterke oxiderende stoffen bovenaan en sterke reductiemiddelen onderaan, dan in Tabel \(\Paginindex{1}\). De actuele standaard potentialen zijn natuurlijk hetzelfde. (CC BY-SA 3.0; Tem5psu).
evenzo zijn alle soorten in Tabel \(\Paginindex{1}\) die boven H2 liggen, sterkere reductanten dan H2, en die onder H2 liggen zijn zwakker. Het sterkste reductiemiddel in de tabel is dus metallisch lithium, met een standaard elektrodepotentiaal van -3,04 V. dit feit kan verrassend zijn omdat cesium, niet lithium, het minst elektronegatieve element is. De schijnbare anomalie kan worden verklaard door het feit dat elektrode potentialen worden gemeten in waterige oplossing, waar intermoleculaire interacties belangrijk zijn, terwijl ionisatie potentialen en elektron affiniteiten worden gemeten in de gasfase. Wegens zijn kleine grootte, wordt het Li+ ion gestabiliseerd in waterige oplossing door sterke elektrostatische interactie met het negatieve dipooleind van watermolecules. Deze interacties resulteren in een significant grotere Δhhydratatie voor Li+ in vergelijking met Cs+. Lithiummetaal is daarom de sterkste reductant (het gemakkelijkst geoxideerd) van de alkalimetalen in waterige oplossing.
het standaard reductiepotentieel kan worden geïnterpreteerd als een rangorde van stoffen volgens hun oxiderende en reducerende vermogen. Soorten in Tabel \(\Pagindex{1}\) die boven H2 liggen zijn sterkere reducerende stoffen (gemakkelijker geoxideerd) dan H2. Soorten die onder H2 liggen zijn sterkere oxiderende stoffen.
omdat de halfreacties in Tabel \(\Paginindex{1}\) gerangschikt zijn in volgorde van hun E° waarden, kunnen we de tabel gebruiken om snel de relatieve sterktes van verschillende oxidanten en reductanten te voorspellen. Elke soort aan de linkerkant van een halve reactie zal spontaan elke soort aan de rechterkant van een andere halve reactie oxideren die eronder in de tabel ligt. Omgekeerd zal elke soort aan de rechterkant van een halve reactie spontaan elke soort aan de linkerkant van een andere halve reactie verminderen die erboven in de tabel ligt. We kunnen deze generalisaties gebruiken om de spontaniteit van een grote verscheidenheid aan redoxreacties te voorspellen (E°cell > 0), zoals geïllustreerd in Voorbeeld \(\Paginindex{1}\).
voorbeeld \(\Paginindex{1}\): zilversulfide
De zwarte kleur die zich vormt op zilverobjecten is voornamelijk Ag2S. de halve reactie voor het omkeren van het kleurproces is als volgt:
- verwijzend naar tabel \(\Paginindex{1}\), voorspel welke soorten—H2O2(aq), Zn(s), I−(aq), Sn2+(aq)—Ag2S kunnen reduceren tot Ag onder standaardomstandigheden.
- van deze soorten—H2O2(aq), Zn(s), I−(aq), Sn2+(aq), identificeren welke het sterkste reductiemiddel in waterige oplossing is en dus de beste kandidaat voor een commercieel product.
- uit de gegevens in Tabel \(\Paginindex{1}\) kan een alternatief reductiemiddel worden voorgesteld dat gemakkelijk beschikbaar, goedkoop en mogelijk effectiever is bij het verwijderen van aantasting.

gegeven: reductiehalfreactie, standaard elektrodepotentiaal en lijst van mogelijke reductanten
gevraagd: reductanten voor Ag2S, sterkste reductant, en potentiële reductiemiddel voor het verwijderen van tarnish
strategie:
A bepaal uit hun posities in Tabel \(\Pagindex{1}\) Welke soort Ag2S kan verminderen. Bepaal welke soort De sterkste reductant is.
B gebruik tabel \(\Paginindex{1}\) om een reductiemiddel voor Ag2S te identificeren dat een veel voorkomend huishoudproduct is.
oplossing
We kunnen het probleem op twee manieren oplossen: (1) vergelijk de relatieve posities van de vier mogelijke reductanten met die van het Ag2S/Ag paar in Tabel \(\Paginindex{1}\) of (2) Vergelijk E° voor elke soort met E° Voor het Ag2S/Ag paar (-0,69 V).
- A de soorten in Tabel \(\Paginindex{1}\) zijn gerangschikt van boven naar beneden in volgorde van toenemende reducerende sterkte. Van de vier soorten die in het probleem worden genoemd, liggen I−(aq), Sn2+(aq) en H2O2(aq) boven Ag2S, en één daaronder. We kunnen daarom concluderen dat Zn(s) Ag2S(s) onder standaardomstandigheden kan verminderen, terwijl I−(aq), Sn2+(aq) en H2O2(aq) dat niet kunnen. Sn2+(aq) en H2O2(aq) verschijnen twee keer in de tabel: aan de linkerkant (oxidant) in een halve reactie en aan de rechterkant (reductant) in een andere.
- de sterkste reductiestof is Zn (s), de soort aan de rechterkant van de halfreactie die dichter bij de onderkant van tabel \(\Paginindex{1}\) ligt dan de halfreacties waarbij I-(aq), Sn2+(aq) en H2O2 (aq) betrokken zijn. (Commerciële producten die een stuk zink gebruiken worden vaak op de markt gebracht als een “wonderproduct” voor het verwijderen van aanslag uit zilver. Het enige dat nodig is om warm water en zout toe te voegen voor elektrische geleidbaarheid.)
- B van de reductanten die onder Zn(s) in Tabel \(\Paginindex{1}\) liggen en daarom sterkere reductanten zijn, is er gewoonlijk slechts één beschikbaar in huishoudelijke producten: Al(s), die wordt verkocht als aluminiumfolie voor het verpakken van levensmiddelen.
voorbeeld \(\Paginindex{2}\):
het Gebruiken van de gegevens in Tabel \(\Pagina{1}\) om te bepalen of elke reactie is waarschijnlijk spontaan optreden onder standaard voorwaarden:
- Sn(s) + Be2+(aq) → Sn2+(aq) + Be(s)
- MnO2(s) + H2O2(aq) + 2H+(aq) → O2(g) + Mn2+(aq) + 2H2O(l)
Gegeven: redox-reactie en de lijst van standaard elektrode-potentialen (Tabel P2 )
Gevraagd: reactie spontaniteit
Strategie:
- Identificeren de half-reacties in iedere vergelijking. Bepaal met behulp van tabel \(\Paginindex{1}\) de standaard potentialen voor de halfreacties in de juiste richting.
- gebruik de vergelijking \(E_{cell}=E^o_{srp}(kathode) – E^O_{srp}(anode)\) om de standaardcelpotentiaal voor de totale reactie te berekenen. Bepaal aan de hand van deze waarde of de totale reactie spontaan is.
oplossing
- een metallisch tin wordt geoxideerd tot Sn2+(aq) en Be2+(aq) wordt gereduceerd tot elementair beryllium. We kunnen de standaard elektrode potentialen voor de laatste (reductie) half-reactie (-1.85 V) en voor de vroegere (oxidatie) halfreactie (-0,14 V) direct uit tabel \(\Paginindex{1}\).
B het Toevoegen van de twee half-reacties geeft de algemene reactie:
|
\(\textrm{kathode:} \; \mathrm{Worden^{2+}(aq)} +\mathrm{2e^-} \rightarrow \mathrm{Be(s)}\) \(\textrm{anode:} \; \mathrm{Sn(s) \rightarrow \mathrm{Sn^{2+}}(s)} +\mathrm{2e^-} \) \(\textrm{totaal} \; \mathrm{Sn(s)+ \mathrm{Worden^{2+}(aq)} \rightarrow \mathrm{Sn^{2+}}(aq)} + \mathrm{Be(s)}\) |
\E^\circ_{\textrm{kathode}}=\textrm{-1.99 V} \\ E^\circ_{\textrm{anode}}=\textrm{-0.14 V} \\ E^\circ_{\textrm{cell}}=E^\circ_{\textrm{kathode}}-E^\circ_{\textrm{anode}} \\ \hspace{5mm} =-\textrm{1.85 V}\) |
De standaard cel potentiaal is vrij negatief, dus zal de reactie niet spontaan optreden als geschreven. Dat wil zeggen dat metallisch tin Be2+ niet kan reduceren tot berylliummetaal onder standaardomstandigheden. In plaats daarvan zal het omgekeerde proces, de reductie van stanneuze ionen (Sn2+) door metallisch beryllium, dat een positieve waarde van e°cel heeft, spontaan plaatsvinden.
- A MnO2 is het oxidant (MN4+ wordt gereduceerd tot Mn2+), terwijl H2O2 het reductant is (O2− wordt geoxideerd tot O2). We kunnen de standaard elektrode potentialen voor de reductie en oxidatie half-reacties direct uit tabel \(\Paginindex{1}\) verkrijgen .
B de twee halfreacties en hun overeenkomstige potentieel zijn als volgt:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ E^\circ_{\textrm{anode}}=\textrm{0.70 V} \\ E^\circ_{\textrm{cell}}=E^\circ_{\textrm{kathode}}-E^\circ_{\textrm{anode}} \\ \hspace{5mm} =-\textrm{0.53 V}\) |
De standaard potentiaal voor de reactie is positief, wat aangeeft dat onder standaard voorwaarden, zal het spontaan optreden als geschreven. Waterstofperoxide zal MnO2 verminderen, en zuurstofgas zal uit de oplossing evolueren.
Oefening \(\Pagina{2}\)
het Gebruiken van de gegevens in Tabel \(\Pagina{1}\) om te bepalen of elke reactie is waarschijnlijk spontaan optreden onder standaard voorwaarden:
- 2Ce4+(aq) + 2Cl−(aq) → 2Ce3+(aq) + Cl2(g)
- 4MnO2(s) + 3O2(g) + 4OH−(aq) → 4MnO4−(aq) + 2H2O
Antwoord
- spontane (E°cel = 0.36 V)
- nonspontaneous (E°cel = -0.20 v)
hoewel het teken van E ° cell ons vertelt of een bepaalde redoxreactie spontaan zal optreden onder standaardomstandigheden, vertelt het ons niet in welke mate de reactie doorgaat, en het vertelt ons niet wat er zal gebeuren onder niet-standaardomstandigheden. Om deze vragen te beantwoorden is een meer kwantitatief begrip nodig van de relatie tussen elektrochemische celpotentiaal en chemische thermodynamica.
samenvatting
De relatieve sterkten van verschillende oxidanten en reductanten kunnen worden voorspeld met behulp van E° – waarden. De oxidatieve en reductieve sterkten van een verscheidenheid van substanties kunnen worden vergeleken gebruikend standaard elektrodepotentialen. Schijnbare anomalieën kunnen worden verklaard door het feit dat elektrode potentialen worden gemeten in waterige oplossing, die zorgt voor sterke intermoleculaire elektrostatische interacties, en niet in de gasfase.
conceptuele problemen
- De Orde van elektrodepotentialen kan niet altijd worden voorspeld door ionisatiepotentialen en elektronenaffiniteiten. Waarom? Verwacht u dat natriummetaal een hoger of lager elektrodepotentiaal heeft dan voorspeld op basis van zijn ionisatiepotentiaal? Wat is het geschatte elektrodepotentieel?
- zonder te verwijzen naar getabelleerde gegevens, van Br2 / Br -, Ca2+ / Ca, O2 / OH-en Al3+ / Al, welke zou u verwachten het minst negatieve elektrodepotentiaal te hebben en welke het meest negatieve? Waarom?
- vanwege de zwavelhoudende aminozuren die aanwezig zijn in eiwitten, zal het eten van eieren met een zilveren vork de vork aantasten. Als chemicus heb je allerlei interessante reinigingsproducten in je kast, waaronder een 1 M oplossing van oxaalzuur (H2C2O4). Zou u deze oplossing kiezen om de vork die u hebt bezoedeld van het eten van Roerei schoon te maken?
- het elektrodepotentiaal voor de reactie Cu2+(aq) + 2e− → Cu (s) is 0,34 V onder standaardomstandigheden. Is de potentie voor de oxidatie van 0,5 mol Cu gelijk aan -0,34/2 V? Leg je antwoord uit.
- refereer naar tabel \(\Paginindex{1}\) om te voorspellen
- welke soorten—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) en/of H2O2(aq)—MnO2(s) kunnen oxideren tot MNO4− onder standaardomstandigheden.
- welke soorten−Sn4+(aq), Cl—(aq), Ag+(aq), Cr3+(aq) en/of H2O2(aq) – het sterkste oxidatiemiddel in waterige oplossing zijn.
conceptueel antwoord
- No; E° = -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply