Epigenetica-het zijn niet alleen genen die ons
maken dus wat is epigenetica?een andere manier om naar epigenetica te kijken is als volgt: terwijl traditionele genetica de manier beschrijft waarop de DNA-sequenties in onze genen worden doorgegeven van de ene generatie op de volgende, beschrijft epigenetica het doorgeven van de manier waarop de genen worden gebruikt. Om een computeranalogie te maken, denk aan epigenetica als metadata, informatie die de onderliggende gegevens beschrijft en ordent. Als u bijvoorbeeld een MP3-speler bezit, bevat deze veel gegevens, de MP3-bestanden. Zie deze als analoog aan genen. Maar je hebt waarschijnlijk ook afspeellijsten of je kunt nummers afspelen op artiest of genre. Deze informatie, afspeellijst, artiest, genre etc. is metadata. Het bepaalt welke nummers worden gespeeld en in welke volgorde, en dit is wat epigenetica is voor de genetica. Het is een reeks processen die effecten welke genen worden ingeschakeld, of “uitgedrukt”, zoals moleculair biologen zou zeggen.
Hoe werkt epigenetica?
epigenetica gaat dus over hoe genen worden uitgedrukt en gebruikt, in plaats van de DNA-sequentie van de genen zelf, maar hoe werkt dit? Vele onderzoekers hebben epigenetica in de afgelopen decennia bestudeerd, en het is momenteel een gebied van intense onderzoeksactiviteit. We weten dat een deel van hoe epigenetica werkt is door het toevoegen en verwijderen van kleine chemische labels aan DNA. U kunt denken van deze tags als post-it notities die bepaalde genen met informatie over de vraag of ze moeten worden in-of uitgeschakeld markeren. In feite wordt het chemische label in kwestie een methylgroep genoemd (zie Figuur 1) en het wordt gebruikt om een van de vier basen of “chemische letters”, A, C, T en G, te wijzigen, die de genetische code van ons DNA vormen. De brief die wordt geëtiketteerd is C of cytosine en wanneer het wordt gewijzigd, of geméthyleerd wordt genoemd 5-methylcytosine. De methylgroepen worden aan DNA toegevoegd door enzymen genoemd methyltransferases van DNA (DNMTs).
-
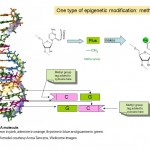
figuur 1. Twee chemische labels, methyl-en acetylgroepen die centraal staan bij epigenetische verschijnselen en de chemische structuur van cytosine en 5-methylcytosine in DNA. Het vijfhoekige deel van de molecule vormt de continue “ruggengraat” van DNA . Slechts één van de twee bundels van DNA die omhoog de vertrouwde dubbele helix maakt wordt getoond.
Queen bee status wordt gedeeltelijk bepaald door minder methyl tags
in de meeste gevallen resulteert meer geméthyleerde Cs in het DNA van een gen in het uitschakelen van het gen. Honingbijen geven ons een goed voorbeeld van hoe dit kan werken. Werkbijen en de koningin hebben zeer verschillende lichamen; de koningin is veel groter, leeft langer, heeft een vergrote buik en legt vele duizenden eieren, terwijl de kleinere werkers steriel zijn, maar complexe foerageer-en communicatievaardigheden hebben. Desondanks zijn de koningin en de werkers in een korf vrouwelijk en genetisch identiek. De aanwijzing hiervoor ligt in koninginnengelei, een secretie die aan sommige zich ontwikkelende larven wordt gevoerd en waardoor deze larven koninginnen worden in plaats van werksters. We komen later terug op koninginnengelei en zijn koningin-makende eigenschappen, maar een fascinerend stukje onderzoek toonde aan dat als de hoeveelheid van de methylgroep die dnmt-enzym toevoegt kunstmatig werd gereduceerd in bijenlarven, de larven zich ontwikkelden tot koninginnen, zelfs als ze geen koninginnengelei kregen. Aldus, kan de schakelaar tussen koningin en arbeider door de overvloed van methylmarkeringen op het DNA van de bijenlarven worden omgedraaid. Minder methyl tags leidt tot het inschakelen van een speciaal gen of genen in de zich ontwikkelende larven, wat resulteert in de ontwikkeling van de larven in koninginnen en niet in werksters.
Tags op staarten werken ook genschakelaars
DNA methyl tags zijn echter slechts een deel van het verhaal. In de cellen van alle planten en dieren, wordt DNA verpakt of verpakt in nucleosomen waar de dubbele helix van DNA wordt gewikkeld rond een centrale kern van eiwit (zie Figuur 2). Ongeveer 150 letters-waarde van DNA (of basenparen) is gewikkeld rond elk nucleosoom, en dit helpt verpakken de 3 miljard basenparen van genetische code in elk van onze cellen. Nucleosomen zijn te klein om te zien met behulp van conventionele microscopen, maar biologen gebruiken een techniek genaamd röntgendiffractie om de vorm en organisatie van objecten zoals nucleosomen uit te werken, en in 1997 onthulde deze techniek de mooie structuur van nucleosomen bij hoge resolutie-see (http://www.rcsb.org/pdb/explore/explore.do?structureId=1aoi).
-
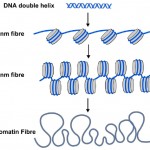
Figuur 2. De bekende dubbele helix van DNA (blauw) wordt om nucleosomen (grijze cilinders) in cellen gewikkeld. De koord van nucleosomen kan in een dikkere gloeidraad worden opgerold, genoemd de Vezel van 30 nm en dit kan verder in een nog dikkere chromatinvezel worden opgerold. Wanneer genen worden ingeschakeld zijn hun nucleosomen meer uncoiled zoals de 10nm-vezel.
nucleosomen zijn compact, maar de uiteinden of “staarten” van de eiwitten waaruit het nucleosoom bestaat, die histonen worden genoemd, steken uit de verder compacte nucleosoomstructuur. Net als de methyl tags op DNA, kunnen ook kleine chemische tags worden toegevoegd aan deze Histon staarten (zie afbeelding 3). Twee van de chemische labels die aan deze staarten worden toegevoegd zijn acetylgroepen en methylgroepen. Methyl, acetyl en een paar andere types van markeringen kunnen aan de staarten in een groot aantal combinaties worden toegevoegd en dit effect of een onderliggend gen wordt in-of uitgeschakeld. In feite kunnen genen rechts worden uitgeschakeld (Dit wordt genoemd het tot zwijgen brengen), volledig aan, of ergens tussen door DNA methylmarkeringen en histone staartmarkeringen. De combinatie van DNA en histone-markeringen kan ook effect hebben hoe gemakkelijk een gen wordt ingeschakeld of uitgeschakeld.
-
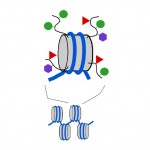
Figuur 3. De chemische labels kunnen aan de “staarten” van de histone proteã nen worden toegevoegd die omhoog nucleosomes maken. Grijze cilinder, nucleosoom; gebogen zwarte lijnen, Histon staarten; groene cirkels, methyl tags; rode driehoeken, acetyl tags; paarse zeshoeken, andere soorten tags.
wanneer cellen delen
wanneer cellen delen, wordt de volledige DNA-sequentie van de oorspronkelijke cel (3 miljard basenparen in 23 paren chromosomen in een menselijke cel) gedupliceerd zodat beide dochtercellen een exacte kopie krijgen. Wat gebeurt er met al die epigenetische labels? We weten al enige tijd dat de DNA-methyl tags ook worden gekopieerd, zodat beide dochtercellen hetzelfde patroon van DNA methylering hebben. We weten nu dat het patroon van histone-tags ook meestal wordt gedupliceerd als cellen delen, hoewel dit momenteel minder goed wordt begrepen. Toch is celdeling ook een tijd waarin epigenetische tags het gemakkelijkst kunnen worden gewijzigd.
terugkeer van de langlevende worm
in het begin stuitten we op het verhaal van de langlevende microscopische wormen die hun nakomelingen langlevende, zelfs als de individuele nakomelingen niet het variantgen (mutatie) erven dat oorspronkelijk de verlengde levensduur veroorzaakte. We zijn nu in de positie om dit schijnbaar vreemde resultaat uit te leggen. In de meeste gevallen bevatten genen de informatie om een eiwitmolecuul te maken, en de eiwitmoleculen kunnen enzymen zijn die chemische reacties in de cel Uitvoeren, of delen van de structuur van de cel zelf. Het blijkt dat de genen die gemuteerd werden in de worm studie eiwitten maken die samenwerken om een methyl tag toe te voegen aan nucleosomen. Deze tag is een aan-schakelaar. Wanneer een of meer van de genen werden gemuteerd was dit label afwezig en verschillende genen die zouden moeten worden ingeschakeld, waaronder sommige die betrokken zijn bij veroudering, werden uitgeschakeld en de wormen hadden een langere levensduur. Het onverwachte is dat men dacht dat de epigenetische tags volledig werden gewist of gereset tijdens de vorming van sperma en ei, en dus in tegenstelling tot de genen zelf zouden ze niet moeten worden doorgegeven aan de volgende generatie. Maar dit resultaat en ander onderzoek waaruit blijkt dat dit niet altijd het geval is en dat soms het patroon van epigenetische tags wordt doorgegeven.
Hoe maak je een koningin
of een larve honingbij een werkster of een koningin wordt, hangt af van een epigenetische schakelaar, en deze schakelaar lijkt te worden “omgedraaid” door koninginnengelei. Maar wat is het met koninginnengelei dat een larve leidt die anders zou opgroeien tot Werkster, tot koningin? Het antwoord ligt in het begrijpen dat de individuele chemische markeringen die aan de histone staarten van nucleosomes worden toegevoegd constant door de cel worden herzien. Acetyl tags worden toegevoegd door enzymen genoemd histone acetyl transferases en zij worden verwijderd of gewist door een tweede groep enzymen genoemd histone deacetylases (HDACs). Beide enzymen zijn aanwezig in de meeste cellen en dit laat genen toe om na verloop van tijd worden in-of uitgeschakeld.
meer acetyl-tags helpen bij het verkrijgen van de status van koningin bij
onlangs gingen onderzoekers op zoek naar stoffen in koninginnengelei die dit proces zouden kunnen veranderen, en ze vonden iets dat bekend staat als een HDAC-remmer. Dit was een relatief eenvoudige chemische verbinding die aanwezig is in koninginnengelei en die de werking van HDAC-enzymen stopt die normaal acetyl tags uit histonen verwijderen. Dit resulteert in een opeenhoping van acetylmarkeringen in de cellen van de bijembryo ‘ s, en als de eerder beschreven vermindering van DNA-methylgroepen, wordt dit verondersteld om zeer belangrijke genen in te schakelen die voor ontwikkeling van een koningin worden vereist. Zonder de HDAC-remmer in de koninginnengelei, volgen de larven een” standaard ” set van genetische instructies en ontwikkelen zich tot werkers.
HDAC-remmers zijn niet alleen belangrijk voor koninginnen, maar maken ook deel uit van een klein maar groeiend aantal medisch bruikbare geneesmiddelen die gericht zijn op epigenetische tags en die nuttig zijn bij de behandeling van sommige soorten kanker. Verder spelen HDACs ook een rol in de manier waarop onze hersenen herinneringen vormen, en nieuwe geneesmiddelen die Histon-acetylering beïnvloeden, kunnen in de toekomst een rol spelen bij de behandeling van geheugenstoornissen bij oudere patiënten.
milieu en epigenetica
we hebben gezien hoe het verschil tussen een koningin en werkbij wordt bepaald door blootstelling aan een chemische stof die epigenetische tags zoals acetylgroepen direct verandert; maar zijn er voorbeelden waarin voeding of andere aspecten van het milieu de menselijke bevolking beïnvloeden op een manier die kan worden verklaard door epigenetica? Uiteraard kunnen we niet experimenteren op menselijke populaties zoals we dat kunnen op microscopische wormen of bijen, maar soms doen menselijke geschiedenis of natuurverschijnselen het voor ons. Een voorbeeld hiervan is de zogenaamde Nederlandse Hongerwinter. In het laatste jaar van de Tweede Wereldoorlog in Europa leidde een voedselembargo dat door de Duitse bezettingstroepen werd opgelegd aan de Nederlandse burgerbevolking tot een ernstige hongersnood, die samenvalt met een bijzonder strenge winter. Ongeveer 20.000 mensen stierven van de honger als rantsoenen daalde tot onder de 1000 kilocalorieën per dag. Ondanks de chaos van de oorlog, medische zorg en verslagen bleef intact waardoor wetenschappers vervolgens het effect van hongersnood op de menselijke gezondheid te bestuderen. Wat ze ontdekten was dat kinderen die in de baarmoeder waren tijdens de hongersnood een levenslange toename van hun kansen op het ontwikkelen van verschillende gezondheidsproblemen ervaren in vergelijking met kinderen verwekt na de hongersnood. De meest gevoelige periode voor dit effect was de eerste paar maanden van de zwangerschap. Dus, iets lijkt te gebeuren vroeg in de ontwikkeling in de baarmoeder die het individu kan beïnvloeden voor de rest van hun leven.
epigenetische effecten kunnen soms overgaan op kleinkinderen
nog verrassender lijken sommige gegevens te suggereren dat kleinkinderen van vrouwen die zwanger waren tijdens de Hongerwinter sommige van deze effecten ervaren. Uit wat we al hebben besproken, suggereert dit sterk een epigenetisch mechanisme. In feite gaat het onderzoek met de Nederlandse Hongerwinterfamilies door, en een recente studie die een gen vergalde IGF2 bekijkt, vond lagere niveaus van het methyllabel in het DNA van dit gen bij individuen die voor de geboorte aan de hongersnood zijn blootgesteld. Hoewel IGF2 zelf niet betrokken kan zijn bij het verhoogde risico van slechte gezondheid bij deze mensen, toont het aan dat epigenetische effecten (d.w.z. vermindering van het aantal methyl tags op bepaalde genen) die worden geproduceerd voor de geboorte vele decennia kunnen duren. Studies bij dieren hebben ook aangetoond dat het dieet van de moeder effecten kan hebben op haar nakomelingen. Bijvoorbeeld, leidt het voeden van schapen een dieet die de soorten voedsel ontbreekt die worden vereist om methylgroepen te maken tot nakomelingen met veranderde patronen van methylation van DNA en die hoger dan verwachte tarieven van bepaalde gezondheidsproblemen hebben.
epigenetica en bedrukking, waarom genen van mama en papa niet altijd gelijkwaardig zijn
We hebben allemaal 23 paar chromosomen in onze cellen. Voor elk paar kwam er één van moeder en één van vader. Zo erven we een kopie van elk gen van elke ouder en we nemen over het algemeen aan dat de functie van het gen niet afhangt van welke ouder het vandaan kwam. Echter, voor ingeprent genen dingen zijn anders. Voor deze genen is ofwel de maternale of vaderlijke kopie van het gen actief, terwijl de andere stil wordt gehouden. Er zijn minstens 80 ingeprente genen in mensen en muizen, waarvan velen betrokken zijn bij de groei van het embryo of de placenta. Hoe kan een kopie van een gen worden uitgeschakeld, terwijl de andere kopie in dezelfde cel wordt ingeschakeld? Het antwoord is epigenetica. Waarschijnlijk is het meest bestudeerde ingeprente gen IGF2 (zie hierboven). Een deel van IGF2 werkt als een switch. Als het DNA hier geméthyleerd is kan het IGF2 gen worden uitgedrukt. De schakelaar wordt alleen geméthyleerd in Dad ‘ s kopie van het gen en dus alleen deze kopie wordt uitgedrukt, terwijl de maternale kopie is stil. Deze schakelaar wordt verondersteld te worden opgezet in de gameten (eieren en sperma) dus vanaf het begin, genen ontvangen van mama en die van papa zijn verschillend geëtiketteerd met epigenetische tags en dus zijn niet gelijkwaardig.
Imprinting en psychische stoornissen
Angelmann-en Prader-Willi-syndromen zijn twee verschillende genetische aandoeningen met verschillende symptomen, beide veroorzaakt door verlies van een deel van chromosoom 15. De kinderen die één exemplaar van dit defecte chromosoom erven ontwikkelen of angelmann of Prader-Willi syndroom, ondanks het hebben van een normaal exemplaar van het chromosoom van hun andere ouder. Dus hoe leidt dezelfde mutatie (verlies van een deel van chromosoom 15) tot deze twee verschillende condities? Het antwoord ligt in de ontdekking dat dit specifieke stuk van chromosoom 15 een aantal genen bevat die zijn ingeprent, dus alleen de vaderlijke of moederlijke kopie van dit gen wordt uitgedrukt; welke van de twee syndromen verschijnt hangt af van of de deletie in het moederlijke of paternaal overgeërfde chromosoom was. Wanneer het defecte chromosoom van Dad wordt geërfd, is er geen functionele kopie van de ingeprente genen die op het maternale chromosoom 15 worden uitgeschakeld en het resultaat is het syndroom van Angelmann en vice versa voor het syndroom van Prader-Willi. Dit is vrij in tegenstelling tot de meeste genetische voorwaarden zoals cystic fibrosis, waar een effect op ontwikkeling of gezondheid slechts wordt gezien wanneer een gemuteerd gen of genen van beide ouders wordt geërfd.
jongens versus meisjes, hoe een heel chromosoom uit te schakelen
een beetje genetica dat de meesten van ons kennen is wat een jongen een jongen maakt, en een meisje een meisje. Het zijn de x en Y chromosomen. Aan het begin van ons bestaan ontving ieder van ons een X-chromosoom van onze moeders via het ei, en terwijl de meisjes een ander X-chromosoom van hun vaders kregen, via het sperma, kregen de jongens een Y-chromosoom. Het Y-chromosoom in de cellen van een mannelijk embryo leidt het om zich tot een jongen te ontwikkelen, terwijl met twee X en geen Y-chromosoom het vrouwelijke embryo zich tot een meisje ontwikkelt. Je zou kunnen merken dat er hier een onbalans is. We hebben er allemaal twee van alle andere chromosomen, maar voor de geslachtschromosomen (X en Y) hebben de meisjes twee Xs terwijl de jongens slechts één X (en een Y) hebben. Terwijl het Y-chromosoom weinig genen bevat, meestal betrokken bij” mannelijkheid”, bevat het X-chromosoom nogal wat genen betrokken bij belangrijke processen zoals kleurenvisie, bloedstolling en spierfunctie. Om de “dosering” van X-chromosoomgenen tussen mannelijke en vrouwelijke cellen te verhogen, wordt één volledig X-chromosoom in vrouwelijke cellen uitgeschakeld. Dit wordt genoemd X-chromosoom inactivering en gebeurt zeer vroeg in de baarmoeder. In dit proces schakelen cellen willekeurig uit ofwel de vaderlijke of moederlijke X-chromosoom, zodat wanneer een meisje baby wordt geboren haar lichaam is een mengsel of chimera van cellen waar ofwel de moeder of vaderlijke X-chromosoom is uitgeschakeld. De manier waarop dit gebeurt gaat over het type epigenetische tags die we hebben besproken en het is al tientallen jaren bekend dat vrouwelijke cellen bevatten een zeer compacte X chromosoom genaamd de Barr lichaam dat kan worden gezien onder de microscoop, en dit is het inactieve X chromosoom.
het geval van de schildpad kat
We zijn waarschijnlijk allemaal bekend met schildpad katten en hun gevlekte vacht met vlekken van oranje en zwarte vacht. Wat je misschien niet weet is dat bijna alle katten met dit soort vacht vrouwelijk zijn! De reden hiervoor is dat een gen voor vachtkleur zich op het X-chromosoom van de kat bevindt. Er zijn twee versies van dit gen, genaamd “O” en “o”; de ene geeft gemberbont en de andere Zwart. Twee exemplaren van dezelfde versie bij een vrouwelijke kat resulteert in respectievelijk gember of zwarte vacht, maar één exemplaar van elk geeft een schildpad effect. Dit komt door X-chromosoom inactivering. De huid van deze katten bestaat uit cellenvlekken waarbij ofwel het maternale of het paternale X-chromosoom geïnactiveerd is. Dit resulteert in de huid met het o gen ingeschakeld en o het zwijgen opgelegd in sommige patches (oranje vacht) en o gen aan en O het zwijgen opgelegd in andere patches (zwarte vacht), vandaar het schildpaddenhuid patroon. Aangezien de mannelijke katten slechts één X-chromosoom hebben, en geen X-chromosoom inactivatie, zijn ze overal oranje of zwart.
epigenetische overerving, kunnen epigenetische toestanden van de ene generatie op de volgende worden doorgegeven?
zoals we uit het rondwormvoorbeeld hebben gezien, kunnen epigenetische effecten (in dit geval verlengde levensduur) soms van generatie op generatie worden doorgegeven, hoewel de effecten slechts enkele generaties lijken te duren. Zijn er voorbeelden waarbij epigenetische effecten doorwerken naar volgende generaties bij mensen of andere zoogdieren? Er zijn aanwijzingen dat de gevolgen van de Nederlandse Hongerwinter kleinkinderen van zwangere vrouwen tijdens de hongersnood hebben getroffen. In een studie van een 19e – eeuwse Noord-Zweedse bevolking die cycli van hongersnood en overvloed onderging, lijkt de hoeveelheid beschikbare voedsel de gezondheid en levensduur van de volgende generatie te hebben beïnvloed.
haarkleur bij muizen kan worden bepaald door een epigenetisch effect
misschien wordt het bekendste voorbeeld van transgenerationele epigenetische effecten geleverd door het agouti-gen van de muis. Dit gen controleert de haarkleur, en wordt op precies het juiste moment in haarfollikelcellen ingeschakeld om een gele streep te produceren in de anders donkere haren, wat resulteert in wat een agouti vacht wordt genoemd. Maar muizen met een bepaalde variant van het agouti-gen, Avy genaamd, hebben vachten die ergens tussen geel en het normale donkere (agouti) patroon van wild-type muizen liggen. De gele muizen worden ook zwaarlijvig en lijden aan andere gezondheidsproblemen. Het Avy-gen lijkt dus een variabel effect te hebben (in feite staat het Avy voor Avariabel geel). Hoe dit werkt heeft genetici jarenlang verbaasd, maar we kunnen dit nu herkennen als een epigenetisch effect. De gele vacht komt voor omdat de Avy – versie van het agouti-gen defecte controles heeft en voortdurend wordt ingeschakeld. Nochtans, worden methylmarkeringen vaak toegevoegd aan de defecte opeenvolging van controledna en dit neigt om het gen uit te schakelen, resulterend in gevlekte of donkere agoutibont in individuele muizen. Pups geboren uit moederdieren met het Avy-gen in kleur variërend van geel tot donker, maar de verhouding hangt af van de vachtkleur van de moeder; nesten van donkere (agouti) vrouwtjes hebben meer kans om donkere pups te bevatten. Verder wordt een hoger percentage donkere Nakomelingen waargenomen als zowel de moeder als de grootmoeder de donkere kleur hebben. Dus de agouti kleuring, die epigenetisch bepaald wordt (door het aantal methyl tags op het Avy gen) kan tot op zekere hoogte van de ene generatie naar de volgende overgaan.
eitjes en sperma ‘dragen gewoonlijk geen epigenetische effecten over’
hoewel we gevallen kunnen vinden waarin epigenetische effecten van ouders op nakomelingen lijken te duren, is dit meestal niet het geval en worden bijna alle epigenetische schakelaars of markeringen gereset in kiemcellen (eieren en sperma) en in de vroegste ontwikkelingsstadia van een embryo. Als dit niet het geval was, zou de verbazingwekkende ontwikkeling van een bevrucht ei tot een volledig gevormd wezen onmogelijk zijn.tot nu toe hebben we enkele specifieke gevallen van epigenetische Regulatie beschreven, maar we weten nu dat epigenetica in brede zin (hoe genen worden uitgedrukt en gebruikt, in plaats van de DNA-sequentie van de genen zelf) centraal staat in hoe een bevruchte eicel uiteindelijk een heel organisme kan veroorzaken en hoe cellen van, Laten we zeggen je huid, huidcellen blijven en verschillen van je hersencellen, ondanks het feit dat ze precies dezelfde genen. Kort na de bevruchting bestaat een zich ontwikkelend menselijk embryo uit een bal cellen die embryonale stamcellen worden genoemd. Elk van deze cellen heeft het vermogen om te leiden tot een van de soorten cellen in het lichaam als het embryo groeit (bijvoorbeeld hersencellen, huidcellen of bloedcellen). Daarentegen, 9 maanden later wanneer een baby wordt geboren, zijn de meeste cellen die zijn of haar lichaam vormen geëngageerd om een specifiek type cel met specifieke functies te zijn. Dus terwijl de cellen zich delen, ontwikkelt de bal van embryonale stamcellen zich geleidelijk tot alle celtypes en structuren van de baby op termijn. Om dit te laten gebeuren, moeten duizenden genen worden in-of uitgeschakeld op precies de juiste tijden en in de juiste cellen als een embryo groeit. Bijvoorbeeld, genen die het vezelige keratine-eiwit maken dat onze huid zijn kracht geeft, worden alleen ingeschakeld in huidcellen en niet in de ontwikkelende hersenen en genen die nodig zijn om hersencellen te ontwikkelen en hun verbindingen te maken, zijn ingeschakeld in de hersenen, maar niet in de huid.
tijdens de ontwikkeling moeten genen ‘aan’ en ‘uit’worden gezet. Epigenetische tags helpen bij deze
een zeer groot onderzoeksgebied van vandaag betreft hoe al dit gen dat in-en uitschakelt werkt, en een groot deel van dit proces maakt gebruik van de epigenetische chemische tags, met name acetyl-en methylhistonetags. Opdat die embryonale stamcellen tot alle andere types van cellen kunnen leiden, worden hun epigenetische schakelaars (bijna) volledig teruggesteld in vergelijking met volwassen cellen. Ik heb “bijna” tussen haakjes gezet zoals we weten van ingeprente genen en transgenerationele epigenetische overerving dat er uitzonderingen zijn.epigenetica, Dolly the sheep and friends in februari 1997 werd het schaap Dolly het beroemdste voorbeeld van haar soort. De reden voor haar roem is dat ze het eerste zoogdier was dat werd “gecreëerd” door een proces dat somatische celkernoverdracht wordt genoemd, of met andere woorden de eerste door de mens gemaakte kloon (door de mens gemaakt om te onderscheiden van eeneiige tweeling, die natuurlijke klonen zijn). Het proces dat leidde tot haar geboorte vereiste een rijpe eicel (een onbevrucht ei) van een vrouwelijk Schaap en een gewone cel van de uier van een tweede schaap. Eerst werd de kern (het deel dat het DNA bevat) uit de eicel verwijderd. Dit werd gedaan gebruikend een speciale microscoop aangezien hoewel oocytes vrij groot in vergelijking met andere cellen zijn, zij nog te klein zijn om met het blote oog te zien. Toen werd de kern van de uiercel in enucleated eicel ingebracht. Dolly had dus drie “moeders”: de donor van de eicel, de donor van de uiercel en de schapen die het zich ontwikkelende embryo voldragen. Er was geen vader bij betrokken. Hoewel dit proces zeer inefficiënt was en blijft, was het het eerste bewijs dat de genen van een volwassen zoogdiercel “epigenetisch kunnen worden geherprogrammeerd” terug naar de staat van de embryonale stamcellen die zich tot om het even welk ander type van cel kunnen ontwikkelen. Vervolgens is hetzelfde proces toegepast op andere soorten en kan medisch gebruik hebben in het genereren van cellen die weefsels beschadigd door letsel of ziekte kunnen herstellen.
samenvatting: het epigenoom en het ENCODE project – De “Large Hadron Collider” van de biologie
terwijl de term “genoom” verwijst naar de volledige DNA-sequentie van een organisme (drie miljard letters ervan voor de mens), verwijst het epigenoom naar het volledige patroon van epigenetische wijzigingen in alle genen, inclusief methyl-DNA-tags, methylhiston-tags, acetylhiston-tags en andere chemische tags die we niet hebben genoemd, in elk celtype van een organisme. Dit vertegenwoordigt een bijna onvoorstelbare hoeveelheid informatie, die zelfs het menselijk genoomproject overschaduwt. Toch is kennis van het epigenoom essentieel om een volledig antwoord te geven op enkele van de grootste vragen in de biologie, zoals: hoe ontwikkelen we ons van een bal van identieke cellen tot een heel organisme? waarom worden we ouder? en hoe kunnen we ziekten zoals kanker beter begrijpen? Niet verrassend dan, epigenetica en het epigenoom is een groot gebied van onderzoek. Een deel van het onderzoek op dit gebied wordt uitgevoerd door het ENCODE (Encyclopedia of DNA Elements) project, een lopende onderneming om patronen van epigenetische tags in vele verschillende soorten cellen voor het gehele menselijke genoom te identificeren (http://genome.ucsc.edu/ENCODE/). Het ENCODE project wordt soms vergeleken met de Large Hadron Collider of LHC in Zwitserland. De LHC is het grootste stuk wetenschappelijke apparatuur ooit gebouwd en de experimenten natuurkundige uitvoeren met het doel om de fundamentele details van de materie die deel uitmaakt van ons universum te onderzoeken. Hoewel biologen niet zo ‘ n spectaculair stukje kit hebben (of nodig hebben) voor hun onderzoek, is de poging om de complexiteit van het menselijk epigenoom te onderzoeken vergeleken met het LHC-project vanwege de schaal, complexiteit en de hoeveelheid informatie die wordt gecreëerd.
epigenetische fouten
epigenetica is een gebied waar onze wetenschappelijke kennis snel toeneemt. Een ding dat wetenschappers hebben ontdekt is dat epigenetische fouten vaak voorkomen in ziekten zoals kanker en in verouderende cellen. Als gevolg daarvan ontwikkelen wetenschappers geneesmiddelen die defecte epigenomen richten en een van de eerste voorbeelden is het gebruik van HDAC-remmers, vergelijkbaar met de verbinding die in koninginnengelei wordt gevonden. Uit de studie van vreemde patronen van overerving zoals genetische inprenting, de geel/agouti Avy muis, de all-vrouwelijke tortoiseshell kat populatie en andere gerelateerde fenomenen hebben biologen een hele nieuwe laag van informatie ontdekt die “bovenop” ligt van de DNA-sequentie van onze genen. Deze nieuwe ontdekkingen verklaren deze eerdere raadselachtige observaties, maar hebben ook een groot potentieel voor nieuwe inzichten en behandelingen voor menselijke ziekten.
verdere informatie:
- Bird, Adrian. “Epigenetica. Instant Expert No. 29′, New Scientist, 5 januari 2013, No. 2898.
- Carey, Nessa. ‘The Epigenetics Revolution: How Modern Biology is Rewriting Our Understanding of Genetics, Disease and Inheritance’. Uitgever: Icon Books. Paperback 1 maart 2012. ISBN-10: 1848313470. RRP prijs £9-99.
epigenetische invloeden en ziekte op de Website:
- http://www.nature.com/scitable/tpicpage/epigenetic-influences-and-disease-895
Leave a Reply