Overgangsmetall
det finnes en rekke egenskaper som deles av overgangselementene som ikke finnes i andre elementer, noe som resulterer fra det delvis fylte d-skallet. Disse inkluderer dannelsen av forbindelser hvis farge skyldes d-d elektroniske overganger dannelsen av forbindelser i mange oksidasjonstilstander, på grunn av det relativt lave energigapet mellom forskjellige mulige oksidasjonstilstander dannelsen av mange paramagnetiske forbindelser på grunn av tilstedeværelsen av uparede d-elektroner. Noen få forbindelser av hovedgruppeelementer er også paramagnetiske (f. eks. nitrogenoksid, oksygen)
de fleste overgangsmetaller kan bindes til en rekke ligander, noe som åpner for et bredt utvalg av overgangsmetallkomplekser.
Fargede forbindelser

3)
2 (rød); K
2Cr
2o
7 (oransje); k
2cro
4 (Gul); nicl
2 (turkis); cuso
4 (blå); kmno
4 (lilla).
Farge i overgangsserie metallforbindelser skyldes vanligvis elektroniske overganger av to hovedtyper.
- lade overføring overganger. Et elektron kan hoppe fra en overveiende ligand orbital til en overveiende metall orbital, noe som gir opphav til en ligand-til-metall charge-transfer (LMCT) overgang. Disse kan lettest oppstå når metallet er i høy oksidasjonstilstand. For eksempel skyldes fargen på kromat -, dikromat-og permanganationer lmct-overganger. Et annet eksempel er at kvikksølvjodid, HgI2, er rødt på grunn AV EN lmct-overgang.
EN METALL-til-ligand charge transfer (MLCT) overgang vil være mest sannsynlig når metallet er i en lav oksidasjon tilstand og ligand er lett redusert.
generelt gir ladeoverføringer mer intense farger enn d-d-overganger.
- d-d overganger. Et elektron hopper fra en d-orbital til en annen. I komplekser av overgangsmetaller har d-orbitaler ikke alle samme energi. Mønsteret for splitting av d orbitaler kan beregnes ved hjelp av krystallfeltteori. Omfanget av splittelsen avhenger av det spesielle metallet, dets oksidasjonstilstand og ligandernes natur. De faktiske energinivåene er vist På Tanabe-Sugano-diagrammer.
i sentrosymmetriske komplekser, som oktaedrale komplekser, er d-d-overganger forbudt Av Laporte-regelen og oppstår bare på grunn av vibronisk kobling der en molekylær vibrasjon oppstår sammen med en d-d-overgang. Tetraedrale komplekser har noe mer intens farge fordi blanding av d-og p-orbitaler er mulig når det ikke er noe senter for symmetri, så overganger er ikke rene d-d-overganger. Molarabsorpsjon (ε) av bånd forårsaket av dd-overganger er relativt lave, omtrent i området 5-500 M−1cm−1 (hvor M = mol dm−3). Noen d – d-overganger er spinn forbudt. Et eksempel forekommer i oktaediske, høy-spin komplekser av mangan (II), som har en d5 konfigurasjon der alle fem elektron har parallelle spinn; fargen på slike komplekser er mye svakere enn i komplekser med spin-tillatt overganger. Mange forbindelser av mangan (II) virker nesten fargeløse. Spekteret av 2 +
viser en maksimal molar absorptivitet på ca 0,04 M−1cm−1 i det synlige spektret.
Oksidasjonstilstander
et kjennetegn ved overgangsmetaller er at de viser to eller flere oksidasjonstilstander, som vanligvis varierer med en. For eksempel er forbindelser av vanadium kjent i alle oksidasjonstilstander mellom -1, slik som −
og +5, slik SOM VO3−
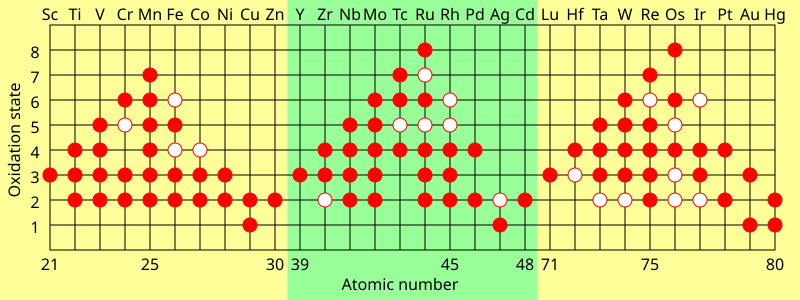
hovedgruppeelementer i grupper 13 til 18 viser også flere oksidasjonstilstander. De» vanlige » oksidasjonstilstandene til disse elementene varierer vanligvis med to i stedet for en. For eksempel finnes forbindelser av gallium i oksidasjonstilstander +1 og + 3 der det er et enkelt galliumatom. Ingen forbindelse Av Ga (II) er kjent: en slik forbindelse ville ha en upparet elektron og ville oppføre seg som et fritt radikal og bli ødelagt raskt. De eneste forbindelsene der gallium har en formell oksidasjonstilstand på + 2 er dimere forbindelser, slik som 2 –
, som inneholder En Ga-Ga-binding dannet fra den uparede elektronen på Hvert Ga-atom. Dermed er hovedforskjellen i oksidasjonstilstander, mellom overgangselementer og andre elementer, at oksidasjonstilstander er kjent der det er et enkelt atom av elementet og en eller flere uparede elektroner.
maksimal oksidasjonstilstand i første radovergangsmetaller er lik antall valenselektroner fra titan (+4) opp til mangan (+7), men avtar i de senere elementene. I den andre raden oppstår maksimumet med ruthenium (+8), og i tredje rad oppstår maksimumet med iridium (+9). I forbindelser som –
og OsO
4, oppnår elementene en stabil konfigurasjon ved kovalent binding.de laveste oksidasjonstilstandene er utstilt i metallkarbonylkomplekser som Cr (CO)
6 (oksidasjonstilstand null) og 2 –
(oksidasjonstilstand -2) der 18-elektronregelen overholdes. Disse kompleksene er også kovalente.
Ioniske forbindelser dannes for det meste med oksidasjonstilstander +2 og + 3. I vandig oppløsning blir ionene hydrert av (vanligvis) seks vannmolekyler arrangert oktaedralt.
Magnetisme
Overgangsmetallforbindelser er paramagnetiske når de har ett eller flere uparede d-elektroner. I oktaedrale komplekser med mellom fire og syv d elektroner er både høye spinn og lave spinntilstander mulige. Tetrahedrale overgangsmetallkomplekser som 2 –
er høye spinn fordi krystallfeltsplitningen er liten, slik at energien som skal oppnås i kraft av at elektronene er i lavere energiorbitaler, alltid er mindre enn energien som trengs for å koble opp spinnene. Noen forbindelser er diamagnetiske. Disse inkluderer oktaediske, lavspinns -, d6-og firkantede d8-komplekser. I disse tilfellene er krystallfeltsplitting slik at alle elektronene er paret opp.Ferromagnetisme oppstår når individuelle atomer er paramagnetiske og spinnvektorene er justert parallelt med hverandre i et krystallinsk materiale. Metallisk jern og legeringen alnico er eksempler på ferromagnetiske materialer som involverer overgangsmetaller. Anti-ferromagnetisme er et annet eksempel på en magnetisk egenskap som oppstår fra en bestemt justering av individuelle spinn i fast tilstand.
Katalytiske egenskaper
overgangsmetallene og deres forbindelser er kjent for deres homogene og heterogene katalytiske aktivitet. Denne aktiviteten tilskrives deres evne til å vedta flere oksidasjonstilstander og å danne komplekser. Vanadium (v) oksid (i kontaktprosessen), finfordelt jern (I Haber-prosessen) og nikkel (i katalytisk hydrogenering) er noen av eksemplene. Katalysatorer på en fast overflate (nanomaterialbaserte katalysatorer) involverer dannelse av bindinger mellom reaktantmolekyler og atomer av overflaten av katalysatoren (første radovergangsmetaller bruker 3d-og 4s-elektroner for binding). Dette har effekten av å øke konsentrasjonen av reaktantene på katalysatoroverflaten og også svekkelse av bindingene i de reagerende molekylene (aktiveringsenergien senkes). Også fordi overgangsmetallioner kan forandre deres oksidasjonstilstander, blir de mer effektive som katalysatorer.en interessant type katalyse oppstår når produktene av en reaksjon katalyserer reaksjonen som produserer mer katalysator (autokatalyse). Et eksempel er reaksjonen av oksalsyre med surgjort kaliumpermanganat (eller manganat (VII)). Når En Liten Mn2+ er produsert, kan den reagere Med MnO4-forming Mn3+. Dette reagerer deretter MED C2O4-ioner som danner Mn2+ igjen.
Fysiske egenskaper
som underforstått av navnet, er alle overgangsmetaller metaller og dermed ledere av elektrisitet.
generelt har overgangsmetaller høy tetthet og høye smeltepunkter og kokepunkter. Disse egenskapene skyldes metallisk binding av delokaliserte d-elektroner, noe som fører til kohesjon som øker med antall delte elektroner. Men gruppen 12 metaller har mye lavere smelte-og kokepunkter siden deres fulle d sub-skjell hindre d-d binding, som igjen har en tendens til å skille dem fra de aksepterte overgangsmetaller. Merkur har et smeltepunkt på -38.83 °C (-37.89 °F) og er en væske ved romtemperatur.
Leave a Reply