Natriumhydroksid
Natriumhydroksid Kjemiske Egenskaper, Bruksområder, Produksjon
Kjemiske Egenskaper
Natriumhydroksid er et hvitt, luktfritt, ikke-flyktig alkalisk materiale markedsført i fast form som pellets, flak, klumper eller pinner. Dens oppløselighet i vann er 111 vekt% og et damptrykk på 0mmHg (NIOSH, 1994).
det kan reagere med trikoletylen (TCE) for å danne brannfarlig dikloracetylen og med metaller for å danne hydrogengass (OEHHA, 1993). Dens reaktivitet med metaller bør vurderes i forhold til lagringsenheter og beholdere.
Natriumhydroksid er vanligvis tilgjengelig som en vandig løsning kjent som kaustisk soda, soda lut, eller enkel som lut. Den har ulike bruksområder, inkludert nøytralisering av syre; produksjon av papir, tekstiler, plast, etsende, fargestoffer, maling, malingsfjerner og såpe; raffinering av petroleum; galvanisering; metallrengjøring; hvitvasking; og oppvask. En voksende bruk har vært i ulovlig produksjon av metamfetamin.
Bruker
Natriumhydroksid (NaOH) er En av de mest nyttige industrielle natriumforbindelsene. Det er også kjent som lut eller kaustisk soda og er en av de sterkeste basalkaliene (høy pH-verdi)på husholdningsmarkedet. Den brukes som en renne og ovn renere, og det saponifies fett iproduksjon av såpe. Det må brukes med forsiktighet fordi det også er i stand til å produsere alvorlighudforbrenninger.
Beskrivelse
Natriumhydroksid, også kjent som lut og kaustisk soda, er et svært kaustisk stoff som brukes i små mengder i kosmetikk for å etablere og holde pH i et produkt.Natriumhydroksid er en ekstremt viktig forbindelse i våre liv fordi den har så mange bruksområder. Det er en svært vanlig base som brukes i kjemisk industri og brukes til mange ting, hvorav mange forekommer i vårt daglige liv. En av De mest kjente anvendelser Av Natriumhydroksid er bruken i unclogging avløp. Den kommer i mange forskjellige merker av avløpsrensere, men En av de vanligste Er Drano. Den kommer også i form av lut såpe som kan brukes til å vaske praktisk talt alt, fra retter til ansiktet ditt.
natriumhydroksydstruktur
ved romtemperatur er natriumhydroksyd et hvitt krystallinsk luktfritt fast stoff som absorberer fuktighet fra luften. Det er en produsert substans. Natriumhydroksid er en uorganisk forbindelse som brukes til å kontrollere pH-nivåene eller tjene som buffermiddel i kosmetikk og personlig pleieprodukter. Det ble historisk brukt i formuleringen av såper, men er for tiden sett i en rekke formler, inkludert badeprodukter, renseprodukter, dufter, fotpulver, hårfarger og farger, sminke, spikerprodukter, personlige renslighetsprodukter, sjampo, barberingsprodukter, depilatories, hudpleieprodukter og solbrunsprodukter, samt kjemiske hårrettemidler og hårbølgesett. Det er også en populær ingrediens i industrielle løsemidler som en kjemisk base for såper, ovnsrensere, vaskemidler og avløpsrensere på grunn av dets evne til å oppløse fett, oljer, fett og proteinbaserte innskudd, Ifølge Wikipedia. Mindre vanlig Er Natriumhydroksyd sett på som en ingrediens i tannkrem.Natriumhydroksid ER FDA godkjent,og har mottatt GRAS (Generelt Anerkjent Som Trygt) vurdering som et direkte tilsetningsstoff. Det brukes imidlertid primært i vask og kjemisk peeling av råvarer. Den er godkjent for bruk i kosmetikk og personlig pleieprodukter i varierende konsentrasjoner: 5 vektprosent i løsemidler for neglebånd, 2 vektprosent i rettetang for generell bruk, 4,5 vektprosent i rettetang for profesjonell bruk, opp til pH 12,7 i hårfjerningsmidler og opp til pH 11 i andre bruksområder som pH-justering.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxidehttp://sodiumhydroxide.weebly.com/uses.html
Kjemiske Egenskaper
Natriumhydroksid, NaOH,også referert til som kaustisk soda eller natriumhydrat(og tidligere kjent som lut), er en hvit,massiv, deliquescent krystallinsk fast stoff som er løselig i vann,alkohol og glyserol. Den smelter ved 318°C (606 AV) og er den mest brukte og tilgjengelige alkaliske kjemikalien. De fleste natriumhydroksid produseres som et samprodukt av klor ved bruk av elektrolytiske celler; cellene er av membran, kvikksølv eller membrantype. Noen natriumhydroksid er merket som produsert i cellene; de fleste fordampes og selges som 50% og 73% løsninger eller som vannfrie perler. De fleste kaustiske sluttbruk krever løsninger med relativt lave konsentrasjoner. Kaustisk soda brukes som et analytisk reagens og kjemisk mellomprodukt, i skure-og rengjøringsbad, i gummigjenvinning og petroleumsraffinering, i slukningsbad for varmebehandling av stål,i kutting og oppløselige oljer,i såper og vaskemidler, og i en rekke andre applikasjoner.
Kjemiske Egenskaper
NaOH er et hvitt, luktfritt, deliquescent materiale solgt som pellets, flak, klumper eller pinner. Vandige løsninger er kjent som soda lut
Kjemiske Egenskaper
Natriumhydroksid oppstår som en hvit eller nesten hvit smeltet masse. Det er tilgjengelig i små pellets, flak, pinner og andre former eller former. Det er hardt og sprøtt og viser en krystallinsk brudd. Sodiumhydroksid er svært deliquescent og ved eksponering for luft absorberer det raskt karbondioksid og vann.
Fysiske egenskaper
Hvite orthorhombic krystaller, produsert i form av pellets, klumper, pinner, perler, chips, flak eller løsninger; hygroskopisk; veldig korroderende; absorberer RASKT CO2 og vann fra luften; tetthet 2.13 g/cm3; smelter ved 323°C; fordamper ved 1388°C; damptrykk 1 torr ved 739°C og 5 torr ved 843°C; meget løselig i vann (110 g/100ml ved romtemperatur), genererer varme på oppløsning; Vandige løsninger svært alkalisk, ph På 0,5% løsning ca 13 og 0,05% løsning ca 12; løselig i metanol, etanol og glyserol (23,8 g/100 ml metanol og 13.9 g/100 mL etanol ved omgivelsestemperaturer.).
Bruker
Caustic soda er en av de mest bruktekjemikalier. Det brukes til å nøytralisere syrer; tomake natriumsalter; å utfelle metaller somderes hydroksyder; i petroleumsraffinering; i forsaponifisering av estere; i behandling av cellulose, plast og gummi; og i mangesyntetiske og analytiske applikasjoner.
Bruker
Natriumhydroksid selges kommersielt som vannfrie flak eller pellets eller som 50% eller 73% vandige løsninger. Den har utallige industrielle bruksområder og er en av de 10 beste kjemikaliene når det gjelder produksjon og bruk på global skala. Omtrent 15 millioner tonn natriumhydroksyd brukes årlig. Den største bruken, som bruker omtrent halvparten av produksjonen, er som base for å produsere andre kjemikalier. Det brukes til å kontrollere pH og nøytralisere syrer i kjemiske prosesser. Papirindustrien gjør utstrakt bruk av natriumhydoksid i masseprosessen. Natriumhydroksyd brukes til å skille fibre ved å oppløse forbindelses ligninet. Den brukes på lignende måte i produksjon av rayon fra cellulose. Natriumhydroksid er et viktig kjemikalie i såpen industry.In forsåpningsprosessen, triglyserider oppnådd fra dyr og planter oppvarmes i abasisk løsning for å gi glyserol og såpe: Natriumhydroksyd brukes i tekstilindustrien for bleking og behandling av tekstiler for å gjøre dem fargestoff lettere. Petroleumsindustrien bruker natriumhydroksid i boreslam og asa baktericid. Natriumhypokloritt (NaOCl) brukes mye til rengjøring og som desinfeksjonsmiddel.Vanlig husholdningsblegemiddel består av ca 5% natriumhypoklorittløsning. Natriumhypokloritt fremstilles ved å omsette klor med natriumhydroksid: Cl2(g) + 2naoh(aq) →NaOCl(aq) + NaCl(aq) + H2O(l). Natriumhydroksyd brukes i næringsmiddelindustrien for rengjøringog peeling frukt og grønnsaker. Natriumhydroksid er en mindre ingrediens i mange vanligehusholdningsprodukter, men i noen få kan det utgjøre mer enn halvparten av produktet. Dranokrystaller inneholder mellom 30% og 60% natriumhydroksid, og noen avløpsrensere kan bestå av 100% natriumhydroksid.
Bruker
Natriumhydroksyd Er et alkali som er løselig i vann, med en oppløselighet på 1 g i 1 ml vann. det brukes til å ødelegge de bitre kjemikaliene i oliven som skal bli svarte oliven. det fungerer også for å nøytralisere syrer i ulike matvarer.
Bruker
natriumhydroksid brukes til å justere et produkt pH for å gjøre det mer akseptabelt for huden. Det kalles ofte kaustisk soda, og fungerer ofte som et kjemisk reagens når man lager såpe. Hvis det er for konsentrert, kan det forårsake alvorlig hudirritasjon.
Bruker
Natriumhydroksid er en av de viktigste industrielle kjemikaliene. I volum er det i topp ti kjemikalier produsert i Usa. Det brukes i produksjon av et stort antall forbindelser, inkludert flere natriumsalter, i behandling av cellulose for å produsere rayon og cellofan, og i produksjon av såper, vaskemidler, masse og papir. Natriumhydroksid er et vanlig nøytraliserende middel for syrer i syrebasetitreringer og petroleumsraffinering. En annen viktig applikasjon er å trekke ut metaller fra malmene der alkali-fusjon, som fusjon med kaustisk soda, ofte brukes til å åpne malmene. I tillegg brukes natriumhydroksyd til å utfelle metaller som hydroksyder. Andre bruksområder er gjenvinning av gummi, oppløsning av kasein i plastproduksjon, raffinering av vegetabilske oljer, bearbeiding av tekstiler, som eluant i ionekromatografi, etsing og galvanisering, og som laboratoriereagens. Natriumhydroksid brukes også som en sterk base i mange organiske syntese-og basekatalyserte reaksjoner.
Bruker
NaOH-løsninger brukes til å nøytralisere syrer og lage natriumsalter, f. eks. i petroleumsraffinering for å fjerne svovelsyre og organiske syrer; å behandle cellulose ved å lage viskose rayon og cellofan; ved å gjenvinne gummi for å oppløse stoffet; ved å lage plast for å oppløse kasein. NaOH solutions hydrolyserer fett og danner såper; de utfeller alkaloider (baser) og de fleste metaller (som hydroksyder) fra vannløsninger av deres salter. Farmakeutisk hjelpemiddel(alkalizer).
Forberedelse
Natriumhydroksyd fremstilles sammen med klor ved elektrolyse av natriumkloridoppløsning. Ulike typer elektrolytiske celler brukes kommersielt. De inkluderer kvikksølvcellen, membrancellen og membrancellen.
en mettet løsning av saltlake elektrolyseres. Klorgass frigjøres ved anoden og natriumionet ved katoden. Nedbrytning av vann produserer hydrogen-og hydroksidioner. Hydroksidionet kombinerer med natriumion som danner NaOH. De totale elektrolytiske reaksjonene kan representeres som:
2na+ + 2Cl – + 2h2o → Cl2 (g) + H2 (g) + 2naoh (aq)
kvikksølvcellen fortsetter i to trinn som forekommer separat i to celler. Den første er kjent som saltlakecellen eller den primære elektrolyseren der natriumionavsetninger på kvikksølvkatoden danner amalgam, mens klorgass frigjøres ved anoden:
Na + + Cl-→ Na-hg (katode) + ½ cl2 (g) (anode)
i den andre cellen, kjent som dekomponeringscellen, brukes en grafittkatode mens natriumamalgam tjener som anode. Vann reagerer med amalgamets natriummetall i dekomponatoren:
Na-Hg + H2O → Na + + OH – + ½ 2 + Hg
i klor-alkalimembranceller brukes en membran for å skille klor frigjort ved anoden fra natriumhydroksidet og hydrogen generert ved katoden. Uten en membran vil det dannede natriumhydroksidet kombinere med klor for å danne natriumhypokloritt og klorat. I mange celler brukes asbestmembraner til slik separasjon. Mange typer membranceller er tilgjengelige.Natriumhydroksyd produseres enten som et vannfritt fast stoff eller som en 50% vandig løsning.
Definisjon
den viktigste kommersielle.
Produksjonsmetoder
Natriumhydroksid produseres ved elektrolyse av saltlake ved bruk av inerte elektroder. Klor utvikles som en gass ved anoden oghydrogen utvikles som en gass ved katoden. Fjerning av kloridog hydrogenioner forlater natrium – og hydroksydioner i oppløsning.Løsningen tørkes for å produsere det faste natriumhydroksidet.
en annen metode bruker kellner-Solvay cellen. Mettet natriumkloridoppløsning elektrolyseres mellom en karbonanode og flytende kvikksølvkatode. I dette tilfellet produseres natrium ikatode i stedet for hydrogen på grunn av beredskapen tilnatrium for å oppløse i kvikksølv. Natrium-kvikksølv amalgam erderetter utsatt for vann og en natriumhydroksydoppløsning er produsert.
Reaksjoner
Natriumhydroksid er sterkt alkalisk og kan reagere med syrer for å danne salter og vann.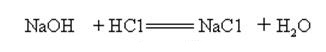
Natriumhydroksyd reagerer med sure oksider for å danne salt og vann, slik at natriumhydroksyd kan brukes til å absorbere syregasser i laboratoriet eller industrielt.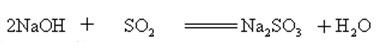
Natriumhydroksid kan reagere med vandige løsninger av mange metallsalter for å danne natriumsalter og metallhydroksider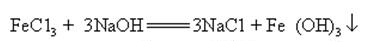
når natriumhydroksid og ammoniakk salt oppvarmes sammen, kan det frigi ammoniakk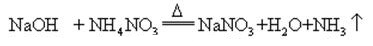
Natriumhydroksid er svært etsende, slik at glassflasker som lagrer natriumhydroksydløsninger, må være gummipropper, og glassstopper bør ikke brukes til å forhindre At En Kjemisk reaksjon åpnes. Natriumhydroksid er et viktig industrielt råmateriale,og kan produseres ved elektrolyse av saltoppløsning industrielt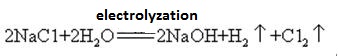
Generell Beskrivelse
et hvitt fast stoff. Etsende for metaller og vev. Brukes i kjemisk produksjon, petroleum raffinering, rengjøring forbindelser, avløp rengjøringsmidler.
Luft & Vannreaksjoner
Oppløselig i vann. Oppløsning kan frigjøre nok varme til å forårsake damping og sprut og antennes tilstøtende brennbart materiale .
Reaktivitetsprofil
KAUSTISK SODA (Natriumhydroksyd) er en sterk base. Reagerer raskt og eksotermisk med syrer, både organiske og uorganiske. Absorberer lett fuktighet fra luften for å gi kaustiske halvfaste stoffer som angriper aluminium og sink med utviklingen av brennbar hydrogengass. Katalyserer polymeriseringen av acetaldehyd og andre polymeriserbare forbindelser; disse reaksjonene kan forekomme voldsomt, for eksempel polymeriserer akrolein med ekstrem vold når de kommer i kontakt med alkaliske materialer som natriumhydroksyd . Reagerer med stor vold med fosforpentaoksid når den initieres ved lokal oppvarming . Kontakt (som tørkemiddel) med tetrahydrofuran, som ofte inneholder peroksider, kan være farlig – – – eksplosjoner har oppstått ved slik bruk av kjemisk lignende kaliumhydroksyd . Blanding med følgende stoffer i en lukket beholder førte til at temperaturen og trykket økte: iseddik, eddiksyre, akrolein, klorhydrin, klorosulfonsyre, etylencyanohydrin, glyoksal, saltsyre (36%), flussyre (48,7%), salpetersyre (70%), oleum, propiolakton, svovelsyre (96%) . Utilsiktet kontakt mellom et etsende rengjøringsmiddel (sannsynligvis inneholder natriumhydroksid) og Pentol forårsaket en voldsom eksplosjon. . Oppvarming med en blanding av metylalkohol og triklorbenzen under et forsøk på syntese førte til en plutselig økning i trykk og eksplosjon . Varmt Og / eller konsentrert NaOH kan føre til at hydrokinon brytes ned eksoterm ved forhøyet temperatur. (NFPA Pub. 491M, 1975, 385)
Fare
Etsende for vev i nærvær av fuktighet, sterkt irriterende for vev (øyne, hud, mucousmembraner og øvre luftveier), gift byingestion.
Helsefare
Sterk etsende virkning på kontaktet vev. INNÅNDING: støv kan forårsake skade på øvre luftveier og lunge selv, som produserer fra mild neseirritasjon til pneumonitt. SVELGING: alvorlig skade på slimhinner; alvorlig arrdannelse eller perforering kan forekomme. ØYEKONTAKT: gir alvorlig skade.
Helsefare
Natriumhydroksid er et svært korroderende stoffsom forårsaker skade på humant vev.Dens handling på huden er noe annerledesfra syreforbrenninger. Det er ingen umiddelbar smerte, men det trenger inn i huden. Det koagulerer ikkeprotein for å hindre ytterligere penetrasjon, og dermed kaustisk brenning kan bli alvorligog langsom helbredelse. Spilling av konsentrertløsninger i øynene kan føre til alvorligirritasjon eller permanent skade.
det er giftig ved inntak samt innånding av støv. Selv om oral toksisitet aven 5-10% løsning av kaustisk soda ble funnetå være lav i testdyr, høye doser påstørre konsentrasjoner kan forårsake oppkast, prostrasjon og sammenbrudd. Den orale dødelige doseni kaniner er 500 mg / kg (NIOSH 1986).
natriumhydroksid støv eller aerosoler areirritating til øyne, nese og hals. Forlenget eksponering for høye konsentrasjoner i luftkan produsere sårdannelse i nesepassasjen.
Brannfare
ikke-brennbart stoff i seg selv brenner ikke, men kan brytes ned ved oppvarming for å produsere etsende og / eller giftige gasser. Noen er oksidasjonsmidler og kan antennes brennbare stoffer (tre, papir, olje, klær, etc.). Kontakt med metaller kan utvikle brannfarlig hydrogengass. Beholdere kan eksplodere ved oppvarming.
Brennbarhet og Eksplosjonsevne
Natriumhydroksid og kaliumhydroksid er ikke brennbare som faste stoffer eller vannløsninger.
Farmasøytiske Anvendelser
Natriumhydroksyd er mye brukt i farmasøytiske formuleringer for åjuster ph av løsninger. Det kan også brukes til å reagere med svaksyrer for å danne salter.
Industriell bruk
Kaustisk soda (NaOH) regnes som den sterkeste alkaliske pH-regulatoren. Kaustisk sodaer et veldig aktivt stoff og er svært etsende. Størstedelen av kaustisk soda er produsertved elektrolyse av mettede saltlake (NaCl). Fra pH 7 til pH 14) ved en relativt lav dosering sammenlignet medandre alkaliske stoffer. Kommersielt er kaustisk soda tilgjengelig i vannfri form, men i de fleste gruveapplikasjoner leveres kaustisk soda som en 50% løsning.i mineralforedlingsindustrien brukes natriumhydroksyd mest for alkalinitetskontroll under behandling av ikke-metalliske mineraler. I grunnmetallflotasjon, bruk avnatriumhydroksyd er sjeldent.
Sikkerhetsprofil
Gift ved intraperitoneal rute. Moderat giftig ved inntak. Mutasjonsdata rapportert. Et etsende irriterende for hud, øyne og slimhinner. Ved oppvarming til dekomponering avgir det giftige Røyk Av NanO.
Sikkerhet
Natriumhydroksid er mye brukt i farmasøytisk og næringsmiddelindustrien og anses generelt som et ikke-giftig materiale ved lave konsentrasjoner. Ved høye konsentrasjoner er det et korrosivt irritasjonsmoment tilhuden, øynene og slimhinnene.
LD50 (mus, IP): 0,04 g / kg
LD50 (kanin, oral): 0,5 g /kg
Potensiell Eksponering
NaOH brukes til å nøytralisere syrer og lage natriumsalter i petroleumsraffinering, viskose rayon; cellofan, plastproduksjon; og i gjenvinning av løsninger av deres salter. Det brukes til fremstilling av mercerisert bomull, papir, eksplosiver og fargestoffer i metallrengjøring; elektrolytisk ekstraksjon av sink; tinnbelegg; oksydbelegg; hvitvasking, bleking, oppvask; og det brukes i kjemisk industri.
oppbevaring
splashgoggles og ugjennomtrengelige hansker bør brukes til enhver tid ved håndtering av disse stoffene for å hindre øye-og hudkontakt. Operasjoner med metallhydroksidløsninger som har potensial til å skape aerosoler, bør utføres i fumehood for å forhindre eksponering ved innånding. NaOH og KOH genererer betydelig varmenår oppløst i vann; når du blander med vann, legg alltid kaustikk sakte tilvann og rør kontinuerlig. Legg aldri vann i begrensede mengder til faststoffhydroksider. Beholdere av hydroksider skal oppbevares på et kjølig, tørt sted, skilt fra syrer og inkompatible stoffer.
lagring
Natriumhydroksid skal oppbevares i en lufttett ikke-metallisk beholder på et kjølig, tørt sted. Ved eksponering for luft absorberer sodiumhydroksid raskt fuktighet og væske, men senereblir fast igjen på grunn av absorpsjon av karbondioksid ogdannelse av natriumkarbonat.
Frakt
UN1823 NaOH, solid, Fareklasse: 8; Etiketter: 8-Etsende materiale. UN1824 NaOH, løsning, Fareklasse: 8; Etiketter: 8-Etsende materiale
Rensemetoder
vanlige urenheter er vann og natriumkarbonat. Natriumhydroksyd kan renses ved å oppløse 100g I 1l ren EtOH, filtrere løsningen under vakuum gjennom en fin sintret glassplate for å fjerne uoppløselige karbonater og halogenider. (Denne og påfølgende operasjoner skal utføres i en tørr, CO2-fri boks.) Løsningen er konsentrert under vakuum, ved hjelp av mild oppvarming, for å gi en tykk slurry av monoalkoholatet som overføres til en grov sintret glassplate og evakueres fri for moderlut. Etter vasking av krystallene flere ganger med renset alkohol for å fjerne spor av vann, tørkes de i vakuum, med mild oppvarming, i ca 30timer for å dekomponere alkoholatet, etterlater et fint hvitt krystallinsk pulver . ETSENDE. Natriumhydroksidløsninger (kaustisk), 14,77. Karbonat ion kan fjernes ved passasje gjennom en anion-utveksling kolonne(For Eksempel AMBERLITE IRA-400; OH-form). Kolonnen skal tilberedes fra kloridformen ved langsom forutgående passasje av natriumhydroksydoppløsning til avløpet ikke gir noen test for kloridioner. Etter bruk kan kolonnen regenereres ved vask med fortynnet HCl, deretter vann. På samme måte fjernes andre metallioner når En 1m (Eller mer fortynnet) NaOH-løsning føres gjennom En kolonne Av Dowex ionbytter A – 1 harpiks I Sin Na + – form. Alternativt kan karbonatforurensning reduseres ved å skylle pinner Av NaOH (analytisk reagenskvalitet) raskt med H2O, deretter oppløses i destillert H2O, eller ved å fremstille en konsentrert vandig Oppløsning Av NaOH og trekke av den klare supernatantvæsken. (Uoppløselig Na2CO3 er igjen. Karbonatforurensning kan reduseres ved å legge til et lite overskudd av konsentrert BaCl2 Eller Ba (OH)2 Til En NaOH-løsning, rist godt og la BaCO3-bunnfallet slå seg ned. Hvis tilstedeværelsen Av Ba i løsningen er uakseptabel, kan en elektrolytisk rensing brukes. For eksempel fremstilles natriumamalgam ved elektrolyse AV 3L av 30% NaOH med 500 ml ren kvikksølv for katode og en platinanode som passerer 15 Faradays ved 4Amps, i en tykkvegget polyetylenflaske. Flasken er deretter utstyrt med innløps-og utløpsrør, den brukte løsningen spyles ut AV CO2-fri N2. Amalgamet vaskes deretter grundig med et stort volum avionisert vann (med elektrolysestrømmen slått på for å minimere Tap Av Na). Til slutt plasseres en ren stålstang i løsningen med amalgamet (for å lette hydrogenutviklingen), reaksjonen får fortsette til en egnet konsentrasjon er nådd, før den overføres til et lagerbeholder og fortynnes etter behov .
Inkompatibilitet
en sterk base og en sterk oksidasjonsmiddel. Voldelig reaksjon med syre. Uforenlig med vann; brannfarlige væsker; organiske halogener, nitrometan og nitroforbindelser, brennbare stoffer. Absorberer raskt karbondioksid og vann fra luften. Kontakt med fuktighet eller vann kan generere varme. Etsende for metaller. Kontakt med sink, aluminium, tinn og bly i nærvær av fuktighet, som danner eksplosiv hydrogengass. Angriper noen former for plast, gummi eller belegg.
Inkompatibilitet
Natriumhydroksid er en sterk base og er uforenlig med noen forbindelse som lett gjennomgår hydrolyse eller oksidasjon. Det vilreagere med syrer, estere og etere, spesielt i vandig løsning.
Avfallshåndtering
Utslipp i tank som inneholder vann, nøytraliser, skyll deretter til kloakk med vann.
Regulatorisk Status
GRAS oppført. Godkjent for bruk som matadditiv I Europa.Inkludert I FDA Inaktive Ingrediensdatabasen(dentalpreparations; injeksjoner; inhalasjoner; nasal, oftalmisk, oral,otisk, rektal, aktuell og vaginal preparater). Inkludert i nonparenteralog parenterale medisiner lisensiert i STORBRITANNIA. Inkludert ikanadisk Liste Over Akseptable Ikke-medisinske Ingredienser.
Leave a Reply