Kovalente Forbindelser
du har nå en kort ide om hvorfor forskjellige elementer oppfører seg annerledes. Men vet du en stor del av det er på grunn av» naturen » av bindingene i forbindelsene. Akkurat som du og dine beste venner har en rekke forskjeller på grunn av de «indre» kvaliteter, så er tilfellet med ioniske og kovalente forbindelser. I dette kapitlet vil vi lære mer om begrepet kovalente forbindelser, se på deres egenskaper og mer.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Dette skyldes at atomene i de kovalente molekylene holdes veldig tett sammen. Hvert molekyl er faktisk ganske separat og tiltrekningskraften mellom de enkelte molekylene i en kovalent forbindelse har en tendens til å være svak.
vi trenger svært lite energi for å separere molekylene. Dette skyldes de attraktive kreftene mellom molekylene med fravær av total elektrisk ladning. Kovalente forbindelser er vanligvis gassformige molekyler ved romtemperatur og trykk. De kan også være væsker med lave relativt lave kokepunkter.
disse egenskapene kan tilskrives deres svake intermolekylære krefter som holder disse atomene sammen. Vi har imidlertid også mange faste kovalente forbindelser. De har lave smeltepunkter. Det er imidlertid interessant å merke seg at et lite antall av disse har en helt annen struktur. De danner store strukturer der et stort antall atomer holdes sammen. Dette er mulig på grunn av tilstedeværelsen av delte elektroner.disse gigantiske molekylære strukturer er i utgangspunktet gitter består av molekyler som holdes sammen av kovalente bindinger struktur. Disse kovalente bindingene er svært sterke. De har også en tendens til å være svært vanskelig med høye smeltepunkter som er forskjellig fra de fleste av de kovalente forbindelser. Eksemplet på denne typen kovalente forbindelser inkluderer diamant og grafitt av karbonatomnettverk. De inkluderer også silika av silisium og oksygenatomer nettverk.
Last Ned Kjemisk Bonding Cheat Sheet PDF VED å klikke På Nedlastingsknappen nedenfor


Bla gjennom Flere Emner under Kjemisk Bonding og Molekylær Struktur
- bindingsparametere
- grunnleggende om kjemisk binding
- Hybridisering
- hydrogenbinding
- ioniske eller elektrovalente forbindelser
- molekylær orbitalteori
- polaritet av bindinger
- resonansstrukturer
- valensbinding Teori
- VSEPR Teori
Generelle Egenskaper Av Kovalente Forbindelser
- Kovalente forbindelser har vanligvis lave smeltepunkter. Et unntak fra dette inkluderer molekyler av silika og diamanter som har et høyt smeltepunkt.
- disse forbindelsene har lave kokepunkter. Dette kan tilskrives deres svake tiltrekningskraft mellom de forskjellige bundne atomer. Van Der Waals styrker binder disse atomene.
- disse forbindelsene er vanligvis gasser og væsker med lavt koke-og smeltepunkt.
- de faste kovalente forbindelsene har myke strukturer som grafitt. Dette er på grunn av tilstedeværelsen av en sky av elektroner i mellom hvert lag av karbonatomer.
- Disse forbindelsene er ikke-ledere av elektrisk ladning. Fraværet av ladede ioner er hovedårsaken til dette. Et unntak fra dette er grafitt, hvor vi ser en sky av elektroner. Dette gjør grafitt til en god leder.
- De er også dårlige ledere av varme. Deres molekyler mangler frie elektroner og som hindrer strømmen av varmeenergi.
- Kovalente forbindelser har ikke polare egenskaper som en generell egenskap. Derfor er disse forbindelsene uoppløselige i vann. Vannmolekyler er ikke helt nøytrale og har en liten negativ ladning på oksygenatomet og små positive ladninger på hydrogenatomene, og siden kovalente forbindelser består av nøytrale molekyler eller molekyler med små ladninger og dermed ikke tiltrekkes vannmolekyler sterkt.
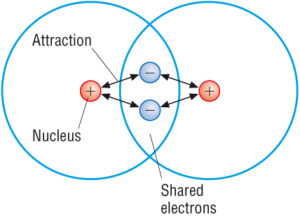
(Kilde: Google)
Fysiske Og Kjemiske Egenskaper
- de flytende kovalente forbindelsene fordamper. Dette betyr at molekylene av væsker og faste stoffer mister fra overflaten i luften.
- disse forbindelsene har meget mindre affinitet mellom deres molekyler.
- Ulike kovalente forbindelser har sine egne karakteristiske formede molekyler. Deres obligasjoner er rettet mot forhåndsinnstilte vinkler.
- Noen forbindelser, spesielt medisiner, er oppløselige i vann. Resten er løselig i olje.De fleste kovalente forbindelsene er ikke-polare eller har svært liten tendens til å splitte helt for å danne ioner og dermed aldri lede elektrisitet.
- ved normal temperatur og trykk finner vi disse forbindelsene som enten væsker eller gasser. Men det er også faste stoffer, og de har høyere molekylvekt.
- de kovalente forbindelsene krystaller er av to typer: en som har svak van Der Waal kraft som holder disse sammen som I Jod. Disse er lett smeltbare og flyktige, Den andre har et stort nettverk av atomer som setter opp makromolekylene.
- disse forbindelsene er oppløselige i organiske løsningsmidler som eter og benzen.
- Kovalente bindinger er retningsbestemt i naturen. Derfor viser de fenomenet isomerisme.
- kovalente forbindelser majorly har en svært langsom rate av reaksjoner, i motsetning til de forskjellige ioniske forbindelser.
Løste Eksempler for Deg
Spørsmål: Hvorfor er kovalente forbindelser ikke oppløselige i vann?
Svar: Vannmolekyler er ikke helt nøytrale. Disse molekylene har en liten negativ ladning på oksygenatomet og små positive ladninger på hydrogenatomer. På den annen side vet vi at kovalente forbindelser består av nøytrale molekyler eller molekyler med små ladninger. Det er av denne grunn at disse forbindelsene ikke er tiltrukket av vannmolekyler sterkt.
Leave a Reply