Kjemisk binding
Kjemiske bindinger er attraksjonene mellom atomer som holder dem sammen for å danne forbindelser. Det er tre hovedtyper av binding: kovalente bindinger som binder sammen molekylære forbindelser, ioniske bindinger som binder salter og ioniske krystaller, og metalliske bindinger som binder atomer av metaller.
Molekyler og Kovalente Bindinger
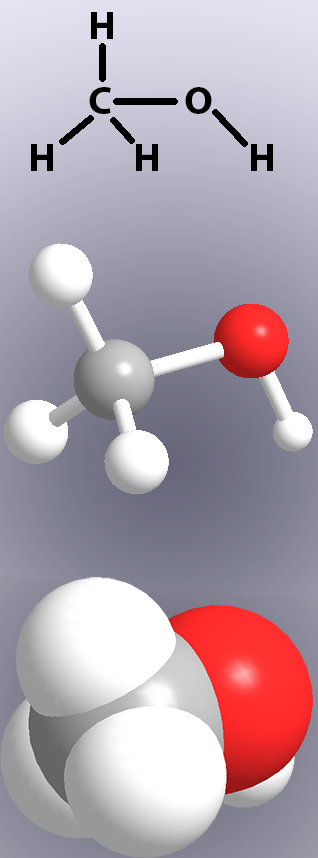
de fleste drivstoff, plast og naturlige produkter er molekylære forbindelser, laget av atomer bundet sammen til molekyler. Bindingstypen som forbinder atomene i et molekyl er kovalent binding, som oppstår når de ytre elektronene av to atomer deles mellom dem, og skaper en tiltrekning mellom de to atomer. Kovalente bindinger vises i kjemiske strukturer ved linjer (Figur 1, øverst) og i modeller ved enten å vise ‘pinner’ eller overlappingen av atomene (Figur 1, midt og bunn). elektronene i en kovalent binding deles ikke alltid likt mellom de to atomene. Når delingen er ulik, vil ett atom ha en veldig liten positiv ladning, og det andre atomet vil være litt negativt. Dette kasser en liten elektrisk dipol-molekyler som inneholder en dipol er polare forbindelser. Hvorvidt et molekyl er polar eller ikke-polar vil påvirke dets egenskaper, som smelting og kokepunkter, og hydrogenbinding.
Les mer om kovalent binding på Kjemi LibreText.
Ionisk Og Metallisk Binding
mens kovalent binding innebærer deling av elektroner mellom to atomer, innebærer ionisk binding fullstendig overføring av elektroner fra ett atom til et annet, og skaper positive og negative ioner. Disse ionene holdes deretter sammen av tiltrekningen mellom deres motsatte ladninger. Ioniske forbindelser danner krystaller basert på disse attraksjonene. Metallisk binding innebærer fullstendig deling av valenselektronene av metallatomer, og skaper et «elektronhav» der elektroner er fri til å bevege seg. Dette er en del av årsaken til metallets høye ledningsevne. Les mer om metallisk binding på Kjemi LibreText
Energi og Kjemiske Bindinger
generelt vil energi frigjøres når en binding dannes mellom to atomer, uansett hvilken type binding. På samme måte, hvis en binding allerede eksisterer mellom to atomer, vil energi være nødvendig for å bryte den. Mengden energi som kreves for å bryte en obligasjon er den samme som mengden energi som frigjøres når den dannes. De fleste kjemiske reaksjoner involverer både bryte og lage kjemiske bindinger. Hvis energien som frigjøres ved å danne nye bindinger er større enn energien som trengs for å bryte de «gamle» bindingene, vil energi bli frigjort samlet ved reaksjonen. Denne energien kan gå tapt som varme, eller kan brukes til strøm. for eksempel følger forbrenningen av metan (CH4) denne kjemiske reaksjonen:
denne reaksjonen innebærer brudd på de fire karbon-hydrogenbindingene i metan og oksygen-oksygenbindingen I O2. Nye bindinger som dannes er de to karbon-oksygenbindingene (I CO2) og hydrogen-oksygenbindingene (I H2O). Disse nye obligasjonene har mindre energi samlet enn de opprinnelige obligasjonene, så energi vil bli frigjort av denne reaksjonen. Å frigjøre energi er en egenskap ved forbrenningsreaksjoner-du har kanskje lagt merke til dette når du føler en varm flamme. Animasjonen nedenfor illustrerer hydrokarbonforbrenningen av metan. Siden en stor mengde energi frigjøres når co2 og H2O dannes ved forbrenning av hydrokarboner som metan, er disse en god primær energikilde. Det betyr også at en stor mengde energi vil være nødvendig for å bryte bindingene I CO2 og danne andre molekyler. Dette er en grunn til at fotosyntese krever så mye energi (fra sollys) for å konvertere CO2 til karbohydrater.
For Videre Lesning
- Kjemisk Energi
- Forbrenning
- Primær energi
- energi konvertering teknologi
- eller utforske en tilfeldig side
Leave a Reply