Kjemi: Hva Er Syrer og Baser?
Hva Er Syrer og Baser?
Selv om jeg har fortalt deg at syrer og baser ikke er vanskelig å forstå, har jeg dårlige nyheter: Det er ikke en, men tre vanlige definisjoner som brukes til å beskrive syrer og baser: Arrhenius syrer og baser, Brnsted-Lowry syrer og baser, Og Lewis syrer og baser. Selv om dette gjør det høres ut som om du må lære om syrer og baser tre ganger, den gode nyheten er at for mange praktiske formål, disse tre definisjonene er omtrent tilsvarende.
Arrhenius Syrer og Baser
Langt tilbake på slutten Av 1800-tallet kom Vår gamle venn Svante Arrhenius opp med definisjoner av syrer og baser mens han jobbet med kinetikkproblemer.
ifølge Arrhenius er syrer forbindelser som bryter opp i vann for å gi av hydronium (H+) ioner. Et vanlig eksempel På En Arrhenius syre er saltsyre (HCl):
- HCl ? H + + Cl-
formlene for syrer starter vanligvis med hydrogen, selv om organiske syrer er et bemerkelsesverdig unntak. Navnene og formlene til noen vanlige syrer er gitt i tabellen nedenfor:
| Syrenavn | Formel | HCl | salpetersyre | HNO3 |
|---|---|
| fosforsyre | h3po4 | h2so4 |
| c2h4o2 |
arrhenius baser er definert som forbindelser som forårsaker dannelsen av hydroksidionet når det plasseres i vann. Et Eksempel På En Arrhenius base er natriumhydroksid (NaOH):
- NaOH ? Na + + OH-
Baser har vanligvis «OH» i formlene, selv om det er unntak. For eksempel inneholder ammoniakk (NH3) ikke hydroksidioner, men danner dem når det reagerer med vann:
- NH3 + H2O ? NH4+ + OH –
navnene og formlene til noen vanlige baser er i følgende tabell:
| Base Navn | Formel | ammoniakk | NH3 |
|---|---|---|
| KOH | ||
| natrium bikarbonat | nahco3 | |
| na2co3 | ||
| natriumhydroksid | naoh |
noen oksider danner syrer eller baser når vann tilsettes. Fordi disse forbindelsene ikke inneholder Noen H + eller OH – ioner med mindre de reagerer med vann, kalles de » anhydrider.»Vanligvis er oksider av ikke-metaller syreanhydrider (de danner syre når de plasseres i vann), og oksider av metaller er baseanhydrider (danner en base når de plasseres i vann).
Brnsted-Lowry Syrer og Baser
tidlig på 1900-tallet ble En alternativ definisjon for syrer og baser foreslått Av Johannes Brnsted og Thomas Lowry for å redegjøre for det faktum at ammoniakk kan nøytralisere surheten Av HCl selv om vann ikke er til stede. Dette fenomenet viste dem at ammoniakk er en base, selv når det ikke er vann rundt for å danne hydroksidioner.
det er mange forskjellige navn og formler som brukes til å beskrive hydroniumionet. Selv om formelen tidligere ble vist som «H+», er den noen ganger skrevet SOM «H3O» fordi dette er ion dannet Når H+ kombinerer med vann. En annen vanlig måte å referere til hydronium ioner er bare å kalle dem » protoner.»Dette navnet kommer fra Det faktum At H + representerer et hydrogenatom (en proton og en elektron) som har mistet sin elektron, og bare etterlater det bare protonet bak.
en Brnsted-Lowry syre er definert som en forbindelse som gir hydroniumioner til en annen forbindelse?for eksempel gir saltsyre H + – ioner til forbindelser den reagerer med. Brnsted-Lowry baser er forbindelser som kan akseptere hydroniumioner?når ammoniakk får en hydroniumion Fra HCl, danner det ammoniumionet.
følgende ligning representerer reaksjonen Av En Brnsted-Lowry syre med En Brnsted-Lowry base:
- HNO3 + NH3 ? NO3 – + NH4 +
i denne reaksjonen oppfører salpetersyre seg som en syre fordi den gir et proton til ammoniakk. Ammoniak oppfører seg som en base fordi den aksepterer protonen fra salpetersyre.
men hvis du ser på den andre siden av ligningen, finner vi nitrat-og ammoniumioner. Fordi nitrationen kan akseptere protoner fra ammoniumionet (for å danne HNO3), er nitrationen en svært svak Brnsted-Lowry-base. Fordi ammoniumionet har en ekstra proton å donere (i dette tilfellet til nitrationet), er Det En Brnsted-Lowry syre.
nitrationet er basert på salpetersyremolekylet, så vi sier at det er konjugatbasen av salpetersyre. På samme måte er ammoniumionet konjugatsyren av ammoniakk. Sammen blir en syre med sin konjugatbase (SOM HNO3 og NO3-) eller en base med sin konjugatsyre (SOM NH3 OG NH4+) referert til som et konjugat syre-basepar.
Lewis Syrer og Baser
I brnsted-Lowry-definisjonen av syrer og baser er en base definert som en forbindelse som kan akseptere et proton. Men hvordan aksepterer det protonet?
en funksjon Som Brnsted-Lowry baser har til felles med hverandre er at de har et udelt par elektroner. Når en hydroniumion kommer vandrende av molekylet, vil noen ganger de ensomme parene nå ut og ta tak i det. Et eksempel på dette er når ammoniakk aksepterer et proton i en sur løsning:
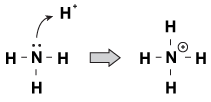
En måte å se på denne prosessen er at ammoniakkatomet donerer sitt ensomme par til protonen. Fordi de ensomme parene driver denne kjemiske reaksjonen, har vi en ny definisjon av surhet og basicitet, kalt «Lewis surhet/basicitet.»En Lewis base er en forbindelse som donerer et elektronpar til en annen forbindelse (ammoniakk i vårt eksempel). En Lewis syre er en forbindelse som aksepterer et elektronpar (H+ ion i vårt eksempel).
Lewis baser Er kjemikalier som kan donere elektronpar. Lewis syrer er kjemikalier som kan akseptere dem.
Selv om vi hadde ammoniakk som donerte et ensomt par til et proton i vårt eksempel, kan det ensomme paret i ammoniakk reagere med mange andre forbindelser også. For eksempel kan ammoniakk donere sine ensomme par elektroner TIL BH3 ved følgende prosess:

Figur 23.2 det ensomme paret på ammoniakk fester seg TIL BH3.
i denne prosessen er ammoniakk Lewis-basen OG BH3 Er Lewis-syren.
Generelt Er Lewis-definisjonen av syrer og baser den mest nyttige fordi Den er den mest inkluderende av de tre definisjonene. For Eksempel Inkluderer Brnsted-Lowry-definisjonen AV en syre HF, men IKKE BH3, som ikke mister et proton når det festes av de ensomme parene på En Lewis-base.
Utdrag Fra Komplett Idiot Guide Til Kjemi 2003 Av Ian Guch. Alle rettigheter forbeholdt inkludert retten til reproduksjon helt eller delvis i enhver form. Brukes etter avtale Med Alpha Books, et medlem Av Penguin Group (USA) Inc.
for å bestille denne boken direkte fra utgiveren, besøk Penguin USA nettside eller ring 1-800-253-6476. Du kan også kjøpe denne boken på Amazon.com og Barnes & Edel.
Leave a Reply