Hvilket Er Det Mest Reaktive Elementet i Det Periodiske Bordet?
Fluor er identifisert som det mest reaktive ikke-metall og det mest elektronegative elementet i det periodiske bordet, noe som gjør Det til det sterkeste oksidasjonsmidlet. Cesium er det mest reaktive metallet i det periodiske bordet, så mye at arbeid med dette metallet ofte slutter i eksplosjoner!
hva sa en kjemiker til en annen da han fant ham fornærmet? «Hvorfor er du natrium distressed? Jeg tror du overreagerer!»Ser du hva jeg gjorde der? Noen ganger lurer jeg på hvorfor-til tross for min hilarity-jeg finner det veldig vanskelig å få venner…
uansett, annet enn mine dårlige karakterer, er det første som kommer til å tenke når jeg tenker på kjemi labfrakker, merkelig formede kar, som om refleksjoner fra karnevalspeil og brennende eksplosjoner. Nå og da mumler noen «reaksjon» eller «reaktivitet», vilkår så allestedsnærværende at du finner dem infiltrere kjemi bøker til deres aller siste side. Dette er akkurat det vi er opptatt av akkurat nå.

Uten teknisk jargong, er en «reaksjon» akkurat hva det betyr, et svar. Reaktivitet, derimot, kan defineres som mål på hvor lett en kjemisk art vil delta i en reaksjon og danne kjemiske bindinger. Så blir spørsmålet-hvilket element er det enkleste å anspore – Men først…
hva bestemmer reaktiviteten til et element?
enkelt sagt er en kjemisk reaksjon den perfekte muligheten for kjøpere og selgere til å kjøpe og selge varer. Kjøpere og selgere er kjemiske elementer. Varene er elektroner og valutaen som utveksles er energi.
hensikten med denne handelen er å oppnå stabilitet, en optimal konfigurasjon av elektroner, som oppnås når enten et elements valens (ytterste) skall er helt fylt eller tømt. I utgangspunktet kan et element kjøpe flere elektroner for å fylle sitt nest siste skall eller selge dem for å tømme det.

jo færre elektronene som er involvert, jo mindre energikostnader. Alle som er kjent med naturens parsimonious måte å fungere på, vil gjette at handler som krever minst mulig energi, er de som mest sannsynlig vil oppstå. Dette er fornuftig, da et element foretrekker å miste elektroner og gjøre seg tom hvis det ytre skallet er mindre enn halvfylt, eller få noe til å fylle seg selv, hvis det er mer enn halvfylt. Kjøpe seks når du kan bare miste to ville være regelrett tåpelig, men enda viktigere, dyrt!
reaktivitet er således en funksjon av hvor lett et element mister eller får elektroner.
hvordan estimerer vi et elements insentiver?
det periodiske bordet og dets»trender»
hvordan finner vi ut om et element er en kjøper eller selger? Vi refererer til periodisk tabell.
det periodiske bordet er en påminnelse om at forskere er borderline OCD og ikke kan hjelpe, men organisere alt på en ekstremt pen og bestilt måte. Den periodiske tabellen organiserer hvert element vi kjenner til på en samlokalisert måte.
tabellen arrangerer elementer i henhold til deres atomnummer, som er det samme som antall protoner eller elektroner de omfatter. (Er det ikke rart at de pleier å være akkurat det samme ?)
Trend 1
antall elektroner i valensskallet øker med en som vi analyserer gjennom hvert element på rad, selv om antall skall forblir det samme. Antall skall kan utledes fra radnummeret. For eksempel vil hvert element i den andre raden inneholde bare to skall og så videre.
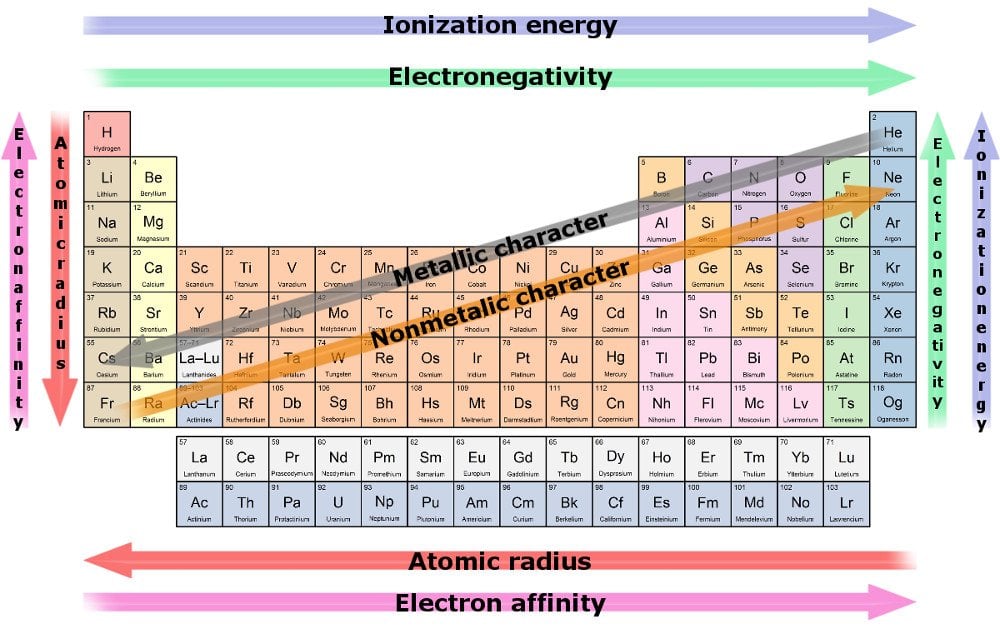
en konsekvens av denne trenden er at atomradius avtar når vi beveger oss mot en rads siste bosatt. Årsaken er at økningen i elektroner blir speilet av økningen i protoner i midten, mens den tidligere må kramme inn i samme skall. I tug-o ‘ – krigen mellom trekkprotonene og de økende elektronene, vinner den tidligere, noe som resulterer i en større kjernefysisk tiltrekning, trekker alle skallene nærmere den.
derfor, på grunn av en sterk tiltrekningskraft, er et element mer sannsynlig å kjøpe eller få elektroner når vi beveger oss langs en rad. Målet på et element evne til å trekke elektroner mot det er kjent som elektronegativitet. Det mest elektro-negative elementet er det mest sannsynlige å stjele elektroner og reagere raskest.
Trend 2
en annen trend er økningen i elementets radius når vi beveger oss ned i en kolonne, mens antall valenselektroner forblir det samme, selv om atomnummeret fortsetter å øke. Dette skyldes at økningen i elektroner er parallell med en økning i skall. Tungmetaller har økt radius, spesielt de på den ytterste bunnen. De illustrerer den fattigste kjernefysiske attraksjonen og har dermed et dårlig grep på sine ytre elektroner.

målet på et element evne til å miste elektroner er kjent som elektro-positivitet, og det øker når vi beveger oss ned en kolonne. Igjen er det mest elektropositive elementet det som mest sannsynlig vil gi opp sine elektroner og reagere raskest.
nå som vi kjenner reglene, la oss avsløre vinnerne.
mest reaktive ikke-metall-Fluor
Fluor er det første elementet i halogengruppen. Det er en blekgul, diatomisk, svært etsende, brennbar gass med en skarp lukt. Dens atomnummer er 9, og har en jam-pakket 7 elektroner i sin valens skall. Videre ligger den i den andre raden, noe som innebærer at alle sine 9 elektroner på en eller annen måte er proppet inn i bare 2 skall.
et 7-elektron valensskall krever at det bare får en enkelt elektron for å fullføre sitt endelige skall og oppnå stabilitet, noe som ikke er en stor prestasjon når du vurderer sin lille størrelse og kraftige nukleare trekk. Fluor er identifisert som det mest elektronegative elementet i det periodiske bordet, noe som gjør det til det sterkeste oksidasjonsmidlet. Det er det mest reaktive ikke-metallet.

Fluor er så reaktivt at Det kan brenne stoffer som man generelt ville tenke på som ikke-brennbart! Det kan brenne glass, vann og til og med sand! Dens promiskuitet gjør det umulig å lagre eller isolere det i sin reneste form. På grunn av sin feral reaktivitet, sin tidlige historie med isolasjon og eksperimentering er fylt med dødsulykker. Ja … dødelig.
Mest reaktivt metall – Cesium
Cesium er et gullfarget metall som reagerer eksplosivt med luft og vann. Atomnummeret er 55. Cesium ligger i den første kolonnen og den andre til siste rad. Som vi har diskutert, er radiusen til et element så lavt i kolonnen ganske stort sammenlignet med elementene ovenfor.

(Bilde Kreditt : Dnn87 / Wikimedia Commons)
den store radiusen gjør sitt kjernefysiske trekk ineffektivt og gjør det veldig klønete. Den store størrelsen gjør den svært utsatt for ionisering. Det er svært acquiescent og gir lett opp enkelt elektron i sin valens skallet for å oppnå stabilitet, noe som gjør det svært reaktiv. Cesium er det mest reaktive metallet i det periodiske bordet, så mye at arbeid med dette metallet ofte slutter i eksplosjoner!
Francium
Francium er det siste elementet i den første kolonnen, sitter like under Cesium, noe som gjør det til det største atomet i kolonnen. Logisk ville man utlede At Francium må ha en overlegen reaktivitet sammenlignet med Cesium, men dette er ikke tilfelle.
det anslås at Det ikke er mer enn en unse av Det I Jordskorpen om gangen. Siden det er så lite naturlig, må forskere produsere det for å studere det.

(Bilde Kreditt : MarlonMarin1 / Wikimedia Commons)
selv om det på en eller annen måte er isolert, varer det ikke lenge. Francium er radioaktivt i naturen, har en halveringstid på bare 22 minutter, så det henfaller før det får en sjanse til å reagere! Videre fører tilstedeværelsen av så mange protoner til at elektronene beveger seg rundt med utrolig høye hastigheter. Som Einstein innså, på skalaer så små og hastigheter så høye, begynner merkelige ting å skje-elektronene snuggle litt nærmere kjernen enn man logisk ville forvente, noe som gjør dem litt vanskeligere å bli kvitt.
så det ser ut Til At Francium er det mest reaktive elementet, dessverre teoretisk.
Spoiler alert!
du har kanskje lagt merke til at de to elementene som anses å være mest reaktive, er vinnere bare i sine spesifikke kategorier-metaller og ikke-metaller. Beklager å være en buzzkill, men det er ikke noe definitivt svar på hvem-er-den-mest-reaktive-element-blant-alle, fordi det tar to til tango.
man kan spørre hvilket element som er mest reaktivt Med Natrium? Svaret er Da Fluor, ikke Cesium. Eller kanskje du vil vite hvilket element som er mest reaktivt Med Nitrogen. Dens Litium! Shocker!
begrepet reaktivitet blir ofte notorisk feilfortolket. Spørsmålet er tvetydig, og noe ufullstendig, som denne artikkelen forhåpentligvis viser.
Leave a Reply