Førstelinjebehandling for Metastatisk Kastratresistent Prostatakreft
I 2019 Står Prostatakreft (PCa) for nesten 1 av 5 nye kreftdiagnoser hos menn i USA.1 de siste årene har den totale forekomsten av prostatakreft (pca) gått ned med ca.7% per år.1 den kraftige nedgangen i forekomsten har ofte blitt tilskrevet redusert prostata-spesifikt antigen (PSA) testing fra 2008 til 2013. Den reduserte bruken AV PSA-screening ble forårsaket Av United States (US) Preventive Services Task Force anbefalinger mot rutinemessig PSA-screening. Dette var en grad d anbefaling spesielt hos menn i alderen 75 år og eldre, som ble erklært i 2008, og senere utvidet til alle menn i 2011, på grunn av økende bekymringer for overdiagnose og overbehandling.2 selv om forekomsten AV PSA-testing stoppet avtagende og stabilisert fra 2013 til 2015,3, er effekten av screening reduksjon på forekomsten av avansert sykdom fortsatt uklart. En analyse av et stort kreftregister som dekker 89% AV den AMERIKANSKE befolkningen, rapporterte at den generelle nedgangen i pca-forekomsten faktisk maskerer en økning i fjernstadiediagnoser fra 2010 over alder og rase.4
Uavhengig av gitt behandling, utvikler omtrent 20% -30% av pasientene med lokalisert PCa seg til metastatisk sykdom, som vanligvis behandles med hormonbehandling.5 Dette kan gis gjennom kirurgisk kastrering (bilateral orkiektomi) eller gjennom medisinsk kastrering ved bruk av androgen deprivasjonsbehandling (adt). Begge metodene oppnår et kastratnivå av serumtestosteron som regnes som standard for behandling av metastatisk hormonfølsom pca (mHSPC). Imidlertid er mHSPC bestemt for å utvikle seg til metastatisk kastratresistent prostatakreft (mCRPC).6 den kastratresistente prostatakreft (CRPC) tilstanden er definert som sykdomsprogresjon til tross for å nå kastratestosteronnivåer (serumtestosteron < 50 ng / dL eller 1.7 nmol / L), og kan presentere som enten en kontinuerlig økning i serum PSA nivåer, progresjon av eksisterende sykdom, og / eller utseendet av nye metastaser.7 CRPC har en median overlevelse på omtrent tre år8 og er forbundet med en signifikant forverring av livskvaliteten.9 den eksakte mekanismen for overgang fra mHSPC til mCRPC er fortsatt uklart. Det er imidlertid kjent at til tross for kastratnivåer av androgener, forblir androgenreseptoren (AR) aktiv og fortsetter å drive PCa-progresjon i CRPC.10 Dette har ført til utvikling av nye agenter rettet mot ytterligere redusert androgenproduksjon eller blokkering AV AR-funksjon. Det er imidlertid andre biologiske veier som fungerer uavhengig av androgen signalering og også resultere I CRPC.
Flere signifikante skift har skjedd i behandlingsmulighetene i mHSPC-rommet, noe som resulterer i betydelig overlevelsesfordel (vennligst se «den raskt utviklende styringsstrategien for metastatisk Hormonfølsom Prostatakreft»-lenken), inkludert innføring av kjemoterapi i CHAARTED study11 og STAMPEDE trial,12 tillegg av abirateronacetat og prednison I LATITUDE study13 og STAMPEDE trial,14 tillegg av enzalutamid i ARCHES trial15 og ENZAMET-studien, 16 og til slutt, tillegg av abirateronacetat og prednison I LATITUDE study13 og STAMPEDE trial, 14 tillegg av enzalutamid i ARCHES trial15 og ENZAMET-studien, 16 og til slutt, tillegg av apalutamid, et oralt ikke-steroidalt antiandrogen, som enzalutamid binder seg direkte til det ligandbindende domenet TIL AR og forhindrer ar-translokasjon, DNA-binding og AR-mediert transkripsjon.17 TITAN-studien viste fordel for TOTAL overlevelse (OS) hos apalutamidbehandlede mHSPC-pasienter.18 Apalutamid har også vist fordel i forhold til placebo i ikke-metastatisk CRPC (nmCRP) – innstillingen i DEN SPARTANSKE fase 3 placebokontrollerte studien, 19 tilsvarende fordelen vist av enzalutamidbehandlede ikke-metastatiske kastratresistente prostatakreft (nmCRPC) – pasienter, I PROSPER-trial20 (se lenken «de nye behandlingene for ikke-metastatisk kastratresistent prostatakreft»). Disse behandlingsfremskrittene i mHSPC-og nmCRPC-innstillingen har reist spørsmål om hvilke behandlingsalternativer som bør tilbys til pasienter i mCRPC-innstillingen.21
behandlingen av menn MED CRPC har dramatisk endret seg de siste 15 årene. Før 2004, da pasienter mislyktes primær ADT, ble behandlinger administrert utelukkende for palliasjon. The landmark trials Av Tannock et al.22 og Petrylak et al.23 i 2004 var de første til å introdusere docetaxel kjemoterapi hos mCRPC-pasienter som ble vist å forbedre overlevelsen. Men siden docetaxel ble GODKJENT AV FDA, har fem andre fordelaktige legemidler som viser en overlevelsesfordel, BLITT FDA-godkjent basert på randomiserte kliniske studier (Tabell 1). Disse inkluderer enzalutamid og abirateron, som spesifikt påvirker androgenaksen, sipuleucel-T, som stimulerer immunsystemet; 24 cabazitaxel, som er et annet kjemoterapeutisk middel; 25 og radium-223, en radionuklidbehandling.26 andre behandlinger for mCRPC har vist seg å forbedre resultatene, men har ennå blitt godkjent av FDA og vil bli diskutert i en annen gjennomgang. På grunn AV den betydelige økningen i FLERE FDA-godkjente terapeutiske midler hos pasienter med CRPC, utfordres klinikere med en mengde behandlingsalternativer og mange potensielle sekvenser av disse midlene, noe som gjør klinisk beslutningstaking i mCRPC betydelig mer kompleks.
Tabell 1. Agenter som har blitt godkjent for behandling av metastatisk kastratresistent prostatakreft i USA
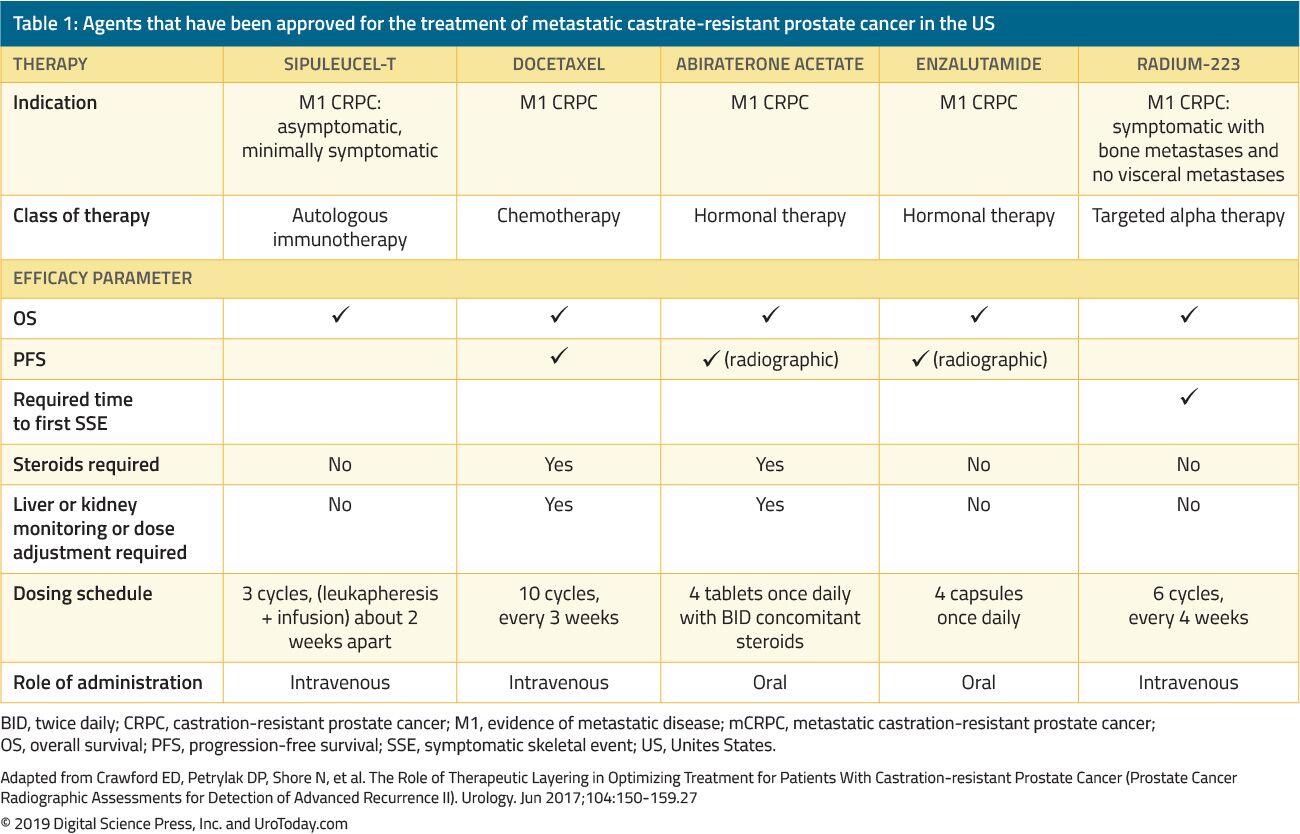
mCRPC er vanligvis en svekkende sykdom, og pasienter vil mest sannsynlig ha nytte av en ledelsesstrategi formalisert av et tverrfaglig team bestående av urologer, medisinske onkologer, stråling onkologer, sykepleiere, psykologer og sosialarbeidere.28 det er viktig å diskutere palliasjonsbehandlingsmuligheter når man vurderer ytterligere systemisk behandling, inkludert behandling av smerte, forstoppelse, anoreksi, kvalme, depresjon og tretthet.Et annet viktig punkt å vurdere når man etablerer riktig behandlingssekvens i dette sykdomsområdet, er den tilhørende kostnaden. Ved bruk av modeller som inkluderte flere behandlingslinjer før eller etter docetaxel, var den gjennomsnittlige kostnaden for mCRPC-behandling i en gjennomsnittlig periode på 28,1 måneder omtrent $48 000 per pasient.29 denne kostnaden er ganske høy på grunn av at pasientene kan få flere behandlingslinjer og pådra seg pågående medisinske tjenester i løpet av sykdommen.30
Bare to studier har vist en marginal overlevelsesfordel for pasienter som forblir på LHRH-analoger i stedet for å legge til andre – og tredjelinjerterapier.31, 32 Studier har vist AT CRPC ikke er resistent mot ADT, men heller overfølsom for det.10 behandlingsmediert seleksjonstrykk under ADT får AR til å forsterke, og sikrer at situasjonen ikke eskalerer, adt fortsetter å bli administrert i mCRPC-innstillingen. Behandlingsmediert seleksjonstrykk fortsetter også gjennom hele levetiden til svulsten, og intensiverer behovet for korrekt sekvensering av terapier. Men fordi prospektive data mangler, oppveier den lille potensielle fordelen ved fortsatt kastrering fortsatt minimal risiko for denne behandlingen. I tillegg har alle senere godkjente behandlinger blitt studert hos menn med pågående ADT, og legger til en annen grunn til at den skal fortsette. før hulene i de faktiske tilgjengelige behandlingstilbud, er det viktig å erkjenne at det fortsatt er uklart når man skal starte behandling i mCRPC pasienter som er helt asymptomatiske. Det er fortsatt ukjent om tidligere behandling er overlegen, eller om vi skal vente til pasienten blir symptomatisk og utvikler smerte. Før behandling påbegynnes, bør vi vurdere pasientens eksisterende komorbiditeter og forventede bivirkninger ved startbehandling. Pasienter med tidlig stadium mCRPC i COU-AA-302-studien som fikk abirateron, overlevde vanligvis nesten ett år lenger enn de som fikk placebo (median OS, henholdsvis 53,6 måneder vs. 41,8 måneder, HR, 0,61; 95% KI, 0,43 til 0,87; P = .006).33 dermed hadde mCRPC-pasienter i tidlig stadium nytte av tidligere oppstart av abirateron. I samme studie førte pasienter med asymptomatisk eller mildt symptomatisk mCRPC, med baseline PSA < 15,6 ng/mL abirateron også til en raskere frekvens og en større GRAD AV PSA-nedgang enn placebo.34 selv om de tilgjengelige dataene er begrensede, tyder det mest sannsynlig at det er mer fordelaktig å starte behandling tidligere enn senere.33, 34
Godkjente førstelinjebehandlingsmuligheter for metastatisk kastratresistent prostatakreft
Abirateron
Abirateron er et antiandrogen som hemmer enzymet 17α-hydroksylase/C17,20-lyase (CYP17). Cou-AA-302 fase III-studien evaluerte abirateron hos 1088 kjemo-naï, asymptomatiske eller mildt symptomatiske mCRPC-pasienter uten viscerale metastaser. I denne studien ble pasientene randomisert til abirateronacetat eller placebo, begge kombinert med prednison 35 (Figur 1). Pasientene ble stratifisert av enten Eastern Cooperative Oncology Group (ECOG) performance status 0 eller 1 og ved asymptomatisk eller mildt symptomatisk sykdom.35 OS og radiografisk progresjonsfri overlevelse (rpfs) var de primære endepunktene. Studien viste at etter en median oppfølging på 22,2 måneder var det en signifikant forbedring av rPFS i abirateronarmen (median 16,5 vs. 8,2 måneder, HR 0,52 ,p < 0,001). VED den endelige analysen etter en median oppfølging på 49,2 måneder var OS-endepunktet signifikant positivt (34,7 vs. 30,3 måneder, HR: 0,81, 95% KI: 0,70-0,93, p = 0,0033).36 det er viktig å huske at mCRPC spenner over et bredt prognostisk spektrum selv når det er kjemoterapi-naï.37 i en analyse av abirateronarmen I COU-AA – 302-studien hadde pasienter som ikke hadde smerter ved baseline, normal alkalisk fosfatase – og LDH-nivå og mindre enn 10 benmetastaser, median OS på 42,6 måneder.37 pasienter med flere risikofaktorer for progresjon hadde imidlertid signifikant kortere MEDIAN OS.37 ved vurdering av toksisitetsprofilen til abirateron syntes det å gi flere bivirkninger relatert til mineralokortikoid overskudd og leverfunksjonsforstyrrelser, men disse var for det meste gradert 1-2 bivirkninger. Til slutt ble abirateron også vist å være like effektiv hos den eldre populasjonen (> 75 år).38
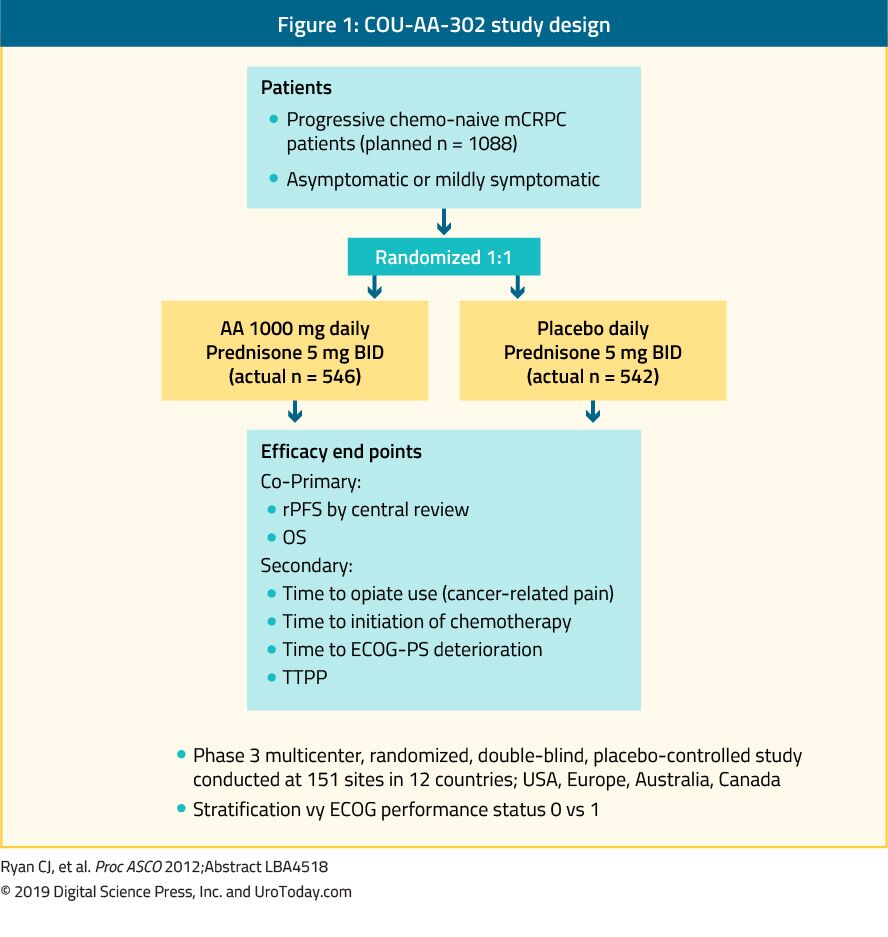
Figur 1. COU-AA – 302 studiedesign
Enzalutamid
Enzalutamid er et ikke-steroid antiandrogen. PREVAIL-studien, som er en randomisert fase III-studie, inkluderte 1717 kjemo-naï mCRPC-pasienter, og pasienter med viscerale metastaser var også kvalifisert.39 denne studien sammenlignet enzalutamid med placebo (Figur 2). PREVAIL-studien viste en signifikant forbedring hos pasienter behandlet med enzalutamid i begge ko-primære endepunkter, som inkluderte rPFS (HR: 0,186; KI: 0,15-0,23, p < 0,0001) og OS (HR: 0,706; KI: 0,6-0,84, p < 0,001). Utvidet oppfølging og endelig analyse bekreftet en fordel I OS og rPFS for enzalutamid.40 hos 78% av pasientene behandlet med enzalutamid ble DET rapportert EN PSA-reduksjon på mer enn 50%. De vanligste klinisk relevante bivirkningene var fatigue og hypertensjon. Enzalutamid var også like effektivt og godt tolerert hos eldre menn (> 75 år) 41 og hos de med eller uten viscerale metastaser.42 men for menn med levermetastaser syntes det ikke å være noen merkbar fordel.43 TERRENGSTUDIEN sammenlignet enzalutamid med bikalutamid, et eldre antiandrogen, i en randomisert dobbeltblind fase II-studie, som viste en signifikant forbedring I PFS (15.7 months vs. 5.8 months, HR: 0.44, p < 0.0001) in favor of enzalutamide.44
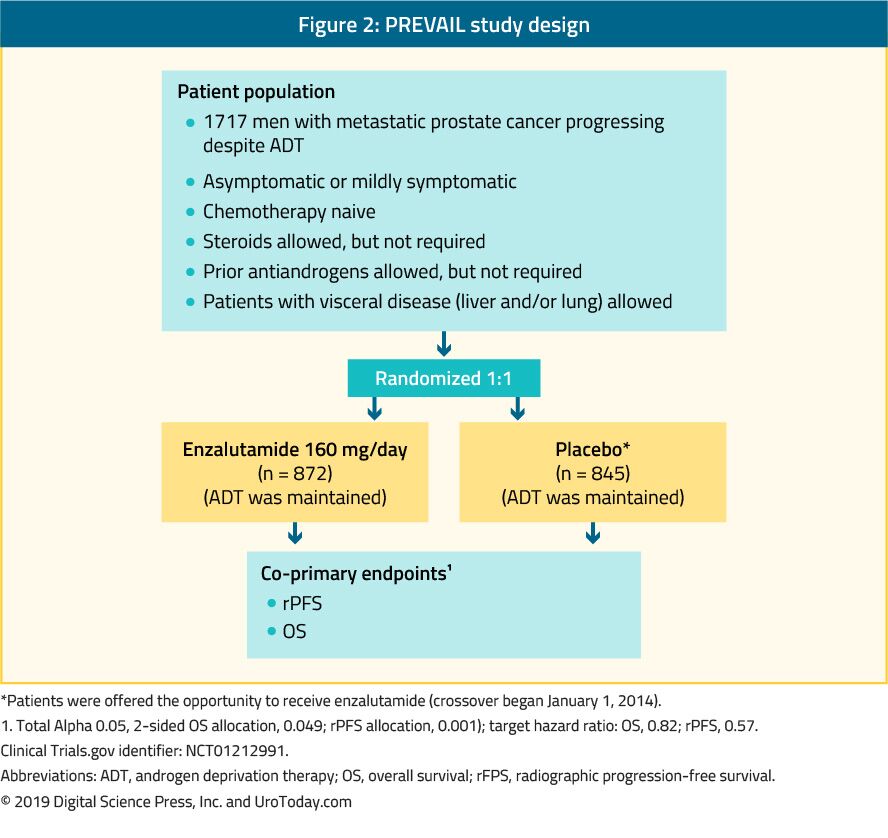
Figure 2. PREVAIL study design
Docetaxel
The landmark trial TAX 327 showed a significant improvement in median OS of 2-2.9 months in mCRPC patients treated with docetaxel-based chemotherapy when compared to patients who were treated with mitoxantrone plus prednisone therapy.22 The SWOG 9916 trial compared mitoxantrone to docetaxel and showed similar results23 (Figure 3). Standard førstelinje kjemoterapi er docetaxel 75 mg / m2 i tre ukentlige doser kombinert med prednison 5 mg to ganger daglig, opptil ti sykluser. Det er flere viktige prognostiske faktorer å vurdere ved administrering av docetaksel: viscerale metastaser, smerter, anemi (hb < 13 g/dL), beinskanningsprogresjon og tidligere behandling med estramustin. Disse prognostiske faktorene kan bidra til å stratifisere responsen på docetaksel. Ved hjelp av disse prognostiske faktorene kan sykdommen kategoriseres i lav, middels og høy risiko, med signifikant forskjellige tilsvarende median OS estimater på 25.Henholdsvis 7, 18,7 og 12,8 måneder.45 selv om alder i seg selv ikke er en kontraindikasjon for docetaksel-behandling, må pasientene være tilstrekkelig egnet til å tåle denne typen behandling, og komorbiditeter bør vurderes før behandlingsstart. Hos menn som antas å være ute av stand til å tolerere standarddosen og tidsplanen for docetaksel, kan dette reduseres fra 75 til 50 mg / m2 annenhver uke, med færre grad 3-4 bivirkninger og lengre tid til behandlingssvikt.46
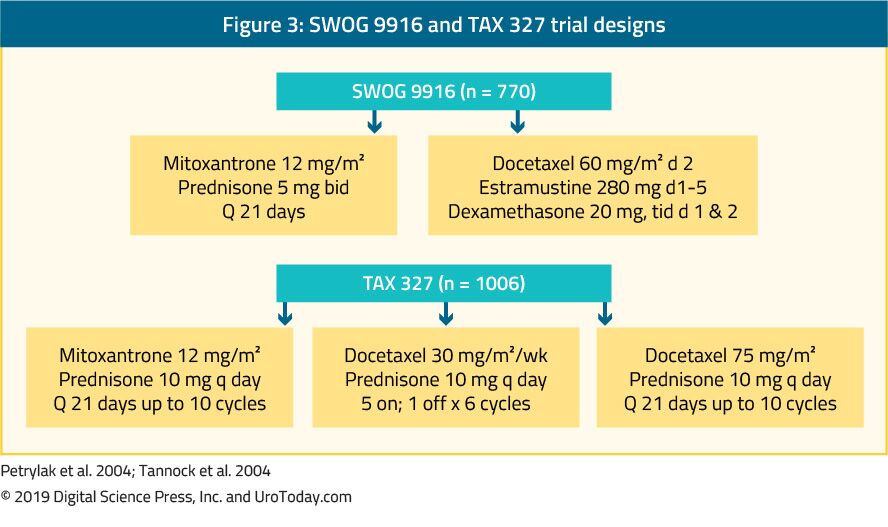
Figur 3. SWOG 9916-og TAX 327-forsøksdesign
Sipuleucel-t
Sipuleucel-T, en autolog aktiv cellulær immunterapi, ble vist i en fase III-studie (IMPACT-studie) for å gi en overlevelsesfordel hos 512 asymptomatiske eller minimalt symptomatiske mCRPC-pasienter sammenlignet med placebo24 (Figur 4). Etter en median oppfølging på 34 måneder var median overlevelse signifikant høyere i sipuleucel-T-gruppen (25,8 vs. 21,7 måneder, MED EN TIME på 0,78, p = 0,03).24 DET Er viktig at DET ikke ble observert PSA-nedgang under eller etter behandling, OG PFS var lik i begge armene. Den totale toleransen for sipuleucel-T var meget god, med hovedsakelig grad 1-2 bivirkninger. Foreløpig er denne behandlingen bare tilgjengelig I USA og er ikke lenger tilgjengelig i Europa.
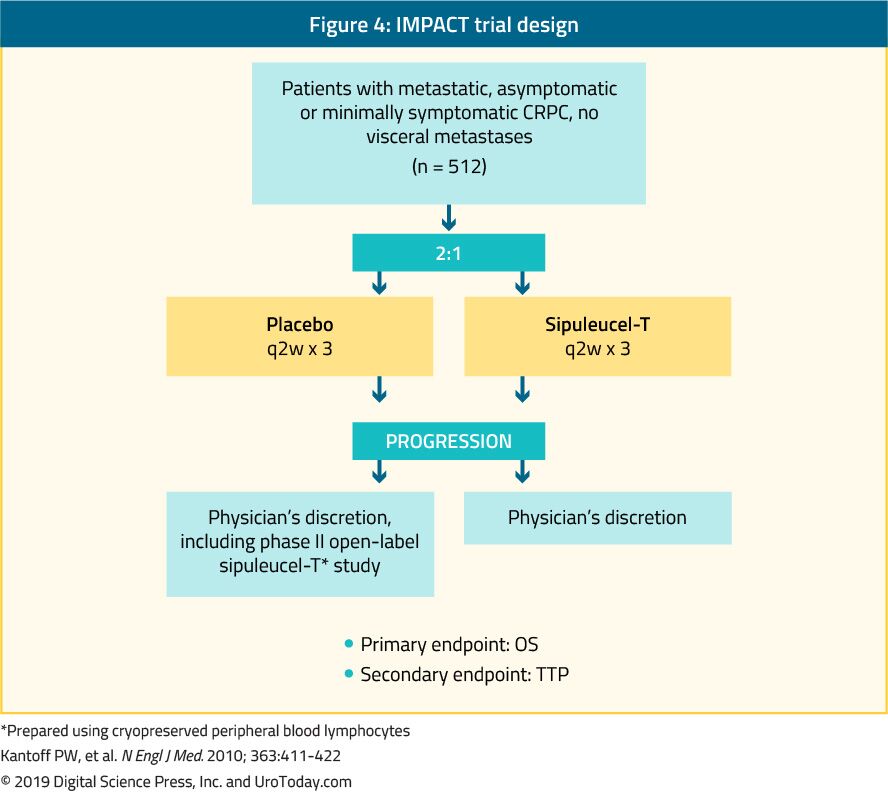
Figur 4. IMPACT trial design
Konklusjoner
I de siste 15 årene har det vært betydelig vitenskapelig fremgang og investering i legemiddelutvikling for pasienter med mCRPC. DETTE har resultert I FDA-godkjenning av flere linjer med systemiske terapier på grunn av smertelindring, minimering av sykdomsbivirkninger og OS-forlengelse. Hittil er den rapporterte effekten PÅ OS hos mCRPC-pasienter fra hver av disse individuelle midlene fortsatt beskjeden, noe som resulterer i et tillegg på bare noen få måneder. Det er nødvendig å forbedre vår forståelse av sykdomsbiologien til mCRPC, integrere en omfattende molekylær forståelse av kastrasjonsresistens, og analysere mekanismer for motstand mot nåværende terapier for å forbedre fremtidig behandlingsutvikling. Det er også viktig å investere og utvikle prediktive biomarkører for å hjelpe til med personalisering av terapi. Til slutt, på et mer praktisk notat, er det behov for mer data om de aktuelle andre og tredje linjerterapiene, og sekvensering og kombinasjon av tilgjengelige medisiner, diskutert mer detaljert i neste gjennomgangsartikkel («Utover førstelinjebehandling av metastatisk kastratresistent prostatakreft»).
Publisert Dato: November 19th, 2019
Leave a Reply