Biologi For Majors I
Læringsutbytte
- Identifiser komponentene i enkle kjemiske reaksjoner
alle elementene er mest stabile når deres ytre skall er fylt med elektroner i henhold til oktettregelen. Dette skyldes at det er energisk gunstig for atomer å være i den konfigurasjonen, og det gjør dem stabile. Men siden ikke alle elementer har nok elektroner til å fylle sine ytterste skall, atomer danne kjemiske bindinger med andre atomer og dermed få elektronene de trenger for å oppnå en stabil elektron konfigurasjon. Når to eller flere atomer kjemisk bindes med hverandre, er den resulterende kjemiske strukturen et molekyl. Det kjente vannmolekylet, H2O, består av to hydrogenatomer og ett oksygenatom; disse bindes sammen for å danne vann, som illustrert i Figur 1. Atomer kan danne molekyler ved å donere, akseptere eller dele elektroner for å fylle sine ytre skall.
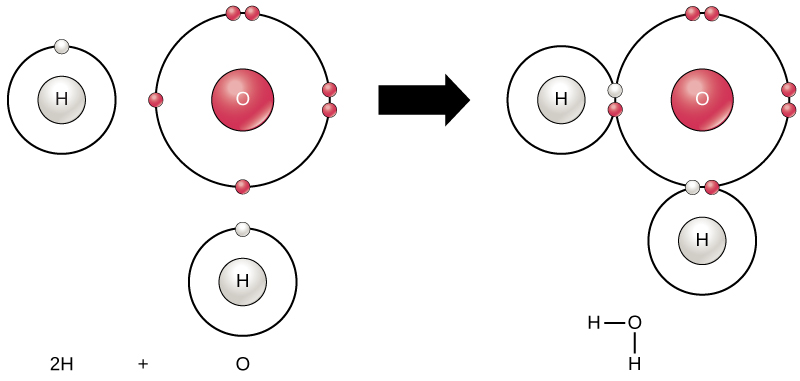
Figur 1. To eller flere atomer kan binde seg til hverandre for å danne et molekyl. Når to hydrogen og et oksygen deler elektroner via kovalente bindinger, dannes et vannmolekyl.Kjemiske reaksjoner oppstår når to eller flere atomer bindes sammen for å danne molekyler eller når bundet atomer brytes fra hverandre. Stoffene som brukes i begynnelsen av en kjemisk reaksjon kalles reaktantene (vanligvis funnet på venstre side av en kjemisk ligning), og stoffene som finnes på slutten av reaksjonen er kjent som produktene (vanligvis funnet på høyre side av en kjemisk ligning). En pil er vanligvis trukket mellom reaktantene og produkter for å indikere retningen av den kjemiske reaksjonen; denne retningen er ikke alltid en » enveiskjørt gate.»For opprettelsen av vannmolekylet vist ovenfor, ville den kjemiske ligningen være:
2H + O → H2O
et eksempel på en enkel kjemisk reaksjon er nedbryting av hydrogenperoksidmolekyler, som hver består av to hydrogenatomer bundet til to oksygenatomer (H2O2). Reaktanten hydrogenperoksid brytes ned i vann, som inneholder ett oksygenatom bundet til to hydrogenatomer (H2O) og oksygen, som består av To bundet oksygenatomer (O2). I ligningen nedenfor omfatter reaksjonen to hydrogenperoksidmolekyler og to vannmolekyler. Dette er et eksempel på en balansert kjemisk ligning, hvor antall atomer av hvert element er det samme på hver side av ligningen. Ifølge loven om bevaring av materie bør antall atomer før og etter en kjemisk reaksjon være lik, slik at ingen atomer under normale omstendigheter blir opprettet eller ødelagt.
2h2o2 (hydrogenperoksid) → 2H2O(vann) + o2 (oksygen)
selv om alle reaktantene og produktene av denne reaksjonen er molekyler (hvert atom forblir bundet til minst ett annet atom), er i denne reaksjonen bare hydrogenperoksid og vann representativ for en underklasse av molekyler kjent som forbindelser: de inneholder atomer av mer enn en type element. Molekylært oksygen, derimot, som vist i Figur 2, består av to dobbeltbundne oksygenatomer og er ikke klassifisert som en forbindelse, men som et element.
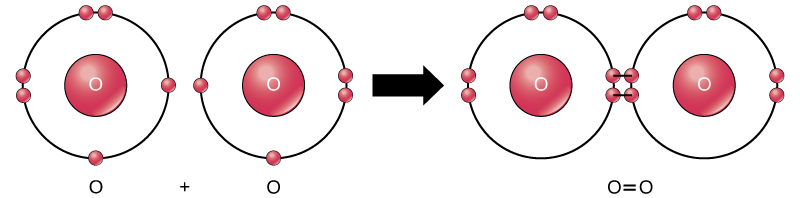
Figur 2. Oksygenatomer i et o2-molekyl er forbundet med en dobbeltbinding.
noen kjemiske reaksjoner, som den som er vist ovenfor, kan fortsette i en retning til reaktantene er brukt opp. Ligningene som beskriver disse reaksjonene inneholder en ensrettet pil og er irreversible. Reversible reaksjoner er de som kan gå i begge retninger. I reversible reaksjoner blir reaktanter omgjort til produkter, men når konsentrasjonen av produktet går utover en viss terskel( karakteristisk for den spesielle reaksjonen), vil noen av disse produktene bli omgjort tilbake til reaktanter; på dette tidspunktet reverseres betegnelsene for produkter og reaktanter. Dette frem og tilbake fortsetter til en viss relativ balanse mellom reaktanter og produkter oppstår – en tilstand som kalles likevekt. Disse situasjonene med reversible reaksjoner betegnes ofte av en kjemisk ligning med en dobbelthodet pil som peker mot både reaktantene og produktene.
for eksempel i humant blod binder overskytende hydrogenioner (H+) til bikarbonationer (HCO3–) som danner en likevektstilstand med karbonsyre (H2CO3). Hvis karbonsyre ble tilsatt til dette systemet, ville noe av det bli omdannet til bikarbonat og hydrogenioner.
HCO3 – + H + ↔ H2CO3
i biologiske reaksjoner oppnås imidlertid likevekt sjelden fordi konsentrasjonene av reaktantene eller produktene eller begge er i stadig endring, ofte med et produkt av en reaksjon som en reaktant for en annen. For å gå tilbake til eksemplet på overskytende hydrogenioner i blodet, vil dannelsen av karbonsyre være hovedretningen av reaksjonen. Karbonsyren kan imidlertid også forlate kroppen som karbondioksidgass (via utånding) i stedet for å bli omdannet tilbake til bikarbonation, og dermed drive reaksjonen til høyre ved kjemisk lov kjent som lov om massehandling. Disse reaksjonene er viktige for å opprettholde homeostasen i blodet vårt.
HCO3 – + H + ↔ H2CO3 ↔ CO2 + H2O
I Sammendrag: Kjemiske Reaksjoner og Molekyler
det ytre elektronskallet dikterer hvor lett og hvilken type kjemiske bindinger et bestemt atom vil danne. Dannelsen av forbindelser er ofte visuelt skissert i kjemiske ligninger som viser reaktantene som deltar i kjemiske reaksjoner for å danne produkter.
Prøv det
Bidra!
Forbedre denne sidenlære mer
Leave a Reply