3.4: Rutherford Eksperiment-Atommodellen Av Atom
Atomer og Gull
I 1911, Rutherford og kolleger Hans Geiger Og Ernest Marsden initiert en rekke banebrytende eksperimenter som ville fullstendig endre den aksepterte modellen av atomet. De bombarderte svært tynne ark med gullfolie med raske alfa partikler.

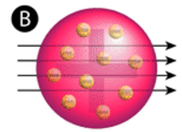

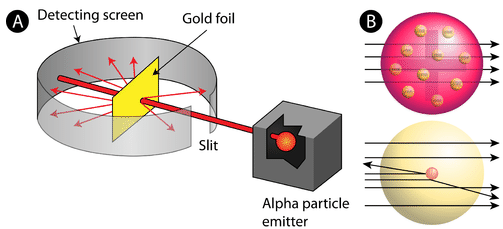
Figur \(\PageIndex{2}\) (A) Det eksperimentelle oppsettet For Rutherfords gullfolieeksperiment: et radioaktivt element som sendte ut alfa-partikler ble rettet mot et tynt ark med gullfolie som var omgitt av en skjerm som ville tillate deteksjon av de avbøyde partiklene. (B) ifølge plommepudding-modellen (øverst) skal alle alfa-partiklene ha passert gjennom gullfolien med liten eller ingen avbøyning. Rutherford fant at en liten prosentandel alfa partikler ble avbøyet i store vinkler, noe som kunne forklares av et atom med en veldig liten, tett, positivt ladet kjerne i midten (bunnen).ifølge den aksepterte atommodellen, hvor et atoms masse og ladning er jevnt fordelt gjennom atomet, forventet forskerne at alle alfa-partiklene ville passere gjennom gullfolien med bare en liten avbøyning eller ingen i det hele tatt. Overraskende, som vist I Figur \(\PageIndex{2}\) (mens de fleste alfa-partiklene faktisk var undeflected, sprang en svært liten prosentandel (ca. 1 i 8000 partikler) av gullfolien i svært store vinkler. Noen ble til og med omdirigert tilbake mot kilden. Ingen forkunnskaper hadde forberedt dem på denne oppdagelsen. I Et berømt sitat utbrøt Rutherford at det var «som om du hadde sparket et 15-tommers skall på et stykke vev, og det kom tilbake og slo deg.»
Rutherford trengte å komme opp med en helt ny modell av atomet for å forklare sine resultater. Fordi det store flertallet av alfa-partiklene hadde passert gjennom gullet, begrunnet han at det meste av atomet var tomt rom. I motsetning til dette må partiklene som ble sterkt avbøyet ha opplevd en enormt kraftig kraft i atomet. Han konkluderte med at all den positive ladningen og størstedelen av atomets masse må konsentreres i et svært lite rom i atomets indre, som han kalte kjernen. Kjernen er den lille, tette, sentrale kjernen av atomet og består av protoner og nøytroner.Rutherfords atommodell ble kjent som atommodellen. I atomatomet er protonene og nøytronene, som utgjør nesten hele massen av atomet, lokalisert i kjernen i sentrum av atomet. Elektronene er fordelt rundt kjernen og opptar det meste av atomets volum. Det er verdt å understreke hvor liten kjernen er i forhold til resten av atomet. Hvis vi kunne sprenge et atom for å være på størrelse med en stor profesjonell fotballstadion, ville kjernen være omtrent på størrelse med en marmor.Rutherfords modell viste seg å være et viktig skritt mot en full forståelse av atomet. Det adresserte imidlertid ikke helt elektronens natur og måten de okkuperte det store rommet rundt kjernen på. For dette og andre innsikter Ble Rutherford tildelt Nobelprisen I Kjemi i 1908. Dessverre Ville Rutherford ha foretrukket Å motta Nobelprisen i Fysikk fordi han betraktet fysikk overlegen kjemi. Etter hans mening, » All vitenskap er enten fysikk eller frimerker.”
Leave a Reply