1.14: Skille mellom pH og pKa
Relativ Surhet og Pka-Verdier
En anvendelse Av Henderson-Hasselbach-Ligningen er evnen til å bestemme den relative surheten av forbindelser ved å sammenligne deres pka-verdier. Jo sterkere en syre, jo større ionisering, jo lavere pKa, og jo lavere pH vil forbindelsen produsere i oppløsning. Noen utvalgte pka-verdier for forbindelser i studiet av organisk kjemi er vist nedenfor. Siden organiske reaksjoner kan utføres i ikke-vandige miljøer, kan pH overstige 14 og organiske forbindelser kan ha pka-verdier over 16. Det er en variant på den linjen Fra Trollmannen Fra Oz, » Vi lever ikke i vann lenger.»





det er en veldig god ide å forplikte seg til minne om de omtrentlige pka-områdene av forbindelsene ovenfor. Et ord av forsiktighet: når du bruker pka-tabellen, vær helt sikker på at du vurderer riktig konjugatsyre/basepar. Hvis du blir bedt om å si noe om basiciteten av ammoniakk (NH3) sammenlignet med ethoxide ion (CH3CH2O-), for eksempel er de relevante pka-verdiene å vurdere 9.2 (pka av ammoniumion) og 16 (pka av etanol). Fra disse tallene vet du at etoksid er den sterkere basen. Ikke gjør feilen ved å bruke pka-verdien på 38: dette er pka av ammoniakk som virker som en syre, og forteller deg hvor grunnleggende NH2-ion er (veldig grunnleggende!)
* et notat på pka av vann: PKa av vann er 14. Biokjemi og organisk kjemi tekster ofte liste verdien som 15.7. Disse tekstene har feilaktig tatt hensyn til molarverdien for konsentrasjonen av vann i likevektskonstanten. Den riktige avledningen av likevektskonstanten innebærer aktiviteten av vann, som har en verdi på 1.
Eksempel
mens dette kurset begynner med enkle funksjonelle grupper, vil vi til slutt jobbe med interessante forbindelser som inneholder flere funksjonelle grupper. Å anerkjenne hvilke hydrogen som kan ioniseres som sure protoner og hvilke hydrogen ikke kan, er en nyttig ferdighet. Legg merke til i dette eksemplet at vi må evaluere potensiell surhet på fire forskjellige steder på molekylet.
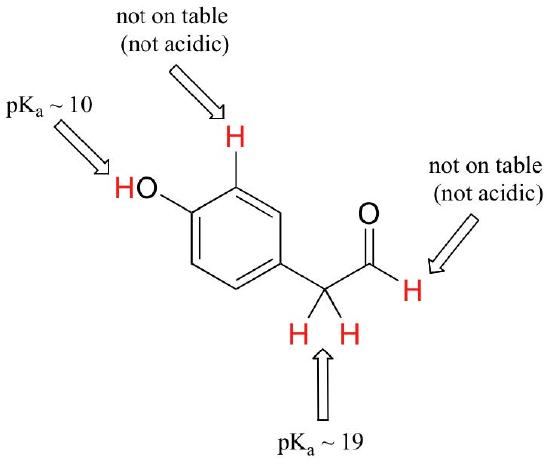
Aldehyd og aromatiske protoner er ikke i det hele tatt sure (pkavverdier er over 40 – ikke på bordet vårt). De to protonene på karbonet ved siden av karbonylen er litt sure, med pKa-verdier rundt 19-20 i henhold til tabellen. Den mest sure protonen er på fenolgruppen, så hvis forbindelsen skulle bli utsatt for en enkelt molar ekvivalent av sterk base, er dette protonen som ville bli donert.
Syr& Grunnleggende Miljøer – Alt Er Relativt I Reaktivitet
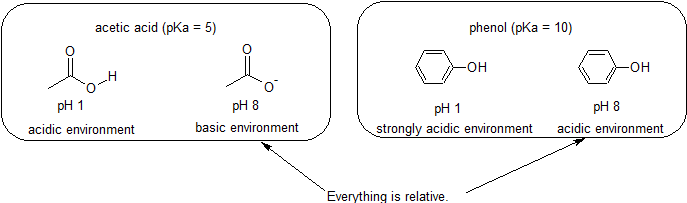
Fordi vårt mål er å forstå dynamisk kjemisk reaktivitet, trenger vi ikke å vite den spesifikke mengden av protonerte og uprotonerte former av en forbindelse. Vi trenger bare å vite hvilken form som er dominerende. Når ph i miljøet er mindre enn pka av forbindelsen, anses miljøet surt og forbindelsen vil eksistere hovedsakelig i sin protonerte form. Når ph i miljøet er større enn pka av forbindelsen, anses miljøet som grunnleggende og forbindelsen vil eksistere hovedsakelig i sin deprotonerte form.
for eksempel er pka av eddiksyre omtrent 5. Ved en pH på 1 anses miljøet surt og eddiksyre eksisterer hovedsakelig i sin protonerte form. Ved pH 8 anses miljøet som grunnleggende, og eddiksyre blir deprotonert for å danne acetat(CH3CO2 -). Omvendt er pka av fenol 10. Ved pH 8 anses miljøet surt for fenol, og det forblir primært protonert.
det er også viktig å huske at organisk kjemi ikke trenger å forekomme i vann, slik at pka-verdiene kan være så høye som 50.
Øvelse
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
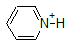 |
 |
 |
 |
 |
 |
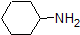 |
 |
 |
 |
 |
 |
 |
 |
 |
Leave a Reply