Vogt-小柳-原田(VKH)疾患
著者:Anthony P.Mai,BS;Charlene Tran,BS;Caroline W.Wilson,MD;Austin R.Fox,MD;H.Culver Boldt,MD
April1,2019
最初のプレゼンテーション
主訴
ぼやけた視力と頭痛
現在の病気の病歴
h3>
44歳のベトナム人女性は、両眼に進行性のぼやけた視力の10日間の病歴と重度の頭痛の三日間の病歴を救急部に提示しました。 検眼医による屈折では中心視力低下は改善しなかった。 重度の後頭部頭痛は運動とともに悪化し,全身倦怠感,極度の疲労,軽度の光恐怖症,裂傷と関連していた。 アセトアミノフェンは部分的に痛みを軽減した。
彼女は最近ベトナムに旅行していたが、そこで病気の連絡先に遭遇することを拒否した。 彼女は顎の跛行、発熱、または体重の変化を否定した。 彼女は皮膚の発疹、聴覚の変化、耳鳴り、めまい、しびれ、またはうずきを否定した。 彼女は結核を患っていることを否定した。 彼女は以前の視力の問題、自己免疫状態、または癌の病歴はなかった。
過去の眼歴
- 美容眼瞼手術(両側眼瞼形成術)の歴史三年前
- 眼外傷や疾患の歴史はありません
過去の病歴
なし
薬
必要に応じてアセトアミノフェン
アレルギー
既知の薬物アレルギーはありません
家族歴
眼疾患または自己免疫疾患の既往がない
社会歴
彼女はプレゼンテーションの数年前にベトナムから移住しました。 彼女は結婚し、3人の子供を持っています。 彼女はネイルサロンで働いています。 彼女はタバコ製品、アルコール、または違法な物質を消費しません。 彼女は半年から十二ヶ月ごとにベトナムに旅行します。
システムのレビュー
現在の病気の歴史の中で詳述されているものを除いて陰性
眼検査
視力矯正(Snellen)
- 右眼(OD):20/300(ピンホールで改善なし)
- 左眼(OS):20/300(ピンホールで改善なし)
- 左眼(OS):20/60-2+2 (ピンホールでは改善されない)
眼の運動性/アライメント
両眼の完全な外眼運動(OU)
眼内圧(IOP): (Tonopen)
- OD:12mmHg
- OS:14mmHg
瞳孔
- OD:暗闇で4mm、光で3mm、相対求心性瞳孔欠損(RAPD)なし
- OS:暗闇で4mm、光で3mm、RAPDなし
対立視野:(指を数える)h3>
- od:中央暗点
- os:総下側部欠損
外部
両側に正常
スリットランプ検査
- 蓋/まつげ:正常ou
- 結膜/強膜:クリアで静かなou
- 角膜: 1+点状上皮びらん、角質沈殿物なしOu
- 前房:微量細胞とフレアと深いOU
- 虹彩:正常アーキテクチャOU
- レンズ:クリアOU
拡張眼底検査(DFE)
- 硝子体:os:グレード2-3ディスク浮腫、充血
- od:3+嚢胞様黄斑浮腫(cme)と網膜下液(srf)ディスクから側頭黄斑に拡張します。 脂質や滲出液はありません。 ボギー-出現脈絡膜。OS:2+cmeとSRFは、中心窩を介してディスクから延びています。 1-2+線状脂質は、中心窩に向かって円板から延びています。 ボギー-出現脈絡膜。
- od:一時的にシース
- OS:正常
- OD:嚢胞性網膜房10:30に赤道に前方OS:浅いSRF4:赤道に前方:00
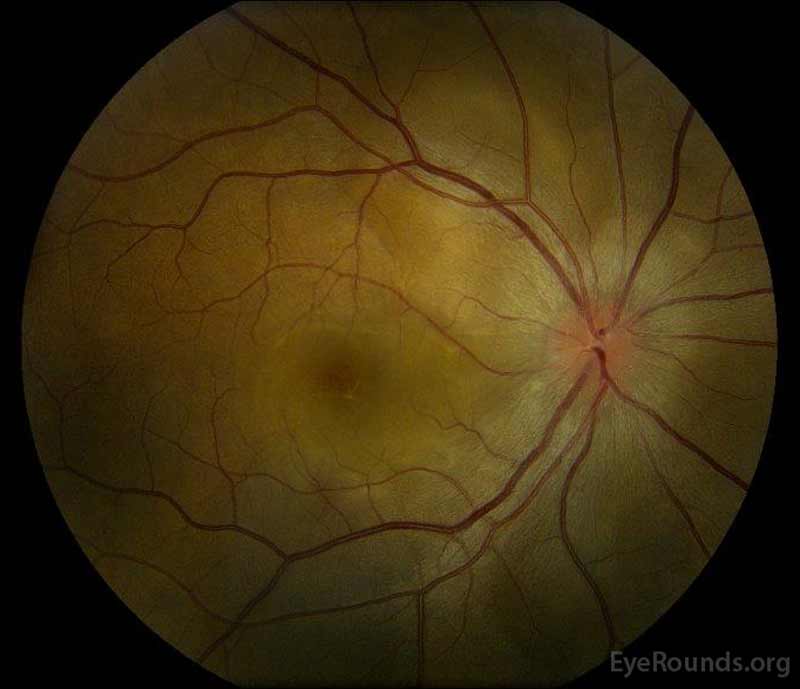 |
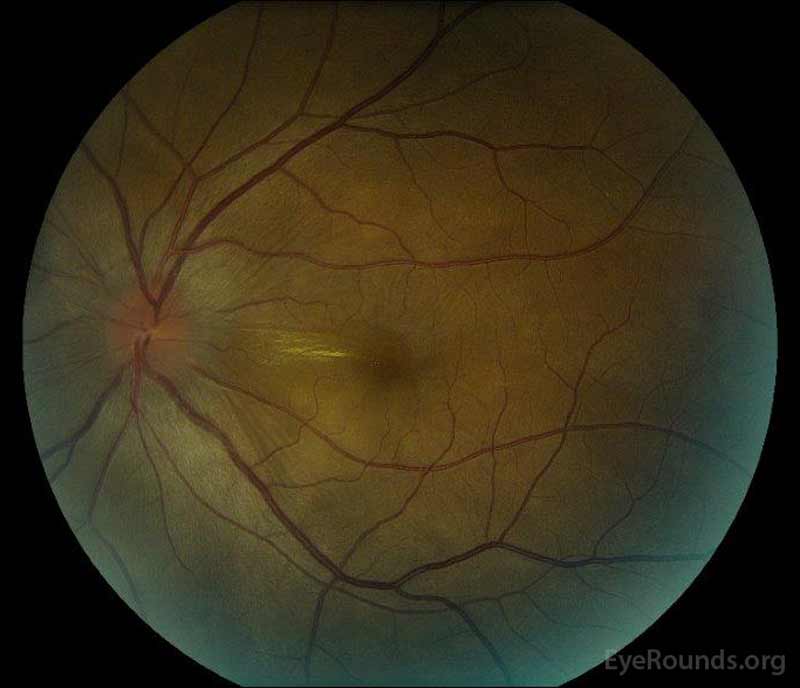 |
 |
図1:プレゼンテーション時のカラー眼底写真:(左の画像)右眼には、椎間板浮腫と軽度の充血があり、椎間板から黄斑を通って また、上のアーケードに沿って、椎間板に焦点性漿液性網膜剥離がある。 (Right image) The left eye has disc edema and mild hyperemia, along with subretinal fluid extending from the disc to the macula and linear lipid deposits in the nasal macula.
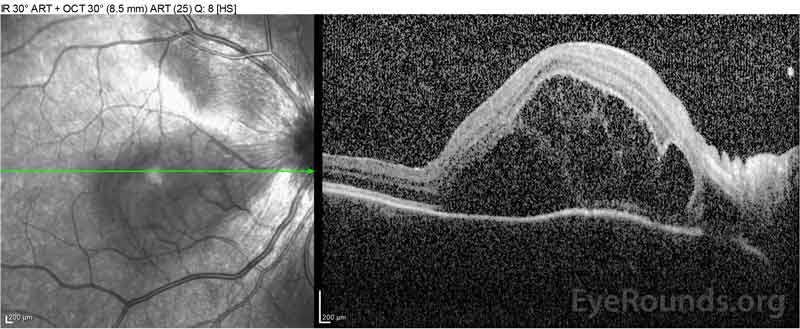 |
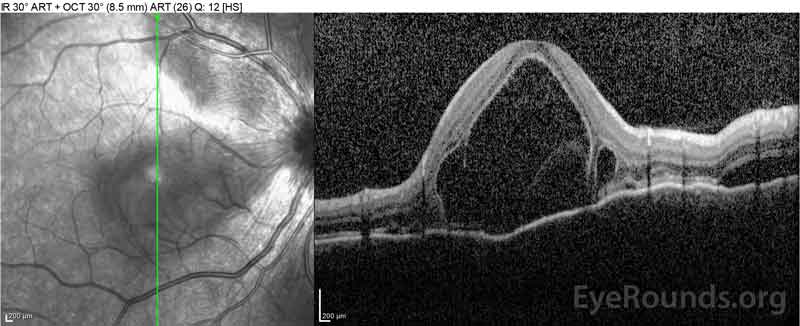 |
 |
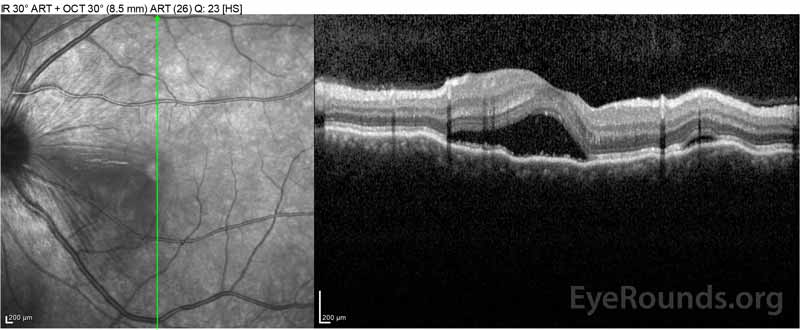 |
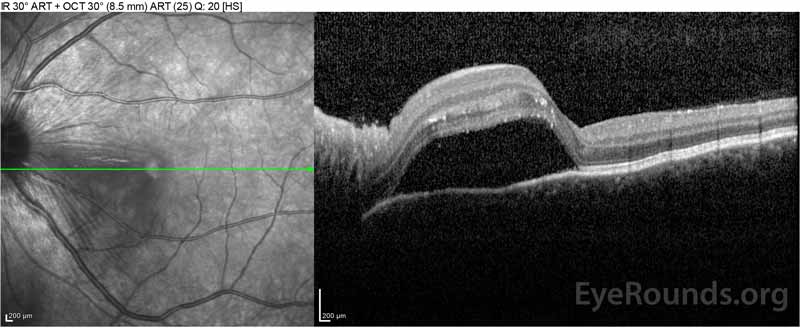
Figure 2: 右眼(上パネル)の光コヒーレンス断層撮影(OCT)は、広範な上にある網膜内液、外側の網膜層の破壊、および肥厚した脈絡膜のうねりを伴う中心窩を含む漿液性網膜 左眼のOCT(底部パネル)は、中心窩まで延びる鼻黄斑における漿液性網膜剥離を示す。
 |
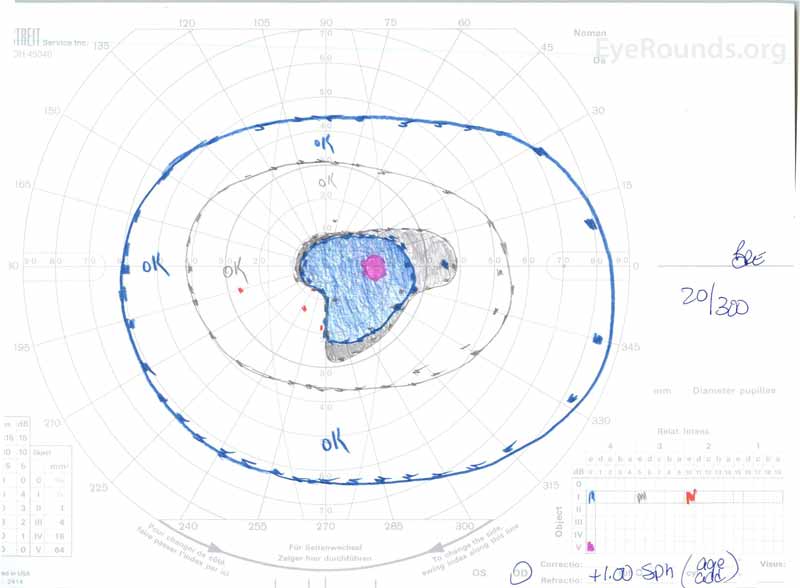 |
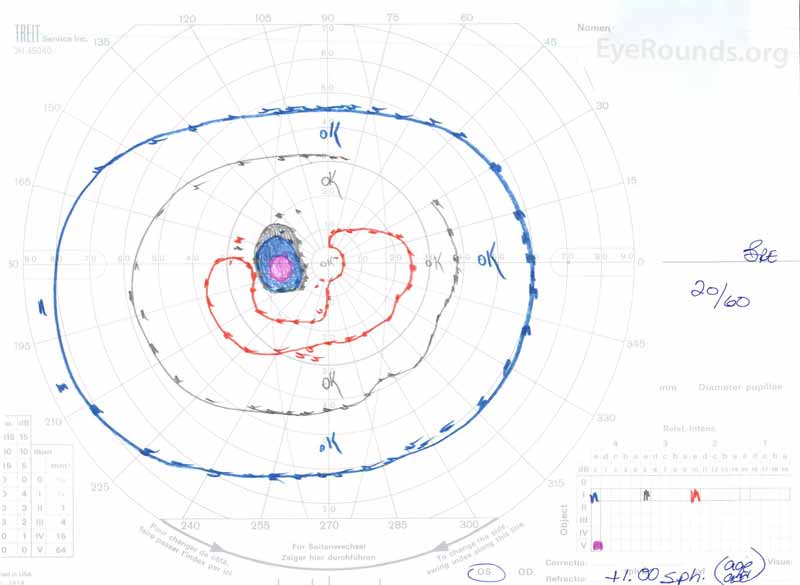
図3: ゴールドマン視覚野(GVF)、OU。 (左の画像)OSは、拡大した生理学的死角と軽度の中心暗点を示しています。 (右の画像)ODは、生理学的死角を取り入れ、下側に伸びる適度に密な中心暗点を示しています。
B-scan:強膜炎の徴候はなく、軽度の硝子体混濁/細胞は劣悪である
鑑別診断
- 急性後部多巣性プラコイド色素上皮症(APMPPE)
- 中枢性漿液性脈絡網膜症
- 視神経炎
- 汎ブドウ膜炎
- 自己免疫疾患(例えば、SLE、サルコイドーシス)
鑑別診断
- 急性後多巣性プラコイド色素上皮症(APMPPE)
- 中枢性漿液性脈絡網膜症
- 視神経炎
- 自己免疫疾患(例えば、SLE、サルコイドーシス)
- 自己免疫疾患(例えば、SLE、サルコイドーシス)
- 自己免疫疾患(例えば、Sle、サルコイドーシスli>
- 感染(E.li>
- 悪性腫瘍(眼リンパ腫など)
- 後強膜炎
- 交感神経性眼炎
- ブドウ膜滲出症候群
- Vogt-Koyanagi-Harada症候群
ワークアップ
完全血球数
完全血球数
完全血球数
完全血球数
完全血球数
完全血球数
完全血球数
完全血球数
完全血球数
白血球数:4.9k/mm3(ref:3.7-10.5)赤血球数:3.99m/mm3(ref:4.0-5.2)ヘモグロビン11.6g/dL(Ref:11.9-15.5)ヘマトクリット35%(REF:11.9-15.5)ヘマトクリット35%(REF:11.9-15.5)ヘマトクリット35%(REF:11.9-15.5)ヘマトクリット35%(REF:11.9-15.5)ヘマトクリット35%(REF:11.9-15.5)ヘマトクリット35%(REF:11.9-15.5)ヘマトクリット35%(REF:11.9-15.5)ヘマトクリット35%(REF:: 35-47)Basic metabolic panel
Sodium 138 mEq/L (Ref: 135-145)
Potassium 4.3 mEq/L (Ref: 3.5-5.0)
Chloride 107 mEq/L (Ref: 95-107)
CO2 20 mEq/L (Ref: 22-29)
Blood urea nitrogen 16 mEq/dL (Ref: 10-20)
Creatinine 0.7 mg/dL (Ref: 0.5-1.0)C-reactive Protein (CRP): <0.5 mg/dL (Ref: <=0.5)
Erythrocyte sedimentation rate (ESR): 12 mm/Hr (Ref: 0-20)
Angiotensin–converting enzyme (ACE): 13 U/L (Ref: 8-52)
QuantiFERON-TB Gold:negative
Iron,blood54microgram/dL(Ref:37-145)
Total iron binding capacity379microgram/dL(Ref:250-425)臨床コース
患者は、最初に新たに発症した重度の頭痛および視力喪失の苦情を与えられた救急部 脳コンピュータ断層撮影(C t)と磁気共鳴画像(MRI)スキャンは目立たなかった。 ESRおよびCRPは正常レベル内であった。 眼科クリニックでは翌日に彼女を評価し、両側の漿液性網膜剥離と汎ぶどう膜炎を発見した。 ACEおよびQuantiferon−TB Gold labsは両方とも陰性であった。 臨床所見とアジア系からVogt-小柳-原田病と診断した。 彼女は毎日80mgのプレドニゾン、頭痛のために必要に応じてアセトアミノフェン、ビタミンDとカルシウム補給で治療されました。 頭痛は急速に解消し,視力は着実に改善した。 彼女のプレドニゾンの投与量は、症状の継続的な解決と視力の改善を伴って、三週間にわたって40mgまで先細りになった。 プレドニゾンテーパー中に頭痛や視力の悪化の再発はなかった。 彼女の最も最近の任命で、彼女は徴候のリターンなしで5mgに一日置きに先細りにしました。 そのフォローアップ訪問での彼女の視力は20/15-2ODと20/20+2OSであり、黄斑OCTは両眼に椎間板浮腫と漿液性網膜剥離の完全な解像度を示した(図4)。 /p>
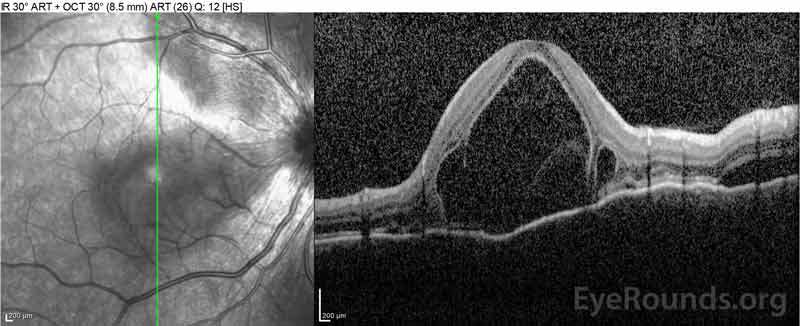
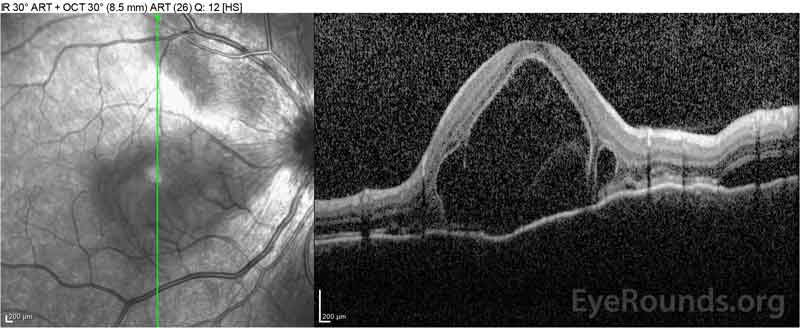
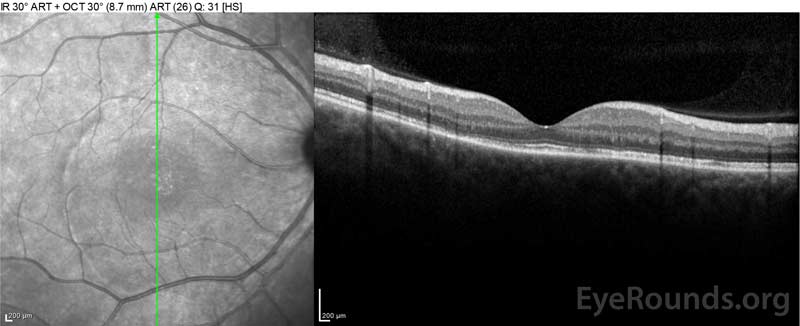
図4: 高用量経口プレドニゾンテーパーにしながら、ベースライン(上)と一週間(中央)と五週間(下)で解像度のコースで網膜下液を示す光コヒーレンス断層撮影。 処置の脈絡膜のうねりから滑らかになることに注意して下さい。
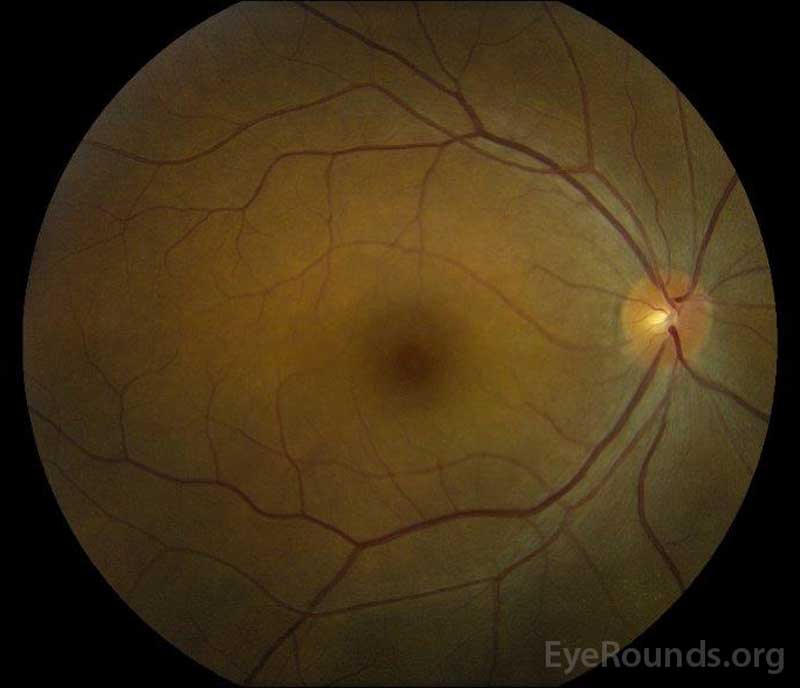
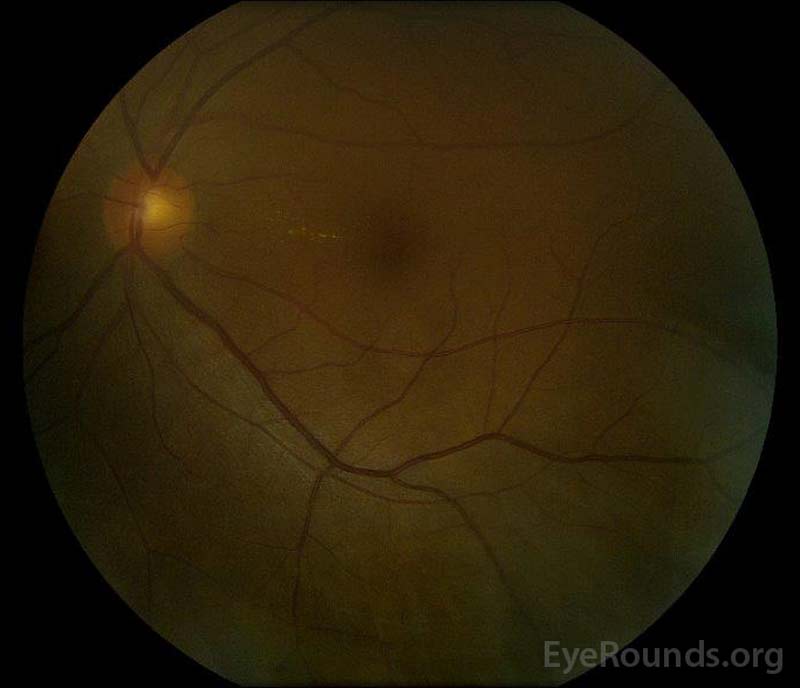
図5: 回復期における右眼(A)と左眼(b)のカラー眼底写真は,網膜下液と椎間板浮腫の改善を示している。
診断
不完全なVogt-Koyanagi-Harada病
ディスカッション
Vogt-Koyanagi-Harada(VKH)病は、ポリオや白斑などの外眼の外皮変化に伴う両側の非壊死性肉芽腫性汎ぶどう膜炎、ブドウ膜、内耳、毛、髄膜に影響を及ぼす炎症を特徴とする全身性自己免疫状態である。 原田病は、VKHの全身徴候または症状を伴わない単離されたブドウ膜炎である。
病因
VKH病の病因は、現在の研究努力にもかかわらず、依然としてほとんど知られていない。 これは、基礎となる遺伝的素因と可能な微生物トリガーと、メラノサイト自己抗原に対するT細胞媒介性過敏症を含む後天性自己免疫疾患であると考 チロシナーゼおよびチロシナーゼ関連ペプチドは、vkhにおける自己免疫プロセスの標的として示唆されているメラノサイト抗原である。 しかし、ある研究によると、VKH疾患のリスクの増加は、チロシナーゼ遺伝子ファミリーと関連していなかった。
特定の民族および性別グループの有病率が増加しているため、VKHの病因に遺伝的素因があると考えられている。 ヒト白血球抗原(HLA)およびインターロイキン(IL)遺伝子を含む複数の遺伝子は、異なる民族集団におけるVKHと関連している。 HLAの受容器は免疫組織にペプチッドを示す人間の主要な組織適合性の複合体です。 HLA-DR1、HLA-DR4、HLA-DRB1*0405、およびHLA-Drw53は、VKH疾患の患者に見られるいくつかのハプロタイプである。 Hla-DRB1*0405は韓国および中東の患者でより頻繁であるが、Hla-DR4は、日本人およびヒスパニック系の人々でより一般的です。 Hla-DR4およびHLA-DRB1*0405対立遺伝子の両方がベトナムの患者に見出される。 HLA-DRB1受容体は、様々な容量のメラノサイト抗原に結合する。 これらの関連にもかかわらず、遺伝子検査は現時点では推奨されていません。
発熱、頭痛、髄膜炎および耳鳴りを含むVKHに伴う通常の前駆症状を考えると、遺伝的素因のある患者における分子模倣のメカニズムを介してVKH発 サイトメガロウイルスエンベロープ糖タンパク質Hはチロシナーゼペプチドと有意なアミノ酸相同性を有し、CMV感染は分子模倣(すなわち、HLAクラスII受容体によ Ebstein-barウイルス(EBV)も関与している。 しかし、VKHのウイルス病因に関する決定的な証拠はなく、何がVKH自己免疫応答を引き起こすのかは不明のままである。 vkhには、前駆症状、急性ぶどう膜炎、回復期、慢性再発性の4つの古典的な段階があります。
病態生理
vkhには、さまざまな提示があります。 病理組織学的変化は、典型的には急性期に始まる。
急性ブドウ膜炎期は、肉芽腫性炎症に続発する両側ブドウ膜肥厚を特徴とする。 肉芽腫は、リンパ球、マクロファージ、および顆粒で満たされた類上皮細胞および巨細胞からなる。 類上皮細胞は以前は変化したメラノサイトであると考えられていたが,フォローアップ免疫組織化学的研究により,代わりに組織マクロファージに由来することが示唆された。 Dalen-Fuchs結節と呼ばれる類上皮組織球で満たされた肉芽腫は、網膜色素上皮(RPE)とBruch膜の間にしばしば見られる。 ブドウ膜肉芽腫性炎症は、脈絡膜の肥厚およびタンパク性液体で満たされた滲出性網膜剥離をもたらす。 さらに、pleocytosis(i.e.,増加した細胞数)前房および硝子体に存在していてもよいです.
回復期は、眼周囲の皮膚および毛髪を含む脈絡膜および外眼領域の脱色素によって同定される。 淡い視神経に対する脱色素性脈絡膜セットは、VKHのこの段階の古典的な特徴である”日没の輝き”眼底の印象を与える。 さらに、Dalen-Fuchsの小節は回復期のRPEの下でより顕著になります。
慢性再発期は、脈絡膜の厚さの減少、漿液性網膜剥離の解消、慢性軽度の硝子体炎、および再発性肉芽腫性前セグメント炎症を特徴とする。 脈絡膜血管新生(CNV)および網膜下線維症は、この段階で発症する可能性があり、重度の疾患進行の指標である。 白内障および続発性緑内障は、この段階における長年または再発性の炎症の他の合併症である。
疫学
VKHは、特にアジア人、南アメリカ人、中東人、およびネイティブアメリカン、暗い皮膚色素を持つレースで流行しています。 VKH疾患は、これらの集団におけるブドウ膜炎の10%を占めています。 ブドウ膜炎の症例のわずか1-4%は、米国(におけるVKH疾患に続発すると考えられている7)。 米国では、VKHのほとんどのケースは、アジア、ヒスパニック、および/またはネイティブアメリカンのまともな個人に影響を与えることが判明しています。 興味深いことに、VKH病はめったに彼らの暗い色素沈着にもかかわらず、アフリカ人に影響を与えません。 VKHの病気の発生率は近隣諸国の人種的なサブグループの間で非常に変わります。 例えば、韓国のVKHの発生率はわずか2%であり、日本や中国に見られるものよりもはるかに低い。
VKHは20-50歳の典型的な発症を有するが、研究では、VKH症例の3.1-13.4%が小児患者であり、症例の10%が65歳以上であることが示唆されている。 古典的には、VKHは女性の性別に対する好みを持っていると考えられており、ほとんどの研究はVKHが女性に不釣り合いに影響を与えることを示していますが、いくつかの研究では男性の素因または性別の素因がないことが示されています。
徴候/症状
前述のように、VKH疾患の四つの段階は、前駆症状、ブドウ膜炎、回復期、および慢性再発性である。 各段階は明瞭な臨床特徴を表わします。 Prodromal:この初期段階は、頭痛、めまい、発熱、疲労、および/または悪心などの主に憲法上の症状を伴うインフルエンザ様疾患として存在する可能性がある。
- Prodromal:この初期段階は、頭痛、めまい、発熱、疲労、および/または悪心などの主に憲法上の症状を有する。 髄膜炎、脳神経麻痺、視神経炎の神経学的症状、ならびに耳鳴り、dysacusis、およびめまいの聴覚症状が報告されている。 光恐怖症、ぼやけた視力、飛蚊症、および/または目の痛みは、通常、前駆症状の48時間以内に始まります。 Prodromal段階は数日から週に普通持続します。
- 急性ブドウ膜炎:この段階には、ぼやけた視力、光恐怖症、結膜注射、眼の痛みが含まれます。 軽度の前ぶどう膜炎があり、最初は肉芽腫性ではないように見えることがあります。 一方的な手始めは1-2週以内の両側のある介入に普通転移します。 マトン脂肪角質沈殿物を伴う肉芽腫性前ぶどう膜炎が発症する可能性がある。 後部検査所見には、視神経浮腫および充血、脈絡膜炎の多巣領域、後眼底に局在する漿液性網膜剥離の複数の領域、脈絡膜肥厚、放射性脈絡網膜襞、および硝子 しょう液性網膜剥離は後眼底にクローバーリーフパターンを形成し,重症例では広範な水ほう性剥離に進行する可能性がある。 急性炎症性緑内障は、この疾患の段階と関連しており、鋭角閉鎖を模倣して、毛様体浮腫に続発する浅い前房を呈することができる。 急性ブドウ膜炎期の持続時間は、迅速な診断および管理に依存する。
- 慢性ぶどう膜炎または回復期:この段階は、通常、急性期の数週間後に発症し、白斑(顔、手、肩、または背中など)、麻痺、および脱毛症を特徴とする。 杉浦サインと呼ばれる角膜輪部付近の色素脱失は、発症から一ヶ月後に見ることができますが、このサインは日本人以外ではほとんど見られません。 脈絡膜脱色素は、通常、数ヶ月にわたって発生し、脈絡膜と古典的な”サンセットグロー眼底の明るい橙赤色になります。”サンセットグロー眼底は、慢性VKHの診断において最も重要かつ予測的であると考えられている。 明確に定義された、円形の、nummular脈絡網膜瘢痕は、中央周辺に形成することができます。 慢性ブドウ膜炎の相は、典型的には数ヶ月続く。
- 慢性-再発性: この段階は、羊肉脂肪角質沈殿物、虹彩結節、虹彩脱色素、後synechiae、後嚢下白内障、二次緑内障、脈絡膜新生血管膜、および最終的には網膜下線維症およびnummular脈絡網膜萎縮を伴う肉芽腫性前ぶどう膜炎の再発エピソードによって特徴付けられる。 慢性期は、典型的には、最初の提示の後、少なくとも6ヶ月を開発しています。 急性期および回復期の間に存在する漿液性網膜剥離は、典型的には、積極的なコルチコステロイド治療で再発しない。
診断基準
Vkhの改訂診断基準(RDC)と呼ばれる最新の診断基準は、1999年にVKHに関する最初の国際ワークショップで定義されました。 これらは表1に概説されています。 RDCは、患者が提示する疾患相に基づいてVKHを三つの異なる診断カテゴリに分割する点で有用である:完全、不完全、および可能性がある。 この疾患の分類は、「完全な」疾患への進行を防ぐのに役立つ可能性のある「可能性のある」疾患における適切かつ早期の管理を可能にする。
眼の炎症の他の原因のためのワークアップは、感染性および自己炎症性の両方が不可欠である。 これらは、赤血球沈降速度(ESR)、c反応性タンパク質(CRP)、結核、梅毒、アンジオテンシン変換酵素(ACE)とサルコイドーシス、抗核抗体(ANA)、およびp-/c-ANCAのための胸部x線のための迅速な血漿レーギン(RPR)のためのquantiferon-Goldテストを含めることができます。 また,最近の眼外傷または眼内手術の病歴に留意しなければならず,SOとVKHとの間で共有される非常に類似した提示および病態生理を考えると,交感神経性眼症(S O)をより可能性の高い診断として示唆している可能性が高い。
曖昧な症例におけるVKHの診断を支持するために、リンパ球および単球性pleocytosisを探すために腰椎穿刺を行うことができるが、これは臨床的にはめったに 患者の八十パーセントは一週間以内に脳脊髄液(CSF)にpleocytosisを持ち、97%は三週間以内にpleocytosisを持っています。 免疫細胞のレベルの増加は、疾患発症後8週間まで持続する可能性があります。 T細胞表面マーカープロファイルはCSFと房水の間で類似していたが,血液とは異なっていた。 これは、VKH疾患におけるブドウ膜炎症を正確に反映するCSFの能力を示唆している。
表1に示すように、
Vogt-小柳-原田病の診断基準を改訂しました
*表1から(15).
“完全なVogt-小柳-原田病(基準1-5が存在しなければならない)
- ブドウ膜炎の最初の発症に先立って眼の外傷または手術を貫通した既往はない。
- 他の眼疾患の実体を示唆する臨床的または実験的証拠はない。
- 両側眼の関与(患者が検査されたときの疾患の段階に応じて、aまたはbを満たさなければならない)。
- 病気の初期症状。
- びまん性脈絡膜炎(前ぶどう膜炎、硝子体炎症反応、または視神経乳頭充血の有無にかかわらず)の証拠がなければならず、以下のいずれかとして現れる可能性がある。
- 病気の初期症状。
- 網膜下液の焦点領域、または
- 水疱性漿液性網膜剥離。
- 脈絡膜灌流の遅延の焦点領域、ピンポイント漏れの多焦点領域、過蛍光の大きなプラコイド領域、網膜下液内のプール、およびフルオレセイン血管造影による視神経染色(順次出現順に記載されている)、および
- びまん性脈絡膜肥厚、超音波検査による後部強膜炎の証拠はない。
- 病気の後期症状。
- 3aからの所見の以前の存在を示唆する歴史、および(2)および(3)の両方または(3)からの複数の徴候のいずれか:
- 眼脱色素(以下の症状のいずれかで十分である):(a)日没グロー眼底、または(b)杉浦サイン。 その他の眼の徴候:
- 網脈絡膜脱色素瘢痕、または
- 網膜色素上皮凝集および/または遊走、または
- 再発または慢性前ぶどう膜炎。
- 神経学的/聴覚的所見(検査時間によって解決した可能性がある)。
- 髄膜炎(倦怠感、発熱、頭痛、吐き気、腹痛、首と背中のこわばり、またはこれらの要因の組み合わせ;頭痛だけでは髄膜炎の定義を満たすのに十分ではない)、または
- 耳鳴り、または
- 脳脊髄液pleocytosis。
- 外皮所見(中枢神経系または眼疾患の発症に先行しない)。
- 脱毛症、または
- ポリオ症、または
- 白斑。
不完全なVogt-Koyanagi-Harada病(基準1-3および4または5のいずれかが存在しなければならない)
- ブドウ膜炎の最初の発症前に眼の外傷または手術を貫通した歴はなく、
- 他の眼疾患の実体を示唆する臨床的または実験室的証拠はなく、
- 両側眼の関与もない。
- 神経学的/聴覚的所見;上記の完全なVogt-小柳-原田病について定義された所見、または
- 外皮所見;上記の完全なVogt-小柳-原田病について定義された所見。
Vogt-Koyanagi-Harada病(孤立した眼疾患、基準1-3が存在しなければならない)
- ブドウ膜炎の初期発症前に眼の外傷または手術を貫通した既往はない。
- 他の眼疾患の実体を示唆する臨床的または実験的証拠はない。
- 上記の完全なVogt-Koyanagi-Harada病について定義されている両側眼の関与。 “
テスト/ラボワークアップ
VKHの最初のワークアップでは、次のテストを取得することを検討する必要があります。
- 光コヒーレンス断層撮影(OCT): 急性ぶどう膜炎期では,OCTTは有意な脈絡膜肥厚およびしょう液性網膜剥離を示す可能性が高い。 網膜下液の蓄積は、フィブリン膜および炎症生成物であると考えられる隔壁を有し、フルオレセイン血管造影でも見ることができる小葉構造を作 回復期では、OCTは副腎皮質ホルモンの処置の後で解決された発火の後で網膜の薄くなることの区域を検出できます。
- B-スキャン超音波検査: 急性期では,超音波検査でびまん性後脈絡膜肥厚,後強膜肥厚,網膜剥離,硝子体混濁を示すことがある。 毛様体滲出液は、超音波生体顕微鏡検査で観察することができる。 このテストは後部の強膜炎を除外するためにまた有用です。
- フルオレセイン血管造影(FA):古典的には、FAは後期にびまん性漏れと複数の焦点過蛍光領域に続いて、初期段階で多焦点脈絡膜低蛍光ドットを明ら 色素はRPEを通って漏れ,過蛍光ドットを取り囲む網膜下空間に蓄積する。 FAは,vkh疾患が外眼症状を示さない場合に診断的に有用であり得る。 萎縮性網脈絡膜瘢痕に起因する視神経乳頭過蛍光および窓欠陥が中周に見られることがある。 VKH病の慢性再発期のFAは,RPE損傷,脈絡膜新生血管,網膜下線維症による非特異的な窓欠損を示した。
- インドシアニングリーン(ICG)血管造影: 初期段階のICGは、脈絡膜血管障害と肉芽腫と脈絡膜血管系の遅延斑状充填に対応する低蛍光暗いドットを示す過蛍光間質血管を示しています。 後期はファジィ間質血管パターンとびまん性脈絡膜過蛍光を明らかにした。 椎間板過蛍光は重篤な疾患を示唆している。 ICGAは、非常に初期の段階で、または全身療法の後でさえも、無症状の脈絡膜炎症を検出することができる。
- 腰椎穿刺:脳脊髄液中のPleocytosisは、VKH患者の大部分に存在する。 Pleocytosisが解決するかもしれないので腰神経穿刺は病気のコースで早く行われるべきです
処置/管理/指針
Vkhの処置の目的は活動的な発火の早い診断
全身性コルチコステロイド治療は、特に急性ブドウ膜炎期のVKH疾患の好ましい治療法である。 コルチコステロイド投与の経路(経口対静脈内)は、急性VKHの治療における視力または視覚的に重要な合併症の発生に影響を与えないことが示されてい 重度の疾患では,メチルプレドニゾロンの静脈内投与とそれに続く経口高用量プレドニゾン治療が推奨される。 軽度-中等度の疾患では、高用量の経口プレドニゾンは1-2mg/kg/日で十分であり得る。 ステロイドの線量はおよそ6か月に再発を防ぐためにゆっくり先を細くされるべきです。 Rpeを介した色素漏出の消失を示す連続FA検査と並んで、積極的な早期治療は、さらなる疾患の進行、再発、および外眼症状の予防に役立つ可能性があ 項目ステロイドおよびcycloplegicsは前房および硝子体液の細胞を減らすことができます。
トリアムシノロンの硝子体内およびサブテノン注射は、急性または再発期の眼内炎症の短期的な制御に使用されている; これらの局所療法は,難治性疾患の場合およびステロイドのテーパー延長を与えられたステロイドの好ましくない全身副作用に耐えられない患者において考慮されるべきである。 硝子体内抗VEGF注射は、脈絡膜新生血管の制御および持続的な中心窩漿液性網膜剥離の場合に使用されることがある。
代謝拮抗剤、カルシニューリン阻害剤、生物製剤、TNF-α阻害剤、または細胞毒性剤を含むステロイド温存剤は、VKHを治療するために使用することができ、 VKH疾患の第一選択療法としての非ステロイド性免疫抑制剤の使用に関する継続的な議論が行われている。 しかし、最近の研究では、早期第一選択免疫調節治療(IMT)とプレドニゾン治療単独の間の転帰に差はないことが明らかになった。 さらに、免疫抑制療法および生物学的療法は高価であり、重篤な副作用を評価するためには、慎重な治療前評価および血液検査による頻繁なフォローアップ
慢性再発期では、頻繁な再発はコルチコステロイド療法に対する耐性を示唆し、ステロイド温存免疫調節治療の必要性を示唆する可能性がある。 ステロイド抵抗力がある再発またはステロイド不耐性のための好まれた代理店はcyclosporineです。 インフリキシマブ、リツキシマブ、アダリムマブ、およびインターフェロンα-2aは、VKH疾患における難治性ブドウ膜炎の治療にも使用されている生物学的
急性VKHにしばしば関連する前ぶどう膜炎を治療するには、前房炎症の程度に応じて、局所ステロイド(例えば、酢酸プレドニゾロン1%)および局所cyloplegia(例えば、シクロペントラート1%またはアトロピン1%)を処方すべきである。
眼の合併症は、一般的にVKH疾患に関連しています。 患者がVKHを提示することができる複数の段階および様々な提示を考えると、多くの場合、治療が遅れる可能性がある。 重度の形態のVKHおよび再発では、眼内炎症は制御が困難であり、構造的損傷をもたらす可能性がある。 患者の50%以上が白内障、二次緑内障、脈絡膜新生血管膜、網膜下線維症、またはこれらの組み合わせを含む関連合併症を発症する(図6)。
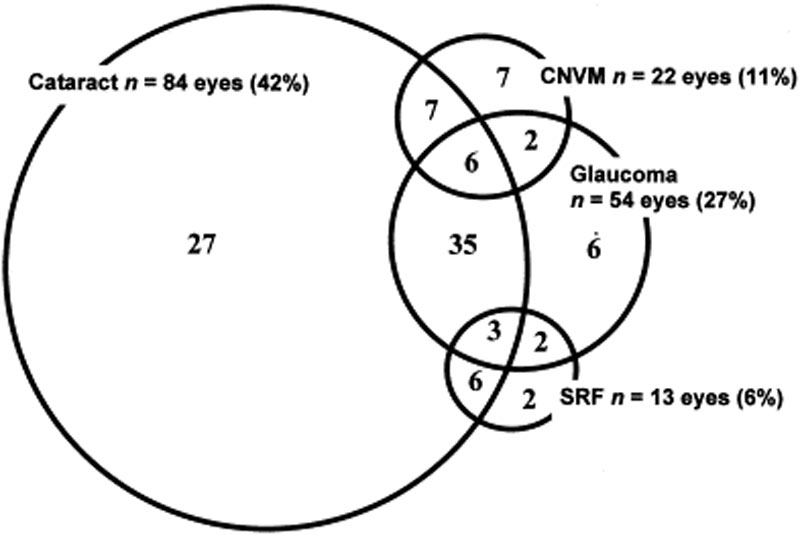
図6:VKH患者の合併症を示すベン図。 (Am J Ophthalmolからの許可を得て使用されます。 2001;131(5):599-606 )
疫学および病因
- 発症の典型的な年齢:20-50歳
- 女性>男性
- 色素沈着した皮膚、特にアジア、中東、ヒスパニック系、およびネイティブアメリカン
- 遺伝的リスク: HLA-DR1, HLA-DR4, HLA-DRB1*0405 alleles
- Possible autoimmune targeting of melanocyte antigens
- Possible viral molecular mimicry as inciting factor in autoinflammatory activation
SIGNS
- Prodromal: Pleocytosis in CSF, meningitis, vertigo
- Uveitic: Bilateral granulomatous anterior or multifocal uveitis, multifocal serous retinal detachments in both eyes, optic nerve head edema and hyperemia
- Convalescent: 脱毛症、ポリオ症、サンセットグロー眼底、杉浦サイン(辺縁脱色素)、Rpe以下のDalen-Fuchs結節
- 慢性再発: 前ぶどう膜炎、網膜下線維症、脈絡膜新生血管膜、多巣性脈絡網膜瘢痕、二次緑内障、白内障の再発
症状
- 頭痛、発熱、倦怠感、悪心、おli>
- 首のコリ
- 両眼を含む急速に悪化するぼやけた視力
- 目の赤み、痛み、飛蚊症、および/または光恐怖症
治療/管理
- 高用量 systemic corticosteroids (intravenous vs oral) for the acute phase with slow taper
- Immunosuppressive agents (cyclosporine) and biologics (infliximab) for recurrent disease refractory to corticosteroids
- Topical steroids (prednisolone acetate 1%) and cycloplegics (cyclopentolate 1% or atropine 1%) for anterior uveitis and ciliary spasm
- Intravitreal triamcinolone and/or intravitreal anti-VEGF injections for control of inflammation, choroidal neovascular membrane, and/or persistent subfoveal fluid
- Du L, Kijlstra A、Yang P.Vogt-Koyanagi-Harada病:病態生理、診断および治療への新規な洞察。 Prog Retin Eye Res2016;52:84-111. https://PubMed.gov/26875727。 土井:10.1016/j.preteyeres.2016.02.002
- Yamaki K,Gocho K,Hayakawa K,Kondo I,Sakuragi S.チロシナーゼファミリータンパク質は、Vogt-Koyanagi-Harada病に特異的な抗原である。 J Immunol2 0 0 0;1 6 5(1 2):7 3 2 3−7 3 2 9. https://PubMed.gov/11120868
- 堀江Y、竹本Y、宮崎A、難波K、加瀬S、吉田K、太田M、蓮見Y、猪子H、水木N、大野S。 日本人患者におけるチロシナーゼ遺伝子ファミリーとVogt-Koyanagi-Harada病。 Mol Vis2006;12:1601-1605。 https://PubMed.gov/17200659
- Ng JY、Luk FO、Lai TY、Pang CP。 Vogt-Koyanagi-Harada病における分子遺伝学の影響。 2014年4月20日、Jリーグ-Fc東京へ完全移籍。 https://PubMed.gov/25097674。 ドイ:10.1186/s12348-014-0020-1
- ボウリングB.ブドウ膜炎。 Kanski’S Clinical Ophthalmology New York,New York:Elsevier;2016;chapter11;p.395-465.
- Yeh PT YC,Yang CH,Lin CP. 非赤外性網膜剥離。 で: Schachat AP SS,Hinton DR,Wilkinson CP,Wiedemann P,,editor. ライアンの網膜 New York:Elsevier;2018;chapter99;p.1828-1849.
- 後藤H RK,Rao N.Vogt–小柳–原田病. で:Schachat AP SS,Hinton DR,Wilkinson CP,Wiedemann P,編集者. ライアンの網膜 New York,New York:Elsevier;2018;chapter78;p.1505-1515.
- リディントンL、ホールAJ、テイトB、ニコルソンI、ヴァーニー M.ベトナムの祖先の患者におけるVogt-小柳-原田症候群。 Aust N Z J Ophthalmol1996;24(2):147-149. https://PubMed.gov/9199747
- 杉田S、高瀬H、川口T、田口C、望月M。 Vogt-小柳-原田病患者のt細胞によるチロシナーゼペプチドとサイトメガロウイルス抗原との交差反応。 Int Ophthalmol2007;27(2-3):87-95. https://PubMed.gov/17253112。 ドイ:10.1007/s10792-006-9020-y
- Freund BK SD,Mieler WF,Yannuzzi LA. 炎症。 網膜アトラス New York,New York:Elsevier2017;chapter4;p.279-398.
- Rao N.Vogt-小柳-原田病。 J-YMaD、編集者。 眼科… New York,New York:Elsevier;2014;chapter7.17;p.761-763.
- ラオ-ナ、徐S、フォントRL。 交感神経性眼症。 類上皮細胞および巨細胞の免疫組織化学的研究。 眼科1985;92(12):1660-1662. https://PubMed.gov/4088616
- Nussenblatt RB. Vogt-小柳-原田症候群。 投稿者:ウィットカップアップ編集長。 ブドウ膜炎:基礎と臨床実践。 第4版ed:Elsevier;2010;chapter Chapter24.
- Read RW,Holland GN,Rao NA,Tabbara KF,Ohno S,Arellanes-Garcia L,Pivetti-Pezzi P,Tessler HH,Usui M.Vogt-Koyanagi-Harada病の診断基準の改訂:国際命名委員会の報告. Am J Ophthalmol2001;131(5):647-652. https://PubMed.gov/11336942
- チョンH、チェDG。 ブドウ膜炎の臨床分析。 1989;3(1):33-37. https://PubMed.gov/2795939。 土井:10.3341/kjo.1989.3.1.33
- Abu El-Asrar AM,Al-Kharashi AS,Aldibhi H,Al-Fraykh H,Kangave D.Vogt-Koyanagi-Harada病。 アイ(ロンド) 2008;22(9):1124-1131. https://PubMed.gov/17479116。 ドイ:10.1038/sj.アイ6702859
- Martin TD、Rathinam SR、Cunningham ET。 南インドにおけるVogt-Koyanagi-Harada病の小児における視力喪失の有病率、臨床的特徴、および原因。 網膜2010;30(7):1113-1121. https://PubMed.gov/20168275。 ドイ:10.1097/IAE.0b013e3181c96a87
- Forster DJ,Green RL,Rao NA. 7歳の子供におけるVogt-Koyanagi-Harada症候群の一方的な症状。 Am J Ophthalmol1991;111(3):380-382. https://PubMed.gov/2000916
- 山本Y、福島A、西野K、小浦Y、小松T、上野H.Vogt-小柳-原田病68歳から89歳の高齢患者に発症する。 Jpn J Ophthalmol2007;51(1):60-63. https://PubMed.gov/17295144。 ドイ:10.1007/s10384-006-0379-0
- 王Y、チャンCC。 Vogt-小柳-原田病と交感神経性眼症の性差。 2014年(平成26年)157803. https://PubMed.gov/24734166。 土井:10.1155/2014/157803
- 中尾K,Abematsu N,水島Y,坂本T.Vogt-小柳-原田病における視神経乳頭腫脹。 Invest Ophthalmol Vis Sci2012;53(4):1917-1922. https://PubMed.gov/22408010。 DOI:10.1167/iovs。11-8984
- Rao NA,Gupta A,Dustin L,Chee SP,Okada AA,Khairallah M,Bodaghi B,Lehoang P,Accorinti M,Mochizuki M,Prabriputaloong T,READ RW. Vogt-Koyanagi-Harada病における臨床的特徴の区別の頻度。 Ophthalmology 2010;117(3):591-599, 599.e591. https://PubMed.gov/20036008. DOI: 10.1016/j.ophtha.2009.08.030
- Veerappan M, Fleischman D, Ulrich JN, Stinnett SS, Jaffe GJ, Allingham RR. The Relationship of Vogt-Koyanagi-Harada Syndrome to Ocular Hypertension and Glaucoma. Ocul Immunol Inflamm 2017;25(6):748-752. https://PubMed.gov/27438521. DOI: 10.1080/09273948.2016.1189578
- Baltmr A, Lightman S, Tomkins-Netzer O. Vogt-Koyanagi-Harada syndrome – current perspectives. Clin Ophthalmol 2016;10:2345-2361. https://PubMed.gov/27932857. DOI: 10.2147/OPTH.S94866
- Kitaichi N,Matoba H,Ohno S.Vogt-Koyanagi-Harada病の診断における腰椎穿刺の積極的な役割:房水および脳脊髄液中のリンパ球サブセット。 Int Ophthalmol2007;27(2-3):97-103. https://PubMed.gov/17211585。 ドイ:10.1007/s10792-006-9016-7
- 大島Y,針野S,原Y,田野Y.Vogt-小柳-原田病におけるインドシアニングリーン血管造影所見。 Am J Ophthalmol1996;122(1):58-66. https://PubMed.gov/8659599
- RW、Yu F、Accorinti M、Bodaghi B、Chee SP、Fardeau C、Goto H、Holland GN、川島H、小島E、Lehoang P、Lemaitre C、岡田AA、Pivetti-Pezzi P、Secchi A、RF、Tabbara KF、Usui M、Rao NAを参照してください。 急性Vogt-小柳-原田病におけるコルチコステロイドの投与経路の転帰に対する影響の評価。 Am J Ophthalm2006;142(1):119-124. https://PubMed.gov/16815259。 土井:10.1016/j.ajo.2006.02.04
- Vogt-小柳-原田症候群。 臨床経過、治療、および長期的な視覚的転帰。 アーチボルド1991;109(5):682-687. https://PubMed.gov/2025171
- Urzua CA,Velasquez V,Sabat P,Berger O,Ramirez S,Goecke A,Vásquez DH,Gatica H,Guerrero J.以前の免疫調節治療は、Vogt-Koyanagi-Harada病患者のサブセットにおけるより良い視覚的転帰と関連している。 アクタ眼科2015;93(6):e475-480. https://PubMed.gov/25565265。 土井:10.1111/aos.12648
- RW、Rechodouni A、Butani N、Johnston R、LaBree LD、Smith RE、Rao NAを読んでください。 Vogt-Koyanagi-Harada病における合併症および予後因子。 Am J Ophthalmol2001;131(5):599-606. https://PubMed.gov/11336934
推奨引用フォーマット
Mai AP、Tran C、Wilson CW、Fox AR、Boldt HC。 Vogt-小柳-原田(VKH)病。 EyeRounds.org2019年4月1日。 から利用可能http://EyeRounds.org/cases/284-vogt-koyanagi-harada.htm
最終更新:04/1/2019 - 自己免疫疾患(例えば、SLE、サルコイドーシス)
Leave a Reply