6.4:ATP:Adenosine Triphosphate
開発するスキル
- 細胞エネルギー通貨としてのATPの役割を説明
- ATPの加水分解によってエネルギーがどのように放出されるかを説明
exergonic、エネルギー放出反応であっても、進行するためには少量の活性化エネルギーが必要である。 しかし、それらの生成物はそれらの反応物よりも多くの自由エネルギーを有するので、はるかに多くのエネルギー入力を必要とするエンダーゴン反応を 細胞内では、そのような反応に動力を与えるエネルギーはどこから来るのですか? 答えは、アデノシン三リン酸、またはATPと呼ばれるエネルギー供給分子にあります。 ATPは小さく、比較的単純な分子です(図\(\PageIndex{1}\))が、その結合のいくつかの中には、細胞の仕事を行うために利用できるエネルギーの急速なバーストの可能性が この分子は、お金が人々が必要とするものと交換する通貨であるのと同じように、細胞の一次エネルギー通貨と考えることができます。 ATPは、エネルギーを必要とする細胞反応の大部分に電力を供給するために使用されます。

エネルギー源としてのATPの使用に関しては、二つの顕著な疑問が残っています。 正確にどのくらいの自由エネルギーがATPの加水分解で放出され、その自由エネルギーはどのように細胞の仕事をするために使用されますか? ADPおよびPiへのATPの1モルの加水分解のための計算されたμ Gは-7.3kcal/モル(-30.5kJ/mol)です。 この計算は標準的な条件下で真であるため、セルラー条件下では異なる値が存在することが予想される。 実際、生きている細胞におけるATPの1モルの加水分解のためのμ Gは、標準条件での値のほぼ2倍である:14kcal/mol(-57kJ/mol)。
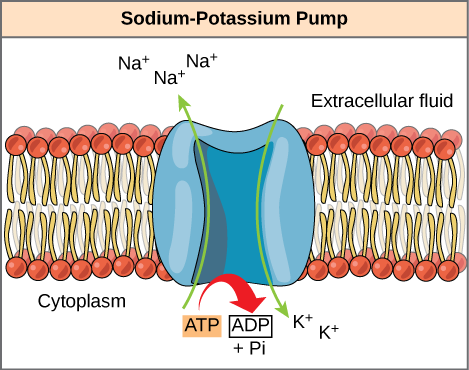
ATPは非常に不安定な分子です。 作業を迅速に行うために使用されない限り、ATPは自発的にADP+Piに解離し、このプロセス中に放出された自由エネルギーは熱として失われます。 上記の2番目の質問、つまり、ATP加水分解によって放出されたエネルギーが細胞内でどのように働くかは、エネルギー結合と呼ばれる戦略に依存する。 細胞はATP加水分解のexergonic反作用をendergonic反作用と結合し、進むようにそれらがする。 ATPを用いたエネルギー結合の一例には、細胞機能にとって非常に重要な膜貫通イオンポンプが含まれる。 このナトリウム-カリウムポンプ(Na+/K+ポンプ)は、ナトリウムを細胞から排出し、カリウムを細胞に送ります(図6.4.2)。 細胞プロセスが細胞から細胞およびカリウムに大量のナトリウムを持って来るので、細胞のATPの大きいパーセントはこのポンプに動力を与える使われ ポンプはナトリウムおよびカリウムの細胞集中を安定させるために絶えず働く。 ポンプが1サイクル(3つのNa+イオンを輸出し、2つのK+イオンを輸入する)を回すためには、ATPの1分子を加水分解する必要があります。 ATPが加水分解されるとき、ガンマの隣酸塩は単に浮かびませんが、実際にポンプ蛋白質に移ります。 分子に結合するリン酸基のこのプロセスは、リン酸化と呼ばれます。 ATP加水分解のほとんどの場合と同様に、ATPからのリン酸塩は別の分子に移される。 リン酸化状態では,Na+/K+ポンプはより多くの自由エネルギーを有し,配座変化を受けるように誘発される。 この変更により、Na+をセルの外側に放出することができます。 その後、細胞外のK+に結合し、別の立体配座の変化を介してリン酸塩をポンプから切り離す。 リン酸塩のこの放出は、K+が細胞の内部に放出されるように誘発する。 本質的に、ATPの加水分解から放出されるエネルギーは、ポンプに動力を与え、Na+およびK+イオンを輸送するのに必要なエネルギーと結合される。 ATPはリン酸化によってエネルギーカップリングのこの基本的な形態を使用して細胞仕事を行う。
多くの場合、栄養素の合成や分解などの細胞代謝反応の間に、反応シリーズの次のステップの基質になるためには、特定の分子の立体配座がわずかに変 一つの例は、糖グルコースの分子が解糖の過程で分解される細胞呼吸の非常に最初のステップの間にある。 このプロセスの最初のステップでは、atpはグルコースのリン酸化に必要であり、高エネルギーではあるが不安定な中間体を生成する。 このリン酸化の反作用はリン酸化されたブドウ糖の分子がリン酸化された砂糖のフルクトースに変えられるようにするconformational変更に動力を与えます。 フルクトースは解糖が前進するために必要な中間体である。 ここでは、ATP加水分解のエクセルゴン反応は、経路中のグルコースをリン酸化中間体に変換するエンドゴン反応と結合している。 再び、ATP内のリン酸結合を破壊することによって放出されるエネルギーは、不安定な中間体を作成し、重要な立体配座変化に電力を供給し、別の分子のリン酸化のために使用されました。

このサイトでは、ATP産生解糖プロセスのインタラクティブなアニメーションを参照してくださATPは生きている細胞のための主要なエネルギー供給分子です。
概要
ATPは生きている細胞のための主要なエネル ATPは、ヌクレオチド、5炭素糖、および3つのリン酸基で構成されています。 リン酸塩を接続する結合(ホスホアンヒドリド結合)は、高エネルギー含有量を有する。 ATPのadp+Piへの加水分解から放出されるエネルギーは、細胞の働きを行うために使用されます。 細胞はatpを使用して、ATP加水分解のexergonic反応をendergonic反応と結合させることによって作業を行う。 ATPはリン酸化として知られているプロセスによって別の分子に隣酸塩グループを寄付します。 リン酸化された分子は高エネルギー状態にあり、非リン酸化された形態よりも安定ではなく、リン酸塩の添加からのこの添加されたエネルギーは、分子がそのエンダーゴン反応を受けることを可能にする。1つのATP分子の加水分解は7.3kcal/molのエネルギーを放出する(∆G=-7.3kcal/molのエネルギー)。 それは2を取る場合。1kcal/molのエネルギー1つのNa+を膜を横切って移動させるには(√G=+2.1kcal/molのエネルギー)、1つのATP分子の加水分解によってどれくらいのナトリウムイオ
三つのナトリウムイオンは、一つのATP分子の加水分解によって移動することができます。 結合された反応のσ Gは負でなければならない。 膜を横切る3つのナトリウムイオンの移動には6.3kcalのエネルギー(2.1kcal×3Na+イオン=6.3kcal)が必要です。 ATPの加水分解は7.3kcalのエネルギーを提供し、この反応に電力を供給するのに十分以上のエネルギーを提供する。 しかし、4つのナトリウムイオンが膜を横切って移動するには、8が必要になります。エネルギーの4kcalは、複数のATPの分子提供できます。
レビューの質問
ATPの加水分解によって放出されるエネルギーは、主にαリン酸塩とβリン酸塩の間に保存されます
d
次の分子のどれが最も潜在的なエネルギーを持つ可能性が高いですか?
- スクロース
- ATP
- グルコース
- ADP
A
自由応答
ATP加水分解のEAは比較的低いか高いと思いますか? あなたの推論を説明しなさい。
加水分解の活性化エネルギーは非常に低い。 ATPの加水分解は大きいγ Gのexergonicプロセスであるが、ATPはまたすぐに利用されなかったらadp+Piに急速に破壊する非常に不安定な分子である。 これは非常に迅速に加水分解するので、非常に低いEAを示唆しています。
用語集
ATPアデノシン三リン酸、ATP分子内のリン酸塩を接続する細胞のエネルギー通貨ホスホアンヒドリド結合結合
貢献者と属性
-
Connie Rye(East Mississippi Community College)、Robert Wise(University of Wisconsin,Oshkosh)、Vladimir Jurukovski(Suffolk County Community College)、Jean DeSaix(ノースカロライナ大学チャペルヒル校)、チョン-チェ(ジョージア工科大学)、ヤエル-アビッサール(ロードアイランドカレッジ)などの寄稿者の間で。 OpenStaxによるオリジナルコンテンツ(CC BY4.0;http://cnx.org/contents/185cbf87-c72…[email protected]で無料でダウンロード)。
Leave a Reply