1.14:pHとpKaの区別
相対酸性度とpKa値
ヘンダーソン-ハッセルバッハ方程式の適用は、それらのpKa値を比較することによ より強い酸、より大きいイオン化、より低いpKa、およびより低いphは混合物解決で作り出します。 有機化学の研究における化合物のためのいくつかの選択されたpKa値は、怒鳴る示されています。 有機反応は非水性環境で行うことができるので、pHは1 4を超えることができ、有機化合物は1 6を超えるpKa値を有することができる。 それはオズの魔法使いからのそのラインの変化である、”私達は水にもう住んでいない。”


上記の化合物のおおよそのpKa範囲をメモリにコミットすることは非常に良い考えです。 注意の言葉: pKaテーブルを使用する場合は、正しい共役酸/塩基対を考慮していることを絶対に確認してください。 例えば、エトキシドイオン(CH3CH2O-)と比較してアンモニア(NH3)の塩基度について何かを言うように求められた場合、考慮すべき関連するpKa値は9.2(アンモニウムイオンのpKa)と16(エタノールのpka)である。 これらの数字から、あなたはエトキシドがより強い塩基であることを知っています。 38のpKaの価値の使用の間違いをしないで下さい:これは酸として機能するアンモナルのpKaで基本的なNH2イオンがいかにあるか告げます(非常に基本的!)
*水のpKaに関するメモ: 水のpKaは14です。 生化学と有機化学のテキストは、多くの場合、15.7として値をリストします。 これらのテキストは、水の濃度のモル値を平衡定数に誤って因数分解しています。 平衡定数の正しい導出は、1の値を有する水の活性を含む。
例
このコースは単一の官能基から始まりますが、最終的には複数の官能基を含む興味深い化合物で作業します。 どの水素が酸性プロトンとしてイオン化することができ、どの水素ができないかを認識することは有用なスキルである。 この例では、分子上の4つの異なる場所での潜在的な酸性度を評価する必要があることに注意してください。
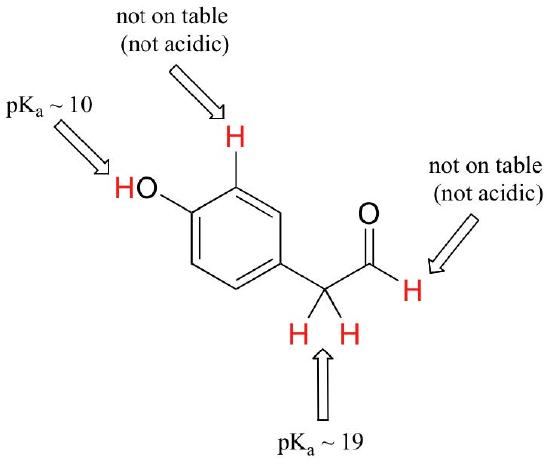
アルデヒドと芳香族プロトンは全く酸性ではありません(pKavaluesは40を超えています–私たちのテーブルにはありません)。 カルボニルの隣の炭素上の2つのプロトンはわずかに酸性であり、表によればpKa値は19-20前後である。 最も酸性のプロトンはフェノール基上にあるので、化合物が強塩基の単一モル当量に供される場合、これは寄付されるプロトンである。
酸性&基本的な環境-すべてが反応性に相対的です
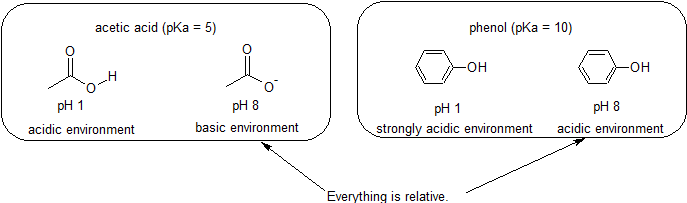
私たちの目標は、動的な化学反応性を理解しているので、我々は化合物のプロ 私たちは、単にフォームが優勢であるかを知る必要があります。 環境のpHが化合物のpKaよりも小さい場合、環境は酸性であると考えられ、化合物はそのプロトン化された形態で優勢に存在するであろう。 環境のpHが化合物のpKaよりも大きい場合、環境は塩基性であると考えられ、化合物は主にその脱プロトン化された形態で存在するであろう。例えば、酢酸のpKaは約5である。
例えば、酢酸のpKaは約5である。
PH1では、環境は酸性であると考えられ、酢酸はプロトン化された形で主に存在する。 PH8では、環境は塩基性であると考えられ、酢酸は脱プロトン化されて酢酸(CH3CO2-)を形成する。 逆に、フェノールのpKaは10である。 PH8では、環境はフェノールのために酸性であると考えられ、主にプロトン化されたままである。
練習
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
Leave a Reply