転移性去勢抵抗性前立腺がんの第一選択治療
2019年の前立腺がん(PCa)は、米国の男性のがんの新しい診断のほぼ1に5を占めています。1過去数年間で、前立腺がん(PCa)全体の発生率は年間約7%減少しました。1発生率の急激な低下は、一般に、2008年から2013年までの前立腺特異抗原(PSA)検査の減少に起因している。 PSAスクリーニングの使用の減少は、定期的なPSAスクリーニングに対する米国(米国)予防サービスタスクフォースの勧告によって引き起こ これは、特に75歳以上の男性におけるグレードD勧告であり、2008年に宣言され、その後、過診断および過治療の懸念が高まっているため、2011年にすべての男性に拡大された。2PSA検査の有病率は減少しなくなり、2013年から2015年まで安定したが、3進行性疾患の発生率に対するスクリーニング減少の影響は依然として不明である。 米国の人口の89%をカバーする大規模な癌レジストリの分析は、PCa発生率の全体的な減少は、実際には、年齢や人種全体で2010年から遠隔期の診断の増加をマス4
与えられた治療にかかわらず、局所PCaを有する患者の約20%-30%が転移性疾患に進行し、一般的にホルモン療法で治療される。5これは外科去勢(両側のあるorchiectomy)または男性ホルモンの剥奪療法(ADT)を使用して医学の去勢によって与えることができます。 両方の方法は、転移性ホルモン感受性PCa(mHSPC)を治療するためのケアの標準とみなされている血清テストステロンの去勢レベルを達成する。 しかし、mHSPCは転移性去勢抵抗性前立腺癌(mCRPC)に進行する運命にあります。6去勢抵抗性前立腺癌(CRPC)状態は、去勢テストステロンレベルに達しているにもかかわらず、疾患の進行として定義されます(血清テストステロン<50ng/dLまたは1。7nmol/L)であり、血清PSAレベルの継続的な上昇、既存の疾患の進行、および/または新しい転移の出現のいずれかとして提示することができる。7CRPCの生存期間の中央値は約三年8であり、生活の質の大幅な低下に関連している。9mHSPCからmCRPCへの移行の正確なメカニズムはまだ不明である。 但し、男性ホルモンの去勢剤のレベルにもかかわらず、男性ホルモンの受容器(AR)が活動的に残り、CRPCのPCaの進行を運転し続けることが知られています。10これは、アンドロゲン産生をさらに減少させるか、またはAR機能を遮断することを目的とした新規薬剤の開発につながっている。 但し、男性ホルモンのシグナリングとは関係なく作用し、またCRPCで起因する他の生物的細道があります。
CHAARTED study11およびSTAMPEDE試験における化学療法の導入、12LATITUDE study13およびSTAMPEDE試験における酢酸アビラテロンおよびプレドニゾンの添加、14ARCHES trial15およびENZAMET試験におけるエンザルタミドの添加、16および最後に、chaarted study13およびSTAMPEDE試験におけるエンザルタミドの添加、16および最後に、chaarted study14およびSTAMPEDE試験におけるエンザルタミドの添加など、mHSPCスペースの治療選択肢にいくつかの重要な変化が生じている。apalutamideのような口頭nonsteroidal反男性ホルモン、 エンザルタミドは、ARのリガンド結合ドメインに直接結合し、AR転座、DNA結合、およびAR媒介転写を防止する。17タイタン試験では、アパルタミド治療mHSPC患者における全生存率(OS)の利益が示された。18アパルタミドはまた、スパルタン第3相プラセボ対照試験における非転移性CRPC(nmCRP)設定においてプラセボよりも利益を示しており、19プロスパートライアル20におけるエンザルタミド治療非転移性去勢抵抗性前立腺癌(nmCRPC)患者によって示されている利益と同様である(“非転移性去勢抵抗性前立腺癌の新規治療法”リンクを参照)。 MHSPCおよびnmCRPCの設定のこれらの処置の前進はmcrpcの設定の患者にどの処置の選択が提供されるべきであるか問題を提起しました。21
CRPCを持つ男性の治療は、過去15年間で劇的に変化しました。 2004年以前、患者が一次ADTに失敗したとき、治療は緩和のためだけに投与された。 Tannockらによる画期的な試験。およびPetrylak e t a l.23は2004年に彼らの存続を改善するために示されていたmCRPCの患者のdocetaxelの化学療法を導入した最初でした。 しかし、ドセタキセルがFDA承認されたため、生存上の優位性を示す5つの追加の有益な薬剤が、無作為化臨床試験に基づいてFDA承認されている(表1)。 これらには、エンザルタミド、およびアンドロゲン軸に特異的に影響を与えるアビラテロン、免疫系を刺激するsipuleucel-T、24cabazitaxel、別の化学療法剤である25およびradium-223、放射性核種療法が含まれる。MCRPCのための26の他の処置は結果を改善するために示しましたが、まだFDAによって承認され、別の検討で論議されます。 CRPCの患者の多数のFDA公認の治療上の代理店の相当な増加が原因で、臨床医は処置の選択の茄多およびmCRPCの臨床意思決定をかなりより複雑にさせるこ
表1. 米国で転移性去勢抵抗性前立腺癌の治療のために承認されているエージェント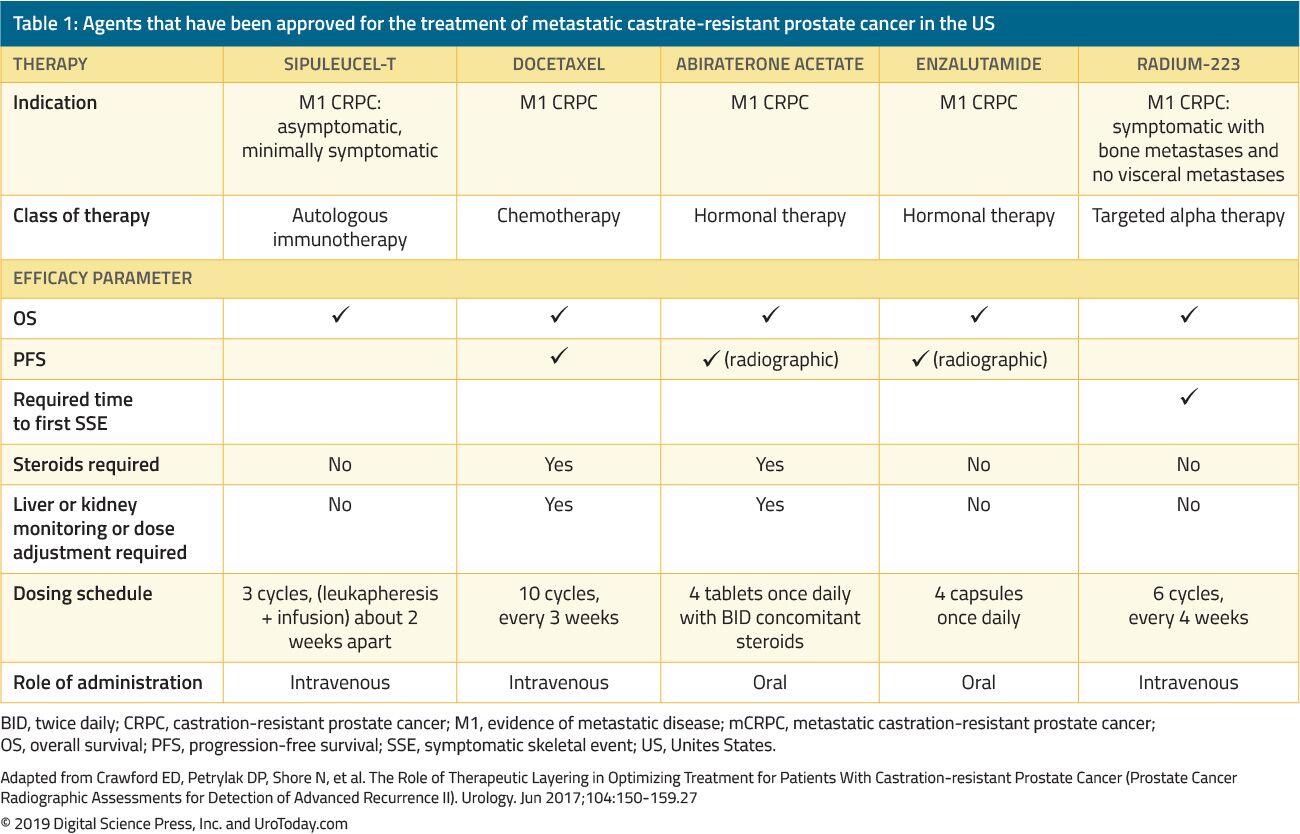
mCRPCは通常、衰弱性疾患であり、患者は泌尿器科医、医療腫瘍学者、放射線腫瘍学者、看護師、心理学者、ソーシャルワーカーからなる学際的なチームによって定式化された管理戦略の恩恵を受ける可能性が最も高い。28痛み、便秘、食欲不振、吐き気、うつ病、疲労の管理を含む追加の全身治療を検討する際には、緩和治療の選択肢について議論することが不可欠である。
この疾患空間に適切な治療順序を確立する際に考慮すべきもう一つの重要なポイントは、関連するコストです。 ドセタキセルの前または後に追加の治療ラインを含むモデルを使用して、28.1ヶ月の平均期間中のmCRPC治療の平均費用は、患者あたり約$48,000であった。29このコストは、患者が複数の治療ラインを受け、病気の過程で継続的な医療サービスを受ける可能性があるため、非常に高い。30
第二および第三選択療法を追加するのではなく、LHRH類似体に残っている患者に対して限界生存利益を実証したのは二つの試験のみである。31、32の研究では、CRPCはADTに耐性がなく、むしろそれに過敏であることが示されている。ADTの間の処置媒介選択圧力は、ARを増幅させ、そして状況が増大しないことを確実にするために、ADTは、MCRPC設定において投与され続けられる。 治療を介した選択圧力はまた、腫瘍の全寿命にわたって継続し、治療を正しく配列する必要性を激化させる。 しかし、将来のデータが不足しているため、去勢を継続することの潜在的な利益は、この治療の最小限のリスクを上回る。 さらに、その後承認されたすべての治療法は、進行中のADTを有する男性で研究されており、それを継続すべき別の理由を追加している。
実際に利用可能な治療選択肢を掘り下げる前に、完全に無症候性のmCRPC患者で治療を開始する時期はまだ不明であることを認識することが重要で 早期治療が優れているかどうか、または患者が症候性になり痛みを発症するまで待つべきかどうかはまだ不明である。 治療を開始する前に、患者の既存の併存疾患および治療を開始することの期待される副作用を考慮する必要があります。 Cou-AA-302試験でアビラテロンを投与された早期mCRPC患者は、通常、プラセボを投与された患者よりもほぼ1年長く生存した(OS中央値、それぞれ53.6ヶ月対41.8ヶ月、HR、0.61;95%CI、0.43〜0.87;P=。006).33このように、早期mCRPC患者は、アビラテロンの早期開始から恩恵を受けました。 同じ試験では、ベースラインPSAを有する無症候性または軽度の症候性mCRPCを有する患者<15.6ng/mLアビラテロンは、プラセボよりも速い速度およびPSA低下の程度をもたらした。現在入手可能なデータは限られているが、治療を後で開始するのではなく、より早く開始する方が有利であることを示唆している可能性が最も高い。33,34
転移性去勢抵抗性前立腺癌の承認された第一選択の治療オプション
アビラテロン
アビラテロンは、17α-ヒドロキシラーゼ/C17,20-リアーゼ(CYP17)酵素の阻害剤である抗アンドロゲンである。 COU-AA-302第III相試験は、内臓metastasesのない1,088化学療法ナイーブ、無症候性または軽度の症候性mCRPC患者におけるアビラテロンを評価した。 この試験では、患者は酢酸アビラテロンまたはプラセボに無作為化され、両方ともプレドニゾン35と組み合わせられた(図1)。 患者は、Eastern Cooperative Oncology Group(ECOG)のパフォーマンスステータス0または1および無症候性または軽度の症候性疾患のいずれかによって層別化された。35OSと放射線無増悪生存率(rPFS)は、共同プライマリエンドポイントでした。 この試験では、22.2ヶ月のフォローアップの中央値の後、アビラテロン腕のRPFの有意な改善があったことが実証された(中央値16.5対8.2ヶ月、HR0.52、p<0.001)。 フォローアップ中央値49.2ヶ月後の最終分析では、OSエンドポイントは有意に陽性であった(34.7vs30.3ヶ月、HR:0.81、95%CI:0.70-0.93、p=0.0033)。36mCRPCは、化学療法がナイーブであっても、幅広い予後スペクトルに及ぶことを覚えておくことが重要です。37COU-AA-302研究のアビラテロン腕の分析では、ベースライン、正常なアルカリホスファターゼおよびLDHレベルで痛みがなく、10未満の骨metastasesの患者は、OSの中央値が42.637しかし、進行の危険因子が多い患者では、OSの中央値が有意に短かった。37アビラテロンの毒性プロファイルを評価すると、ミネラロコルチコイド過剰および肝機能異常に関連するより多くの有害事象を与えるように見えたが、これらは主に1-2の有害作用を等級別にされた。 最後に、abirateroneはまた年配の人口(>75年)で均等に有効であるために示されていました。38
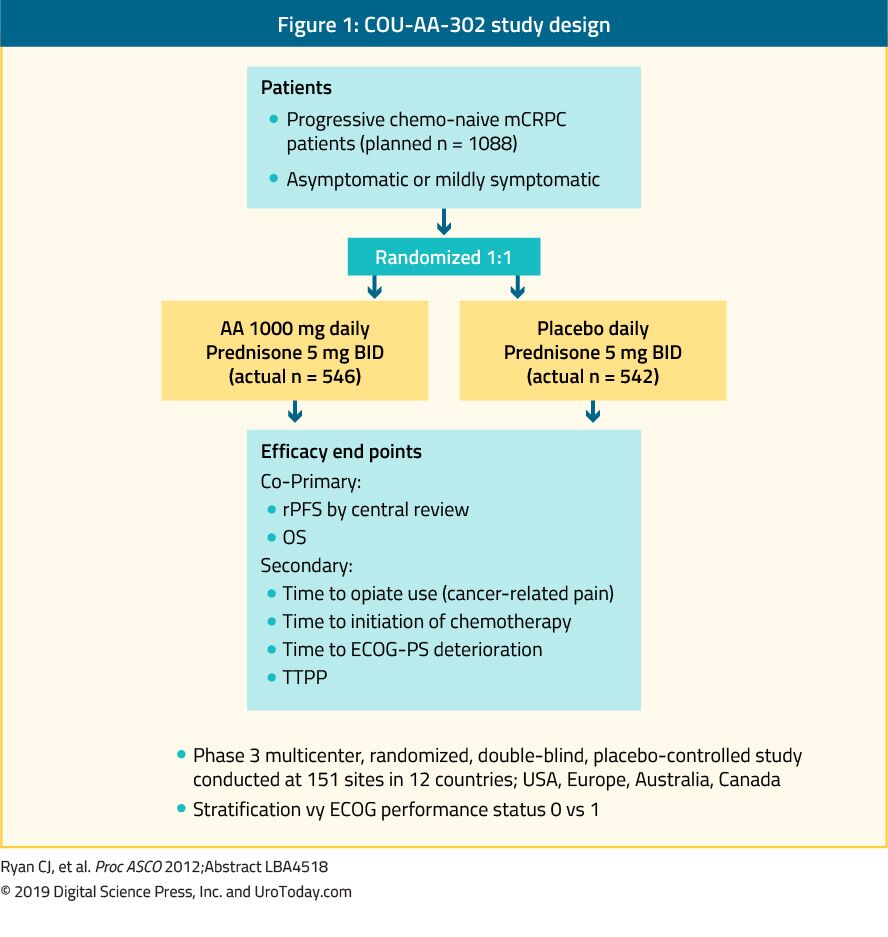
図1. COU-AA-302研究デザイン
エンザルタミド
エンザルタミドは、非ステロイド性抗アンドロゲンである。 無作為化第III相試験であるPREVAIL試験には、1,717人の化学療法未経験のmCRPC患者が含まれ、内臓metastasesを有する患者も同様に適格であった。39この試験では、エンザルタミドとプラセボを比較しました(図2)。 PREVAIL試験では、エンザルタミド治療患者において、rPFS(HR:0.186;CI:0.15-0.23,p<0.0001)とOS(HR:0.706;CI:0.6-0.84,p<0.0001)を含む共一次エンドポイントにおいて有意な改善が示された。0.001)。 延長フォローアップおよび最終的な分析はenzalutamideのためのOSおよびrPFSの利点を確認しました。Enzalutamideと扱われる患者の40の78%50%以上のPSAの減少は報告されました。 最も一般的な臨床的に関連する有害事象は、疲労および高血圧であった。 エンザルタミドは、高齢男性(>75歳)41および内臓metastasesの有無にかかわらず、同様に有効で耐容性が高かった。42しかし、肝metastasesを有する男性については、識別可能な利益はないように見えた。43TERRAIN試験では、pfsの有意な改善を示す無作為化二重盲検第II相試験において、エンザルタミドとビカルタミド、古い抗アンドロゲンとを比較した(15。7 months vs. 5.8 months, HR: 0.44, p < 0.0001) in favor of enzalutamide.44
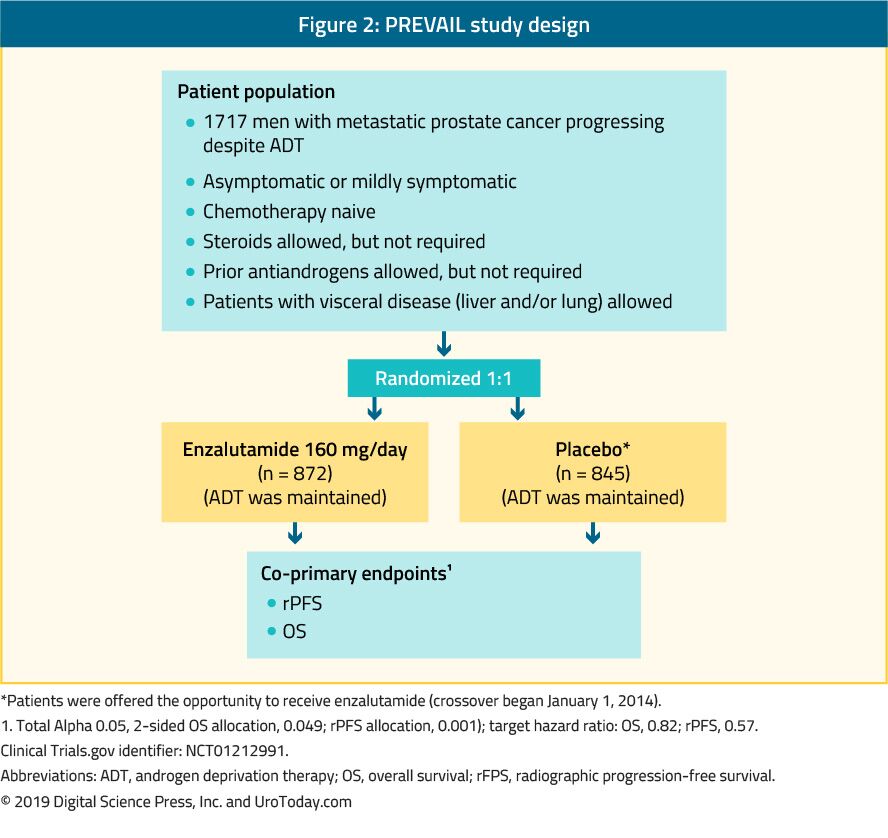
Figure 2. PREVAIL study design
Docetaxel
The landmark trial TAX 327 showed a significant improvement in median OS of 2-2.9 months in mCRPC patients treated with docetaxel-based chemotherapy when compared to patients who were treated with mitoxantrone plus prednisone therapy.22 The SWOG 9916 trial compared mitoxantrone to docetaxel and showed similar results23 (Figure 3). 標準的な第一選択の化学療法はプレドニゾン5mgと1日2回結合される3週間線量のドセタキセル75mg/m2、10までの周期です。 ドセタキセルを投与する際に考慮すべきいくつかの重要な予後因子がある:内臓metastases、疼痛、貧血(Hb<13g/dL)、骨スキャン進行、および事前エストラムスチン これらの予後因子は、ドセタキセルに対する応答を層別化するのに役立つ可能性がある。 これらの予後因子を使用すると、疾患は低リスク、中リスクおよび高リスクに分類することができ、対応する中央値OS推定値は25で有意に異なる。それぞれ7月、18.7月、12.8月。45年齢自体はドセタキセル療法に対する禁忌ではないが、患者はこのタイプの治療に耐えるのに十分に適合しなければならず、併存疾患は治療開始前に評価されるべきである。 Docetaxelの標準的な線量そしてスケジュールを容認してないと考えられる人ではこれは75から50mg/m2に処置の失敗により少ない等級3-4の不利なイベン46
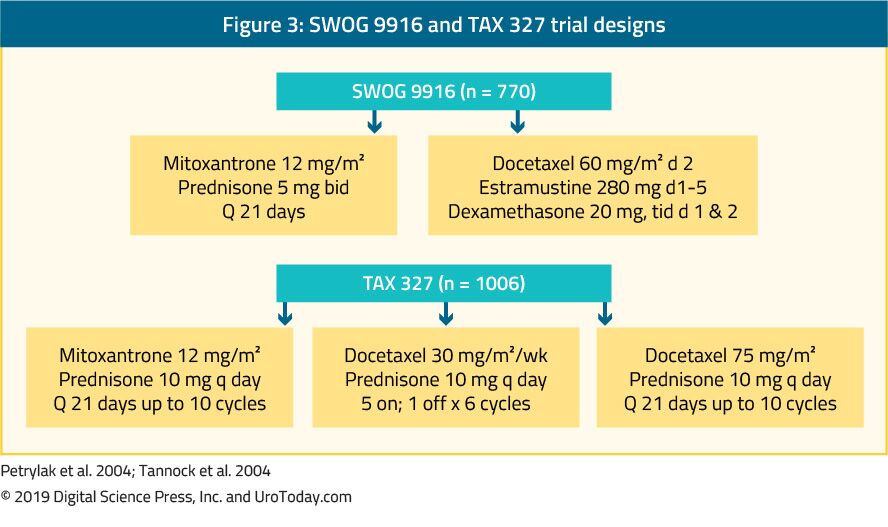
図3。 SWOG9916およびTAX327試験デザイン
Sipuleucel-T
sipuleucel-Tは、自己活性細胞免疫療法であり、プラセボ24と比較した場合、512無症候性または低症候性mCRPC患者に生存利益を付与する第III相試験(インパクト試験)で示された(図4)。 34ヶ月のフォローアップの中央値の後、生存の中央値は、シピュルーセル-T群で有意に高かった(25.8対21.7ヶ月、0.78のHR、p=0.03)。重要なことに、治療中または治療後にPSA低下は観察されず、PFSは両腕で同様であった。 Sipuleucel-Tへの全面的な許容は起こっていて大抵等級1-2の不利なでき事が非常によく、ありました。 現在、この治療法は米国でのみ利用可能であり、ヨーロッパではもはや利用できません。
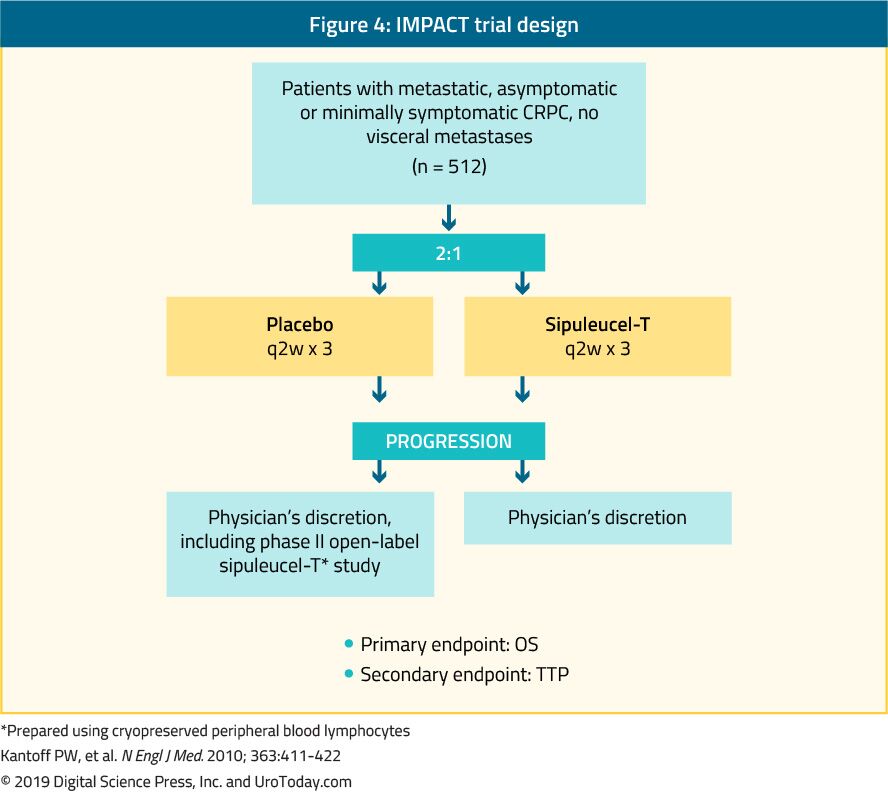
図4。 インパクト試験設計
結論
過去15年間で、mCRPC患者のための医薬品開発にかなりの科学的進歩と投資がありました。 これは苦痛のpalliation、最小になる病気の悪影響およびOSの延長を理由に全身療法の複数のラインのFDAの承認で起因しました。 今日まで、これらの個々の薬剤のそれぞれからのmCRPC患者におけるOSへの報告された影響はまだ控えめであり、その結果、わずか数ヶ月の追加が生じる。 MCRPCの疾患生物学の理解を高め、去勢抵抗性の包括的な分子理解を統合し、将来の治療開発を改善するために、現在の治療に対する抵抗性のメカニズムを解析することが必要である。 また、治療のパーソナライゼーションを支援するために予測バイオマーカーを投資し、開発することも重要です。 最後に、より実用的なノートでは、より多くのデータが適切な第二および第三ラインの治療法、および利用可能な薬物の配列決定および組み合わせに必要とされ、次のレビュー記事(”beyond first line treatment of metastatic castrate-resistant prostate cancer”)でより詳細に議論されている。
公開日:2019年11月19日
Leave a Reply