説明者:同位体とは何ですか?
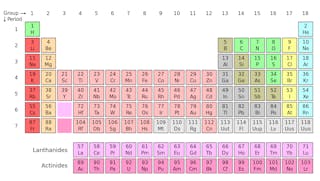
元素の周期表(下記参照)を研究したことがあるなら、この表は私たちの世界を構成する原子の化学的性質について多くのことを明らかにしていることをすでに知っているでしょう。しかし、周期表上の各正方形が実際には同位体の家族を表していることに気付かないかもしれません—原子は同じ名前と化学的性質を共有しますが、 同位体が何であり、どのようにそれらを使用できるかを理解するには、原子の内部を詳しく調べる必要があります。
同位体が何であるかを理解す
物質のビルディングブロック
原子は、陽子と中性子の信じられないほど密なコア(核と呼ばれる)で構成され、電子の拡散陽子と中性子は同じ種類の粒子と考えることができますが、陽子は正に帯電していますが、中性子は電荷を持ちません。
陽子と中性子は同じ種類の粒子と考えることができます。
陽子は正に帯電していますが、中性子は電荷を持ちません。 これは、陽子が電場または磁場を「感じる」ことができることを意味し、中性子はできないことを意味する。
陽子や中性子よりもはるかに軽い電子は、陽子と同じ大きさの電荷を持ちますが、反対の符号を持ち、陽子と電子の数が等しい各原子が電気的に中性であることを意味します。
特定の元素の化学的挙動を決定するのは電子です。

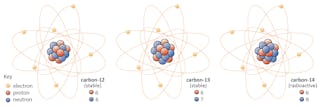
元素の同位体は同じ数の陽子を共有しますが、中性子の数は異なります。 炭素を例にしてみましょう。自然界には炭素12、炭素13、炭素14の3つの同位体があります。
自然界には炭素12、炭素13、炭素14の3つの同位体があります。
自然界には炭素 すべての3つの陽子を持っていますが、それらの中性子数-それぞれ6、7、および8-はすべて異なります。 これは、3つの同位体すべてが異なる原子質量を持っていることを意味します(炭素-14が最も重い)が、同じ原子番号を共有しています(Z=6)。
化学的には、これら三つの同位体のそれぞれの電子の数が同じであるため、三つすべては区別できません。
化学的には、三つの同位体のそれぞれの電子の数が同じであるため、三つ
同じ元素の異なる同位体は、化学的に言えば同じです。 しかし、いくつかの同位体は、完全に別の要素に変換することによって、このルールを回避する能力を持っています。
安定性に向かって行進
いくつかの同位体が持っているこの変換能力は、すべての同位体が安定しているわけではないという事実に関係しており、1913年にフレデリック-ソディがノーベル賞を受賞した同位体の発見につながったものである。炭素-12などのいくつかの同位体は、特別なことが起こらない限り、喜んで炭素として存在し続けるでしょう。
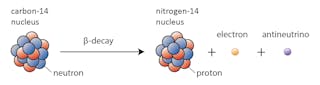
他のもの-炭素-14は、ある時点で近くの安定同位体に崩壊すると言います。
この場合、炭素14中の中性子の1つがプロトンに変化し、窒素14を形成する。 ベータ崩壊として知られているこのプロセスの間に、核は電子と反ニュートリノの形で放射線を放出する。
核が崩壊する原因となる多くの要因があります。 最も重要なのは、特定の核が持つ中性子に対する陽子の比率です。 核に中性子が多すぎる場合(「多すぎる」の定義は核の重さによって異なります)、安定性に向かって崩壊する可能性があります。
核に陽子が多すぎる場合も同じです。 これは、与えられた元素のいくつかの同位体が放射性である一方、他の同位体は放射性ではない理由の一つです。星の腹から
今では、あなたはこれらのすべての同位体が最初の場所でどのように作成されたか疑問に思うかもしれません。 結局のところ、この質問は複雑な質問ですが、私たちはすべて星の塵でできているという格言にいくつかの真実を貸します。
軽い同位体のいくつかは、ビッグバンの間に、宇宙の歴史の中で非常に早い時期に形成されました。 他のものは、星の中で起こるプロセスや、宇宙線として知られている非常にエネルギーの高い核間の偶然の衝突の結果として、私たちの大気中で起こ最も自然に存在する同位体は、長い一連の核反応と崩壊から生じる最終的な(安定または長寿命の)生成物である。
最も自然に存在する同位体は、核反応と崩壊の結果として生じる最終的な(安定または長寿命の)生成物である。
これらの場合のほとんどでは、軽い核は強い力を可能にするのに十分なエネルギーと一緒に粉砕しなければならなかった-陽子と中性子が触れる 強い力が勝つと、衝突する核は一緒に結合するか、融合してより重い核を形成する。 私たちの太陽はこれの良い例です。
私たちの太陽はこれの良い例です。 その主な動力源の1つは、水素をヘリウムに変換する一連の核融合反応とベータ崩壊プロセスです。

知識を道具に変える
同位体の存在が最初に実現された1900年代初頭以来、核物理学者と化学者は、同位体がどのように形成され、どのように崩壊し、どのように使用されるかを研究する方法を模索してきた。
それが判明したように、同位体の性質–その化学的均一性、それらの核の特異性–は、医学、考古学、農業、発電、鉱業などの多様な分野での幅広い用途に役立PETスキャンを受けたことがある場合は、特定の同位体(医療同位体と呼ばれることが多い)の放射性崩壊の副産物の恩恵を受けています。
私たちは、サイクロトロンと呼ばれる原子炉や加速器の助けを借りて、核反応がどのように進行するかの知識を使用して、これらの医学的同位体をしかし、我々はまた、天然に存在する放射性同位体を利用する方法を発見しました。
しかし、我々はまた、天然に存在する放射性同位体を利用する 炭素年代測定は、例えば、長寿命の同位体炭素-14を使用して、古い物体がどのようにあるかを決定する。 通常の状況下では、炭素-14は窒素-14との宇宙線反応を介して大気中で生成されます。
通常の状況下では、炭素-14は窒素-14との宇宙線反応を介して それはおよそ5,700年の半減期を持っています、それは量の炭素-14の半分がその期間内に減衰していることを意味します。

生物が生きている間、それはすべての兆安定した炭素-14同位体のために約一つの炭素-14同位体を取り、炭素-12対炭素-14比は、生物が生き それが死ぬと、炭素の新しい摂取が停止します。
これは、炭素-14と炭素-12の比率が、この生物の残骸の時間の経過とともに変化することを意味します。サンプルから化学的方法を使用して炭素を抽出する場合、加速器質量分析(AMS)と呼ばれる方法を適用して、個々の炭素同位体を重量で分離することがで
AMSは、同じ電荷を持つが質量が異なる加速粒子が磁場を通って別々の経路をたどるという事実を利用しています。
AMSは、同じ電荷を持 これらの別々の経路を利用することによって、我々は信じられないほどの精度で同位体比を決定することができます。これらの例からわかるように、同位体の知識をさまざまな方法で適用します。
私たちは、それらを生成し、それらを検出し、それらを抽出し、原子核がなぜそれがそうであるように振る舞うのか、そして私たちが私たちの利益のためにその力をどのように利用できるのかを理解するという二重の目的でそれらを研究します。
Leave a Reply