化学:酸と塩基は何ですか?
酸と塩基は何ですか?酸と塩基を記述するために使用される一般的な定義は1つではなく、3つあります:Arrhenius酸と塩基、Brnsted-Lowry酸と塩基、およびLewis酸と塩基。 これは、酸と塩基について3回学ぶ必要があるかのように聞こえますが、良いニュースは、多くの実用的な目的のために、これら3つの定義はほぼ同等でアレニウス酸と塩基
1800年代後半に戻って、私たちの古い友人Svante Arrheniusは、動力学の問題に取り組んでいる間、酸と塩基の定義を思い付いた。Arrheniusによると、酸は水の中で分解してヒドロニウム(H+)イオンを放出する化合物です。 アレニウス酸の一般的な例は塩酸(HCl)である:
- HCl? H++Cl-
酸の式は通常、水素で始まりますが、有機酸は注目すべき例外です。 いくつかの一般的な酸の名前と式は以下の表に示されています:
酸名
式
塩酸
HCl
硝酸
HNO3
リン酸
リン酸
リン酸
リン酸
リン酸
リン酸
リン酸
リン酸
リン酸td>
h3po4
硫酸
h2so4
酢酸
c2h4o2
アレニウス塩基は、水に入れたときに水酸化物イオン アレニウス塩基の一例は、水酸化ナトリウム(NaOH)である:
- NaOH? Na++OH-
塩基は通常、式に”OH”を持っていますが、例外があります。 例えば、アンモニア(NH3)は水酸化物イオンを含まないが、水と反応するとそれらを形成する:
- NH3+H2O? NH4++OH-
いくつかの一般的な塩基の名前と式は、次の表にあります:
塩基名
式
アンモニア
NH3
水酸化カリウム
KOH
重炭酸ナトリウム
Nahco3
炭酸ナトリウム
na2co3
水酸化ナトリウム
naoh
水を加えると酸や塩基を形成する酸化物があります。 これらの化合物は、水と反応しない限り、H+またはOH-イオンを含まないため、「無水物」と呼ばれます。「典型的には、非金属の酸化物は酸無水物(水に入れたときに酸を形成する)であり、金属の酸化物は塩基無水物(水に入れたときに塩基を形成する)である。
Brnsted-Lowry Acids and Bases
1900年代初頭、Johannes BrnstedとThomas Lowryによって、アンモニアが水が存在しなくてもHClの酸性度を中和できるという事実を説明するために、酸と塩基の別の定義が提案された。 この現象は、水酸化物イオンを形成するために周りに水がない場合でも、アンモニアが塩基であることを示しました。
5xmlns=”http://www.w3.org/1999/xhtmlモルは言う
ハイドロニウムイオンを記述するために使用される多くの異なる名前と式があ 式は以前は「H+」として示されていましたが、これはH+が水と結合したときに形成されるイオンであるため、「H3O」と書かれることがあります。 ヒドロニウムイオンを参照する別の一般的な方法は、単にそれらを”陽子”と呼ぶことです。「この名前は、H+がその電子を失った水素原子(1つの陽子と1つの電子)を表し、裸の陽子だけを残しているという事実から来ています。Brnsted-Lowry酸は、別の化合物にハイドロニウムイオンを与える化合物として定義されていますか?例えば、塩酸は、それが反応する化合物にH+イオンを与える。 Brnsted-Lowry塩基は、ヒドロニウムイオンを受け入れることができる化合物ですか?アンモニアはHClからハイドロニウムイオンを得るとき、アンモニウムイオンを形作ります。以下の式は、Brnsted-Lowry酸とBrnsted-Lowry塩基との反応を表します。
- HNO3+NH3? NO3-+NH4+
この反応では、硝酸はアンモニアにプロトンを与えるため、酸として振る舞う。 アンモニアは硝酸からプロトンを受け入れるので塩基として振る舞う。しかし、方程式の反対側を見てみると、硝酸イオンとアンモニウムイオンが見つかります。 硝酸イオンはアンモニウムイオンからプロトンを受け入れることができるので(HNO3を形成するために)、硝酸イオンは非常に弱いBrnsted-Lowry塩基である。 アンモニウムイオンは(この場合は硝酸塩イオンに)供与する余分なプロトンを有するので、それはBrnsted-Lowry酸である。
硝酸イオンは硝酸分子に基づいているので、それは硝酸の共役塩基であると言います。 同様に、アンモニウムイオンはアンモナルの共役酸です。 一緒に、その共役塩基との酸(例えば、H NO3およびNO3−)またはその共役酸との塩基(例えば、N H3およびN H4+)は、共役酸−塩基対と呼ばれる。
ルイス酸と塩基
酸と塩基のBrnsted-Lowryの定義では、塩基は陽子を受け入れることができる化合物として定義されています。 しかし、それはどのように陽子を受け入れるのですか?
Brnsted-Lowry塩基が互いに共通している一つの特徴は、それらが共有されていない電子対を持っていることです。 ヒドロニウムイオンが分子によってさまよってくると、孤立したペアが手を伸ばしてそれをつかむことがあります。 これの例は、アンモニアが酸性溶液中でプロトンを受け入れる場合です。
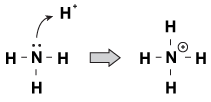
図23.1アンモニアは、その孤立電子対を持つ硝酸からプロトンをつかむことができます。
このプロセスを見る1つの方法は、アンモニア原子がその孤立電子対をプロトンに供与していることです。 孤立電子対がこの化学反応を駆動しているので、我々は”ルイス酸度/塩基度”と呼ばれる酸性度と塩基度の新しい定義を持っています。「ルイス塩基は、電子対を別の化合物(この例ではアンモニア)に供与する化合物である。 ルイス酸は、電子対(この例ではH+イオン)を受け入れる化合物です。
5xmlns=”http://www.w3.org/1999/xhtml分子の意味
ルイス塩基は、電子対を寄付することができる化学物質です。 ルイス酸はそれらを受け入れることができる化学物質です。この例ではアンモニアが孤立電子対をプロトンに供与していましたが、アンモニアの孤立電子対は他の多くの化合物と反応することができます。 例えば、アンモニアは、次のプロセスによってその孤立電子対をBH3に寄付することができます。

図23.2アンモニア上の孤立電子対は、BH3に自分自身を結合します。このプロセスでは、アンモニアはルイス塩基であり、BH3はルイス酸である。
一般的に、酸と塩基のルイス定義は、三つの定義の中で最も包括的であるため、最も有用です。 例えば、酸のBrnsted-Lowryの定義にはHFは含まれていますが、Bh3は含まれておらず、ルイス塩基上の孤立電子対によって結合されたときにプロトンを失わない。Ian GuchによるComplete Idiot’s Guide to Chemistry2003からの抜粋。
すべての権利は、その全部または一部をいかなる形式でも複製する権利を含むものとします。 ペンギン-グループ(アメリカ)の一員であるアルファ-ブックスとの提携により使用されている。
この本を出版社から直接注文するには、Penguin USAのウェブサイトを訪問するか、1-800-253-6476に電話してください。 また、この本を購入することができますAmazon.com そしてバーンズ&ノーブル。
1800年代後半に戻って、私たちの古い友人Svante Arrheniusは、動力学の問題に取り組んでいる間、酸と塩基の定義を思い付いた。Arrheniusによると、酸は水の中で分解してヒドロニウム(H+)イオンを放出する化合物です。 アレニウス酸の一般的な例は塩酸(HCl)である:
- HCl? H++Cl-
酸の式は通常、水素で始まりますが、有機酸は注目すべき例外です。 いくつかの一般的な酸の名前と式は以下の表に示されています:
| 酸名 | 式 |
|---|---|
| 塩酸 | HCl |
| 硝酸 | HNO3 |
| リン酸 | |
| リン酸 | |
| リン酸 | |
| リン酸 | |
| リン酸 | |
| リン酸 | |
| リン酸 | |
| リン酸 | |
| リン酸td> | h3po4 |
| 硫酸 | h2so4 |
| c2h4o2 |
アレニウス塩基は、水に入れたときに水酸化物イオン アレニウス塩基の一例は、水酸化ナトリウム(NaOH)である:
- NaOH? Na++OH-
塩基は通常、式に”OH”を持っていますが、例外があります。 例えば、アンモニア(NH3)は水酸化物イオンを含まないが、水と反応するとそれらを形成する:
- NH3+H2O? NH4++OH-
いくつかの一般的な塩基の名前と式は、次の表にあります:
KOH
水を加えると酸や塩基を形成する酸化物があります。 これらの化合物は、水と反応しない限り、H+またはOH-イオンを含まないため、「無水物」と呼ばれます。「典型的には、非金属の酸化物は酸無水物(水に入れたときに酸を形成する)であり、金属の酸化物は塩基無水物(水に入れたときに塩基を形成する)である。
1900年代初頭、Johannes BrnstedとThomas Lowryによって、アンモニアが水が存在しなくてもHClの酸性度を中和できるという事実を説明するために、酸と塩基の別の定義が提案された。 この現象は、水酸化物イオンを形成するために周りに水がない場合でも、アンモニアが塩基であることを示しました。
ハイドロニウムイオンを記述するために使用される多くの異なる名前と式があ 式は以前は「H+」として示されていましたが、これはH+が水と結合したときに形成されるイオンであるため、「H3O」と書かれることがあります。 ヒドロニウムイオンを参照する別の一般的な方法は、単にそれらを”陽子”と呼ぶことです。「この名前は、H+がその電子を失った水素原子(1つの陽子と1つの電子)を表し、裸の陽子だけを残しているという事実から来ています。Brnsted-Lowry酸は、別の化合物にハイドロニウムイオンを与える化合物として定義されていますか?例えば、塩酸は、それが反応する化合物にH+イオンを与える。 Brnsted-Lowry塩基は、ヒドロニウムイオンを受け入れることができる化合物ですか?アンモニアはHClからハイドロニウムイオンを得るとき、アンモニウムイオンを形作ります。以下の式は、Brnsted-Lowry酸とBrnsted-Lowry塩基との反応を表します。
- HNO3+NH3? NO3-+NH4+
この反応では、硝酸はアンモニアにプロトンを与えるため、酸として振る舞う。 アンモニアは硝酸からプロトンを受け入れるので塩基として振る舞う。しかし、方程式の反対側を見てみると、硝酸イオンとアンモニウムイオンが見つかります。 硝酸イオンはアンモニウムイオンからプロトンを受け入れることができるので(HNO3を形成するために)、硝酸イオンは非常に弱いBrnsted-Lowry塩基である。 アンモニウムイオンは(この場合は硝酸塩イオンに)供与する余分なプロトンを有するので、それはBrnsted-Lowry酸である。
硝酸イオンは硝酸分子に基づいているので、それは硝酸の共役塩基であると言います。 同様に、アンモニウムイオンはアンモナルの共役酸です。 一緒に、その共役塩基との酸(例えば、H NO3およびNO3−)またはその共役酸との塩基(例えば、N H3およびN H4+)は、共役酸−塩基対と呼ばれる。
酸と塩基のBrnsted-Lowryの定義では、塩基は陽子を受け入れることができる化合物として定義されています。 しかし、それはどのように陽子を受け入れるのですか?
Brnsted-Lowry塩基が互いに共通している一つの特徴は、それらが共有されていない電子対を持っていることです。 ヒドロニウムイオンが分子によってさまよってくると、孤立したペアが手を伸ばしてそれをつかむことがあります。 これの例は、アンモニアが酸性溶液中でプロトンを受け入れる場合です。

図23.1アンモニアは、その孤立電子対を持つ硝酸からプロトンをつかむことができます。
このプロセスを見る1つの方法は、アンモニア原子がその孤立電子対をプロトンに供与していることです。 孤立電子対がこの化学反応を駆動しているので、我々は”ルイス酸度/塩基度”と呼ばれる酸性度と塩基度の新しい定義を持っています。「ルイス塩基は、電子対を別の化合物(この例ではアンモニア)に供与する化合物である。 ルイス酸は、電子対(この例ではH+イオン)を受け入れる化合物です。
ルイス塩基は、電子対を寄付することができる化学物質です。 ルイス酸はそれらを受け入れることができる化学物質です。この例ではアンモニアが孤立電子対をプロトンに供与していましたが、アンモニアの孤立電子対は他の多くの化合物と反応することができます。 例えば、アンモニアは、次のプロセスによってその孤立電子対をBH3に寄付することができます。

図23.2アンモニア上の孤立電子対は、BH3に自分自身を結合します。このプロセスでは、アンモニアはルイス塩基であり、BH3はルイス酸である。
一般的に、酸と塩基のルイス定義は、三つの定義の中で最も包括的であるため、最も有用です。 例えば、酸のBrnsted-Lowryの定義にはHFは含まれていますが、Bh3は含まれておらず、ルイス塩基上の孤立電子対によって結合されたときにプロトンを失わない。Ian GuchによるComplete Idiot’s Guide to Chemistry2003からの抜粋。
すべての権利は、その全部または一部をいかなる形式でも複製する権利を含むものとします。 ペンギン-グループ(アメリカ)の一員であるアルファ-ブックスとの提携により使用されている。
この本を出版社から直接注文するには、Penguin USAのウェブサイトを訪問するか、1-800-253-6476に電話してください。 また、この本を購入することができますAmazon.com そしてバーンズ&ノーブル。
Leave a Reply