Traitement de première intention du cancer de la prostate métastatique résistant à la castrate
En 2019, le cancer de la prostate (ACP) représente près de 1 nouveau diagnostic de cancer sur 5 chez les hommes aux États-Unis.1 Au cours des dernières années, le taux d’incidence global du cancer de la prostate (ACP) a diminué d’environ 7 % par année.1 La forte baisse de l’incidence a été généralement attribuée à une diminution des tests d’antigène prostatique spécifique (PSA) de 2008 à 2013. La diminution de l’utilisation du dépistage de l’APS a été causée par les recommandations du Groupe de travail des Services de prévention des États-Unis contre le dépistage systématique de l’APS. Il s’agissait d’une recommandation de grade D spécifiquement chez les hommes âgés de 75 ans et plus, qui a été déclarée en 2008, puis étendue à tous les hommes en 2011, en raison des préoccupations croissantes de surdiagnostic et de surtraitement.2 Bien que la prévalence du dépistage de l’APS ait cessé de diminuer et se soit stabilisée de 2013 à 20153, l’effet de la réduction du dépistage sur l’incidence de la maladie à un stade avancé n’est toujours pas clair. Une analyse d’un vaste registre du cancer couvrant 89% de la population américaine a indiqué que la baisse globale de l’incidence de l’ACP masquait en fait une augmentation des diagnostics à un stade éloigné à partir de 2010, quel que soit l’âge et la race.4
Quel que soit le traitement administré, environ 20% à 30% des patients atteints de PCa localisée évoluent vers une maladie métastatique, généralement traitée par hormonothérapie.5 Cela peut être administré par castration chirurgicale (orchidectomie bilatérale) ou par castration médicale utilisant un traitement de privation d’androgènes (TDA). Les deux méthodes atteignent un taux de castrat de testostérone sérique qui est considéré comme la norme de soins pour le traitement de l’ACP hormono-sensible métastatique (mHSPC). Cependant, la mHSPC est destinée à évoluer vers un cancer de la prostate métastatique résistant à la castrate (mCRPC).6 L’état de cancer de la prostate résistant à la castrate (CRPC) est défini comme une progression de la maladie malgré l’atteinte de taux de testostérone castrale (testostérone sérique < 50 ng / dL ou 1.7 nmol / L), et peut se présenter soit comme une augmentation continue des taux sériques de PSA, une progression de la maladie préexistante et / ou l’apparition de nouvelles métastases.7 Le CPCR a une survie médiane d’environ trois ans8 et est associé à une détérioration importante de la qualité de vie.9 Le mécanisme exact de la transition de la CSPM à la cMRPC n’est toujours pas clair. Cependant, il est connu que malgré les niveaux de castrat d’androgènes, le récepteur aux androgènes (AR) reste actif et continue de stimuler la progression de l’ACP dans le CRPC.10 Cela a conduit au développement de nouveaux agents visant à réduire davantage la production d’androgènes ou à bloquer la fonction AR. Cependant, il existe d’autres voies biologiques qui fonctionnent indépendamment de la signalisation des androgènes et entraînent également une CRPC.
Plusieurs changements significatifs se sont produits dans les options de traitement de l’espace mHSPC, ce qui a entraîné un bénéfice substantiel pour la survie (voir le lien « Stratégie de gestion en évolution rapide du cancer de la prostate sensible aux hormones métastatiques”), y compris l’introduction de la chimiothérapie dans l’étude CHAARTED11 et l’essai STAMPEDE,12 l’ajout d’acétate d’abiratérone et de prednisone dans l’étude LATITUDE 13 et l’essai STAMPEDE,14 l’ajout d’enzalutamide dans l’essai ARCHES 15 et l’étude ENZAMET,16 et enfin, l’ajout d’apalutamide, un anti-androgène non stéroïdien oral, qui comme l’enzalutamide se lie directement au domaine de liaison des ligands de l’AR et empêche la translocation de l’AR, la liaison à l’ADN et la transcription médiée par l’AR.17 L’essai TITAN a montré un bénéfice de survie globale (OS) chez les patients mHSPC traités par l’apalutamide.18 L’apalutamide a également montré un bénéfice par rapport au placebo dans le cadre du CRPC non métastatique (nmCRP) dans l’essai contrôlé par placebo de phase 3 de SPARTAN,19 similaire au bénéfice montré par les patients atteints d’un cancer de la prostate non résistant à la castrate métastatique traité par l’enzalutamide (nmCRPC), dans l’essai prosper20 (veuillez consulter le lien « Nouveaux traitements pour le cancer de la prostate résistant à la castrate non métastatique”). Ces progrès thérapeutiques dans le cadre de la CMSC et de la nmCRPC ont soulevé la question des options de traitement qui devraient être offertes aux patients dans le cadre de la CMCRPC.21
Le traitement des hommes atteints de CRPC a radicalement changé au cours des 15 dernières années. Avant 2004, lorsque les patients ont échoué à la TDA primaire, les traitements étaient administrés uniquement pour les soins palliatifs. Les essais marquants de Tannock et al.22 et Petrylak et al.23 en 2004 ont été les premiers à introduire une chimiothérapie au docétaxel chez des patients atteints de mCRPC dont il a été démontré qu’ils amélioraient leur survie. Cependant, depuis que le docétaxel a été approuvé par la FDA, cinq agents bénéfiques supplémentaires présentant un avantage de survie ont été approuvés par la FDA sur la base d’essais cliniques randomisés (tableau 1). Ceux-ci comprennent l’enzalutamide et l’abiratérone, qui affectent spécifiquement l’axe des androgènes, le sipuleucel-T, qui stimule le système immunitaire; 24 le cabazitaxel, qui est un autre agent chimiothérapeutique; 25 et le radium-223, une thérapie par radionucléides.26 Autres traitements pour mCRPC ont montré pour améliorer les résultats, mais ont encore été approuvés par la FDA et seront discutés dans une autre revue. En raison de l’augmentation substantielle de plusieurs agents thérapeutiques approuvés par la FDA chez les patients atteints de CRPC, les cliniciens sont confrontés à une pléthore d’options de traitement et à une multitude de séquences potentielles de ces agents, ce qui rend la prise de décision clinique en mCRPC beaucoup plus complexe.
Tableau 1. Les agents qui ont été approuvés pour le traitement du cancer de la prostate métastatique résistant à la castrate aux États-Unis 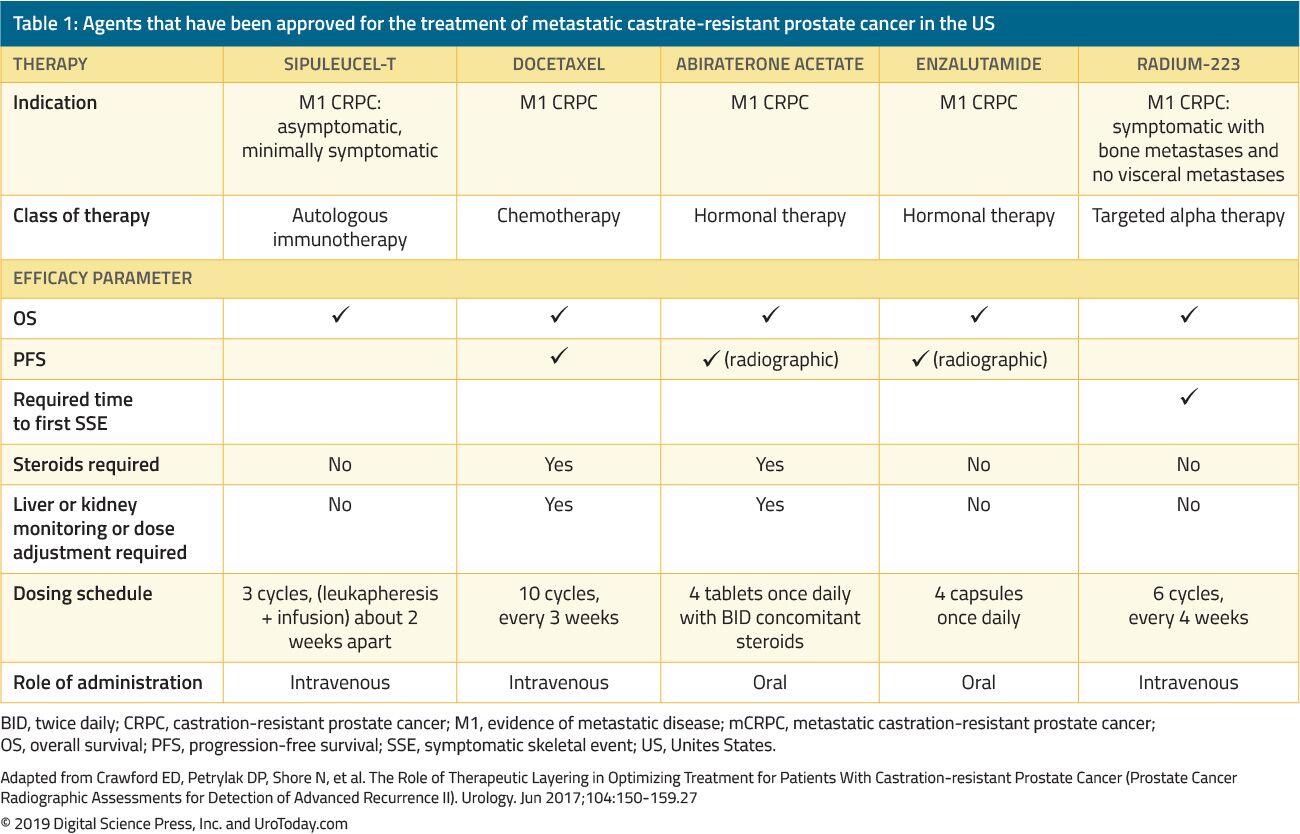
Le mCRPC est généralement une maladie débilitante, et les patients bénéficieront très probablement d’une stratégie de prise en charge formalisée par une équipe multidisciplinaire composée d’urologues, d’oncologues médicaux, d’oncologues en radio-oncologie, d’infirmières, de psychologues et de travailleurs sociaux.28 Il est impératif de discuter des options de traitement de palliation lorsqu’on envisage un traitement systémique supplémentaire, y compris la prise en charge de la douleur, de la constipation, de l’anorexie, des nausées, de la dépression et de la fatigue.
Un autre point crucial à considérer lors de l’établissement de la séquence de traitement appropriée dans cet espace pathologique est le coût associé. En utilisant des modèles qui incluaient des lignes de traitement supplémentaires avant ou après le docétaxel, le coût moyen du traitement mCRPC pendant une période moyenne de 28,1 mois était d’environ 48 000 $ par patient.29 Ce coût est assez élevé en raison du fait que les patients peuvent recevoir plusieurs lignes de traitement et subir des services médicaux continus au cours de leur maladie.30
Seuls deux essais ont démontré un bénéfice marginal de survie pour les patients restant sous analogues de la LHRH au lieu d’ajouter des traitements de deuxième et troisième intention.31, 32 études ont montré que le CRPC n’est pas résistant à l’ADT, mais plutôt hypersensible à celui-ci.10 La pression de sélection médiée par le traitement pendant la TDA provoque une amplification de la RA et garantit que la situation ne s’aggrave pas, la TDA continue à être administrée dans le cadre de la mCRPC. La pression de sélection médiée par le traitement se poursuit également tout au long de la durée de vie de la tumeur, intensifiant la nécessité de séquencer correctement les thérapies. Cependant, en l’absence de données prospectives, l’infime bénéfice potentiel de la castration continue l’emporte toujours sur le risque minimal de ce traitement. De plus, tous les traitements approuvés par la suite ont été étudiés chez les hommes avec une TDA en cours, ajoutant une autre raison pour laquelle il devrait être poursuivi.
Avant de se pencher sur les options de traitement disponibles, il est important de reconnaître qu’il n’est toujours pas clair quand commencer le traitement chez les patients mCRPC qui sont complètement asymptomatiques. On ignore encore si un traitement plus précoce est supérieur ou s’il faut attendre que le patient devienne symptomatique et développe une douleur. Avant de commencer le traitement, nous devons tenir compte des comorbidités existantes du patient et des effets indésirables attendus du début du traitement. Les patients atteints de mCRPC à un stade précoce dans l’essai COU-AA-302 qui ont reçu de l’abiratérone ont généralement survécu près d’un an de plus que ceux qui ont reçu le placebo (OS médian, 53,6 mois contre 41,8 mois, respectivement, HR, 0,61; IC à 95%, 0,43 à 0,87; P =.006).33 Ainsi, les patients mCRPC à un stade précoce ont bénéficié d’un début plus précoce de l’abiratérone. Dans le même essai, les patients atteints de mCRPC asymptomatique ou légèrement symptomatique, avec PSA < 15,6 ng / mL d’abiratérone ont également entraîné un taux plus rapide et un plus grand degré de déclin de PSA que le placebo.34 Bien que les données actuellement disponibles soient limitées, elles suggèrent très probablement qu’il est plus avantageux de commencer le traitement plus tôt que plus tard.33, 34
Options de traitement de première intention approuvées pour le cancer de la prostate métastatique résistant à la castrate
Abiratérone
L’abiratérone est un antiandrogène qui est un inhibiteur de l’enzyme 17α-hydroxylase / C17, 20-lyase (CYP17). L’étude de phase III du COU-AA-302 a évalué l’abiratérone chez 1 088 patients chimio-naïfs, asymptomatiques ou modérément symptomatiques atteints de mCRPC sans métastases viscérales. Dans cet essai, les patients ont été randomisés en acétate d’abiratérone ou en placebo, tous deux associés à prednisone35 (figure 1). Les patients ont été stratifiés par l’état de performance du Groupe d’oncologie coopérative de l’Est (ECOG) 0 ou 1 et par une maladie asymptomatique ou légèrement symptomatique.35 OS et survie sans progression radiographique (rPFS) étaient les points d’extrémité co-primaires. L’essai a démontré qu’après un suivi médian de 22,2 mois, il y avait une amélioration significative des FPR dans le bras abiratérone (médiane 16,5 contre 8,2 mois, HR 0,52, p < 0,001). À l’analyse finale après un suivi médian de 49,2 mois, le point final de l’OS était significativement positif (34,7 contre 30,3 mois, HR: 0,81, IC à 95%: 0,70-0,93, p = 0,0033).36 Il est important de se rappeler que la mCRPC couvre un large spectre pronostique même lorsqu’elle est naïve en chimiothérapie.37 Dans une analyse du bras abiratérone de l’étude COU-AA-302, les patients qui n’avaient aucune douleur au départ, des taux normaux de phosphatase alcaline et de LDH et moins de 10 métastases osseuses avaient un OS médian de 42,6 mois.37 Cependant, les patients présentant plus de facteurs de risque de progression avaient un OS médian significativement plus court.37 Lors de l’évaluation du profil de toxicité de l’abiratérone, il semblait conférer plus d’événements indésirables liés à un excès de minéralocorticoïdes et à des anomalies de la fonction hépatique, mais il s’agissait principalement d’effets indésirables classés 1 à 2. Enfin, l’abiratérone s’est également avérée également efficace chez la population âgée (> 75 ans).38
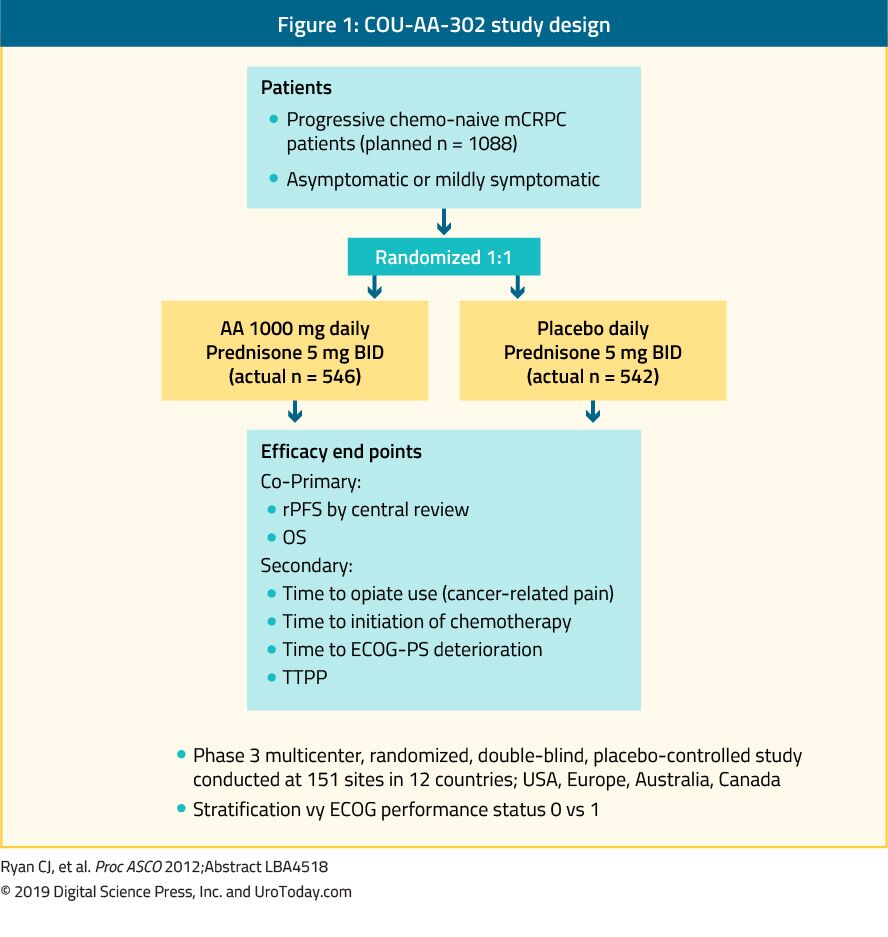
Figure 1. Plan d’étude COU-AA-302
Enzalutamide
L’enzalutamide est un antiandrogène non stéroïdien. L’étude PREVAIL, qui est un essai randomisé de phase III, a inclus 1 717 patients chimio-naïfs de mCRPC et des patients atteints de métastases viscérales étaient également éligibles.39 Cet essai a comparé l’enzalutamide au placebo (figure 2). L’essai PREVAIL a montré une amélioration significative chez les patients traités par l’enzalutamide dans les deux paramètres co-primaires, qui comprenaient les FPR (HR: 0,186; IC: 0,15-0,23, p < 0,0001) et les OS (HR: 0,706; IC: 0,6-0,84, p < 0,001). Un suivi prolongé et une analyse finale ont confirmé un avantage dans les OS et les FPR pour l’enzalutamide.40 Chez 78% des patients traités par l’enzalutamide, une diminution de l’APS de plus de 50% a été rapportée. Les effets indésirables cliniquement pertinents les plus courants étaient la fatigue et l’hypertension. L’enzalutamide s’est également avéré également efficace et bien toléré chez les hommes plus âgés (>75 ans)41 et chez ceux avec ou sans métastases viscérales.42 Cependant, chez les hommes atteints de métastases hépatiques, il ne semblait y avoir aucun avantage perceptible.43 L’essai TERRAIN a comparé l’enzalutamide avec le bicalutamide, un antiandrogène plus ancien, dans une étude randomisée de phase II en double aveugle, montrant une amélioration significative de la SSP (15.7 months vs. 5.8 months, HR: 0.44, p < 0.0001) in favor of enzalutamide.44
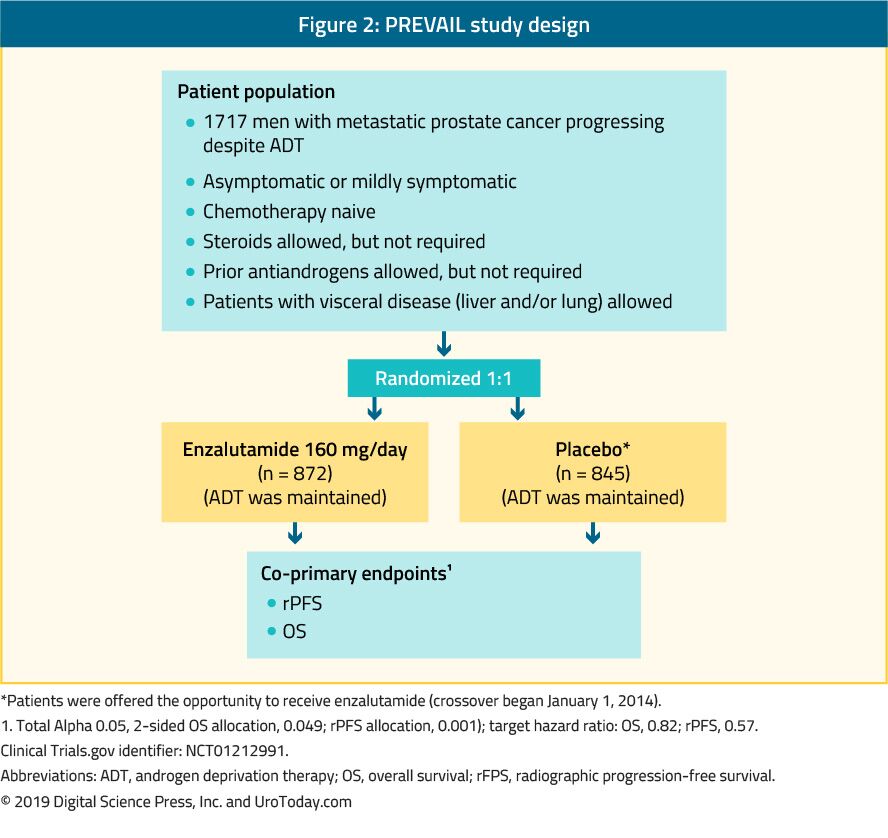
Figure 2. PREVAIL study design
Docetaxel
The landmark trial TAX 327 showed a significant improvement in median OS of 2-2.9 months in mCRPC patients treated with docetaxel-based chemotherapy when compared to patients who were treated with mitoxantrone plus prednisone therapy.22 The SWOG 9916 trial compared mitoxantrone to docetaxel and showed similar results23 (Figure 3). La chimiothérapie de première intention standard est le docétaxel à 75 mg / m2 en doses de trois semaines combinées à la prednisone à 5 mg deux fois par jour, jusqu’à dix cycles. Plusieurs facteurs pronostiques importants doivent être pris en compte lors de l’administration de docétaxel: métastases viscérales, douleur, anémie (Hb < 13 g / dL), progression de l’analyse osseuse et traitement préalable à l’estramustine. Ces facteurs pronostiques peuvent aider à stratifier la réponse au docétaxel. En utilisant ces facteurs pronostiques, la maladie peut être classée en risque faible, intermédiaire et élevé, avec des estimations de l’OS médian correspondantes significativement différentes de 25.7, 18,7 et 12,8 mois, respectivement.45 Bien que l’âge en lui-même ne soit pas une contre-indication au traitement par le docétaxel, les patients doivent être suffisamment en forme pour supporter ce type de traitement et les comorbidités doivent être évaluées avant l’initiation du traitement. Chez les hommes considérés comme incapables de tolérer la dose et le calendrier standard de docétaxel, cette dose peut être réduite de 75 à 50 mg / m2 toutes les deux semaines, ce qui montre moins d’événements indésirables de grade 3-4 et un délai plus long avant l’échec du traitement.46
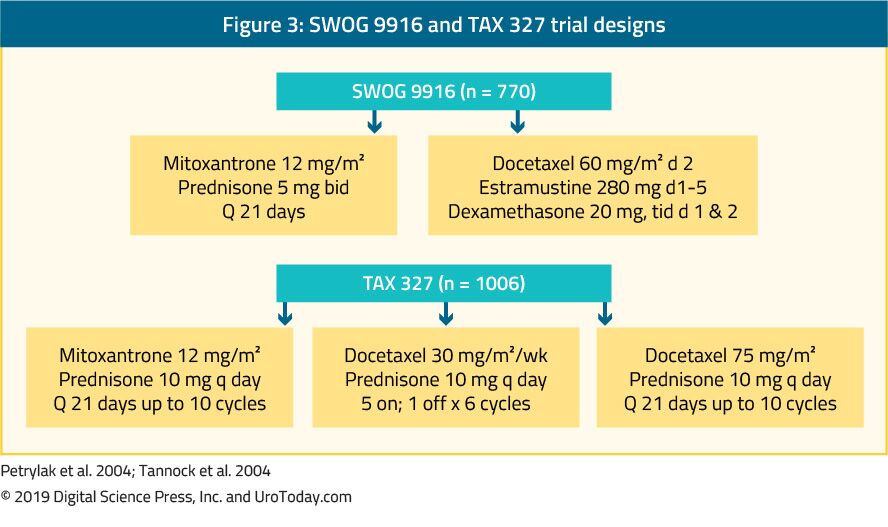
Figure 3. Modèles d’essais SWOG 9916 et TAX 327
Sipuleucel-T
Sipuleucel-T, une immunothérapie cellulaire active autologue, a été montré dans un essai de phase III (essai IMPACT) pour conférer un bénéfice de survie chez 512 patients mCRPC asymptomatiques ou minimalement symptomatiques par rapport à placebo24 (Figure 4). Après un suivi médian de 34 mois, la survie médiane était significativement plus élevée dans le groupe sipuleucel-T (25,8 contre 21,7 mois, avec un HR de 0,78, p = 0,03).24 Fait important, aucun déclin du PSA n’a été observé pendant ou après le traitement et la SSP était similaire dans les deux bras. La tolérance globale au sipuleucel-T était très bonne, avec principalement des événements indésirables de grade 1-2. Actuellement, ce traitement n’est disponible qu’aux États-Unis et n’est plus disponible en Europe.
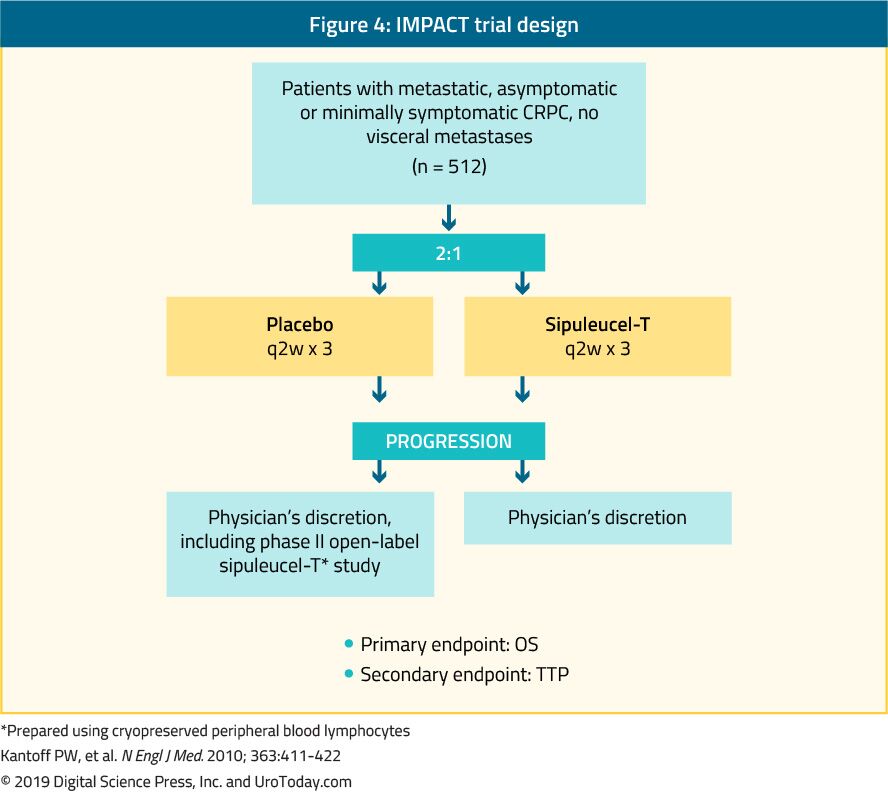
Figure 4. Conception de l’essai IMPACT
Conclusions
Au cours des 15 dernières années, il y a eu des progrès scientifiques considérables et des investissements considérables dans le développement de médicaments pour les patients atteints de mCRPC. Cela a abouti à l’approbation par la FDA de plusieurs lignes de thérapies systémiques en raison de la palliation de la douleur, de la minimisation des effets indésirables de la maladie et de la prolongation de l’OS. À ce jour, l’impact rapporté sur l’OS chez les patients atteints de mCRPC de chacun de ces agents individuels est encore modeste, ce qui entraîne un ajout de seulement quelques mois. Il est nécessaire d’améliorer notre compréhension de la biologie de la maladie de la mCRPC, d’intégrer une compréhension moléculaire complète de la résistance à la castration et d’analyser les mécanismes de résistance aux thérapies actuelles pour améliorer le développement futur du traitement. Il est également crucial d’investir et de développer des biomarqueurs prédictifs pour aider à la personnalisation de la thérapie. Enfin, sur une note plus pratique, davantage de données sont nécessaires sur les thérapies appropriées de deuxième et de troisième intention, ainsi que sur le séquençage et la combinaison des médicaments disponibles, discutés plus en détail dans le prochain article de revue (« Au-delà du traitement de première intention du cancer de la prostate résistant à la castrate métastatique”).
Date de publication : 19 novembre 2019
Leave a Reply