Servier-Phlébolymphologie
Télécharger ce numéro Retour au résumé
des membres inférieurs:
mise à jour et recommandations actuelles
Bourgoin-Jallieu, France
Résumé
Initialement, la thrombose veineuse superficielle (SVT) était considérée comme une maladie bénigne ou une complication fréquente de la maladie. varices. Des études récentes ont montré la gravité potentielle de la SVT et défini sa place dans les maladies thromboemboliques veineuses (TEV), ainsi que la thrombose veineuse profonde (TVP) et l’embolie pulmonaire (EP). Une TVP concomitante a été identifiée chez 25% à 30% des patients lors de la présentation et une EP chez 4% à 7% des patients. Des TEV subséquentes ont été rapportées chez 3 à 20 % des patients, selon la durée du suivi. Jusqu’à récemment, de nombreuses stratégies anticoagulantes ont été testées, sans bénéfice clinique clairement démontré. Cependant, la récente étude CALISTO (Comparaison d’Arixtra dans la thrombose veineuse superficielle des membres inférieurs avec un placebo) a validé un protocole de traitement anticoagulant basé sur le fondaparinux, 2,5 mg par jour pendant 45 jours, aboutissant à des recommandations actualisées pour la prise en charge de la SVT. Cet article présentera une mise à jour sur la prise en charge de la SVT inférieure de la jambe et les recommandations et directives actuelles. En bref, tous les patients atteints de SVT doivent subir un scan duplex bilatéral pour confirmer le diagnostic de SVT, déterminer l’emplacement et l’étendue précis de la SVT et diagnostiquer ou exclure la présence d’une TVP. Pour les patients présentant une SVT symptomatique d’au moins 5 cm de longueur, il est recommandé de prescrire une dose prophylactique de fondaparinux ou d’héparine de faible poids moléculaire pendant 45 jours sans anticoagulation (grade 2B), et lorsque le coût du traitement par fondaparinux est acceptable, il est recommandé d’utiliser le fondaparinux 2,5 mg par jour par rapport à l’héparine de faible poids moléculaire (grade 2C). Cependant, les recommandations et les lignes directrices ont attribué à ces traitements un grade faible, et des questions subsistent sur la gestion de la SVT. Certains facteurs de risque de développer ultérieurement une TEV ont été identifiés, mais des recherches supplémentaires sont nécessaires pour définir des sous-groupes de patients présentant une incidence plus élevée d’une TEV après une TEV.
Introduction
La thrombose veineuse superficielle (TEV) a été considérée comme une maladie bénigne ou une complication fréquente des varices; cependant, des études récentes ont montré leur gravité potentielle et défini leur place dans les maladies thromboemboliques veineuses (TEV), ainsi que la thrombose veineuse profonde (TVP) et l’embolie pulmonaire (EP).
La thérapie anticoagulante est largement utilisée aujourd’hui à la place des anti-inflammatoires non stéroïdiens (AINS), qui étaient couramment utilisés jusqu’à la dernière décennie. Une étude récente a, pour la première fois, validé un protocole thérapeutique.1 Cependant, des questions demeurent concernant la prise en charge de la SVT: (i) un traitement anticoagulant est-il nécessaire pour traiter tous les patients atteints de SVT des membres inférieurs?; ii) faut-il utiliser des doses prophylactiques ou thérapeutiques?; (iii) quelle est la durée de traitement recommandée?; (iv) la prise en charge devrait-elle être la même pour la SVT survenant dans les varices et les veines non variqueuses?; (v) les facteurs de risque de complications de la TEV après la TEV peuvent-ils être prédits?; et (vi) la chirurgie est-elle toujours indiquée pour la prise en charge d’une SVT aiguë?
Cet article présentera la justification de la mise à jour de la gestion des SVT des jambes et les recommandations et directives actuelles.
Incidence de la thrombose veineuse superficielle des membres inférieurs
La SVT est considérée comme une maladie courante, mais l’incidence réelle dans la population adulte reste inconnue. Une étude récente, menée en France,2 a montré que le taux de diagnostic annuel était de 0,6%. Il était plus élevé chez les femmes et augmentait avec l’âge, quel que soit le sexe. Étonnamment, le taux de diagnostic annuel de TVS était plus faible que prévu et inférieur au taux de diagnostic annuel de TVP (environ la moitié de celui de la TVP). Selon une autre étude française, menée avec des méthodes comparables, l’incidence annuelle d’une TVP et d’une EP des membres inférieurs était respectivement de 1,24% et de 0,6%.3
Thrombose veineuse superficielle avec thrombose veineuse profonde concomitante à la présentation
Les études POST (Prospective Observational Superficial Thrombophlébitis) et OPTIMEV (OPTimisation de l’Interverrogatoire dans l’évaluation du risque throMbo-Embolique Veineux), deux grandes études observationnelles et épidémiologiques, ont récemment publié des données essentielles sur la SVT.4,5 Un total de 844 patients atteints de SVT des jambes ont été analysés dans l’étude post4 et une TVP ou une EP a été identifiée chez 25% des patients atteints de SVT lors de la présentation et une TVP proximale a été diagnostiquée chez 9,7% des patients. Il faut souligner que la TVP n’était pas contiguë à la TVP chez 41,9% des patients atteints de TVP. Un total de 788 patients atteints de TVP ont été inclus dans l’étude OPTMEV5, où une TVP était associée à une TVP à l’inclusion chez 29% des patients, une TVP distale survenant chez 59,5% de ces patients (128/215; l’emplacement exact de la TVP manquait chez 12 patients).
Ces données confirment des études antérieures montrant que la TVP était associée à la TVV chez 23% à 36 % des patients et montrent une cohérence entre les différentes études (tableau I).2,4-10
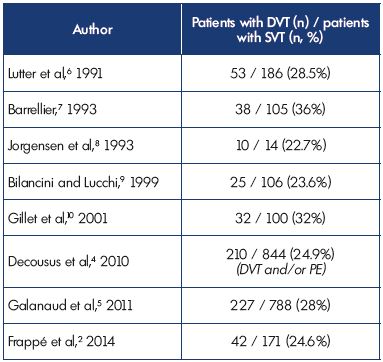
Tableau I. Thrombose veineuse superficielle avec thrombose veineuse profonde concomitante à la présentation.
Abréviations: TVP, thrombose veineuse profonde; EP, embolie pulmonaire; SVT, thrombose veineuse superficielle.
Thrombose veineuse superficielle associée à une embolie pulmonaire à la présentation
À l’inclusion, une EP symptomatique a été diagnostiquée chez 3,9% et 6.9% des patients dans les études POST et OPTIMEV, respectivement. Cependant, la TVV avec EP, mais sans TVP, ne représentait que 2,2% de toutes les TVV avec TVP ou EP. Ces données corroborent les résultats d’études antérieures (tableau II).2,4- 7,9,10
En pratique, un examen recto-verso est obligatoire chez les patients atteints de TVP pour confirmer le diagnostic (figure 1), déterminer l’emplacement et l’étendue précis de la TVP et diagnostiquer ou exclure la présence d’une TVP.
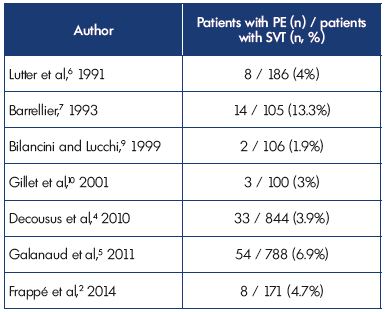
Tableau II. Thrombose veineuse superficielle avec embolie pulmonaire concomitante à la présentation.
Abréviations: EP, embolie pulmonaire; SVT, thrombose veineuse superficielle.
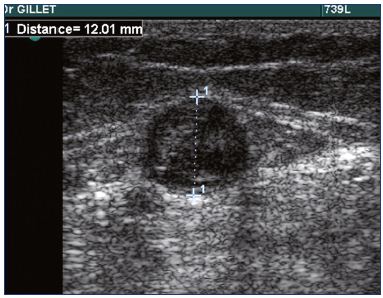
Figure 1. Échographie de la thrombose de la petite veine saphène.

Résultat et récidive thromboembolique veineuse
Dans la littérature, le taux de récidive thromboembolique varie de 3% à 20% selon la durée du suivi. Dans une étude personnelle, 13 nous avons signalé la survenue d’ETV symptomatiques chez 16,4% des patients présentant une TEV isolée, avec un suivi moyen de 14,5 mois. Les événements d’ETV comprenaient la TVP (31 %), l’EP (6 %), une autre TVS dans un système saphène différent (37,5 %) et une TVS récurrente dans le même système saphène (25 %).
Dans la suite de l’étude, 4 8.3% des patients présentant une TEV isolée à l’inclusion ont développé au moins 1 événement symptomatique d’ETV à 3 mois (TVP symptomatique, 2,8%; EP symptomatique, 0,5%; extension symptomatique de la TEV, 3,3%; et récidive symptomatique de la TEV, 1,9 %). Dans l’étude OPTIMEV, 5 à 3% des patients présentant une TEV isolée et 5,4% des patients présentant une TEV associée à une TVP lors de la présentation ont développé une TEV à 3 mois; le taux d’TEV était de 12,5% au suivi de 3 ans. Dans l’étude menée par Dewar et Panther14, une TVP symptomatique est survenue chez 4% des patients présentant une TVP isolée à un suivi de 6 mois.
Ces résultats épidémiologiques montrent la gravité potentielle de la SVT. Ils ne devraient plus être considérés comme une affection bénigne. Par conséquent, leur place est désormais clairement définie au sein des maladies TEV.
Facteurs de risque de développer un événement thromboembolique
Une analyse multivariée de l’étude post4 a identifié le sexe masculin, des antécédents de TVP ou d’EP, un cancer antérieur et l’absence de varices comme facteurs de risque d’une TEV symptomatique à 3 mois, y compris une récidive ou une extension de la TVV. Dans l’étude STENOX (thrombophlébite superficielle traitée par l’énoxaparine), 15 antécédents d’ETV (TVP ou EP), de sexe masculin et d’insuffisance veineuse chronique sévère ont été identifiés comme facteurs prédictifs indépendants d’une ETV à 3 mois. Seule l’insuffisance veineuse chronique sévère était un facteur prédictif indépendant de la TVP ou de l’EP. Dans une analyse groupée des études POST et OPTIMEV16, Galanaud et al ont montré que le sexe masculin, le cancer, les antécédents personnels d’ETV et l’atteinte saphénofémorale ou saphénopoplitée augmentaient de manière significative le risque d’une ETV ultérieure ou d’une TVP / EP dans une analyse univariée. Dans les analyses multivariées, seul le sexe masculin augmentait significativement le risque d’une TEV ou d’une récidive de TVP/ EP. Pour le cancer et les antécédents personnels d’ETV, les rapports de risque ajustés n’étaient que légèrement inférieurs au niveau de signification statistique (P = 0,06 pour les deux), ce qui suggère que, pour ces facteurs, l’étude manquait simplement de puissance statistique suffisante.
Dans l’étude STEVLUX (Thromboembolie superficielle FLUXum)17, un indice de masse corporelle (IMC) compris entre 25 et 30 kg/m2 et un composite d’une précédente TEV et/ou d’une TEV et/ou d’antécédents familiaux d’TEV ont été identifiés comme des facteurs de risque indépendants significatifs d’un événement d’TEV (composite de TVP symptomatique et asymptomatique, d’EP et de récurrence ou d’extension de la TEV).
État de la veine
Il a été rapporté que l’état de la veine variqueuse influence le risque de présenter une TVP lors de la présentation. Dans les études POST4 et OPTIMEV, les SVT 5 survenant dans une veine non variqueuse (NVV-SVT) étaient plus souvent associées à une TVP ou une EP concomitante que les SVT survenant dans une veine variqueuse (VV-SVT). Des résultats similaires ont été rapportés par Gorty et al.18
Lors du suivi de 3 mois dans l’étude OPTIMEV, le NVV-SVT isolé n’était pas associé à un risque plus élevé de résultats indésirables (décès, récidive de TEV et saignement). Le NVV-SVT isolé présentait une association plus élevée avec une récurrence symptomatique de la TVP ou de l’EP (2,7% vs 0,6%), mais ce résultat n’atteignait pas de signification statistique (P = 0,07).
Dans l’étude postérieure, l’absence de varices a été identifiée comme facteur de risque de développement ultérieur d’une TEV symptomatique chez les patients présentant une TEV symptomatique isolée à la présentation (P = 0,049). Dans l’étude STEVLUX 17, l’absence de varices était un facteur de risque d’ETV (P = 0,004) après l’arrêt du traitement par l’héparine de faible poids moléculaire.
Dans le groupe placebo de l’étude CALISTO (Comparaison d’Arixtra dans la thrombose veineuse superficielle des membres inférieurs avec le placebo), 1 des complications thromboemboliques sont survenues plus souvent lorsque la SVT impliquait la grande veine saphène (GSV), était étendue à moins de 10 cm de la jonction saphénofémorale (SFJ), impliquait des veines au-dessus du genou et chez des patients ayant des antécédents d’ETV.
La stase veineuse est le principal mécanisme de la SVT chez les patients atteints de varices. L’inflammation peut jouer un rôle essentiel dans la formation de thrombus chez les patients sans varices; ainsi, conférant un risque plus élevé de thromboembolie plus grave sur le plan clinique. Le dépistage de la thrombophilie n’est pas recommandé pour la prise en charge de routine des patients atteints de NVV-SVT, bien que les données de la littérature aient montré que la thrombophilie était fréquente dans cette situation. Dans une étude prospective personnelle, 10 nous avons identifié une thrombophilie chez 50% des patients atteints de NVV-SVT, alors que seulement 15% des patients atteints de VV-SVT présentaient une thrombophilie. Dans une autre étude prospective portant sur 42 patients atteints de NVV-SVT, 19 nous avons identifié une thrombophilie chez 20 patients (47,6%). La thrombophilie la plus fréquente était due à la mutation du facteur hétérozygote V Leiden. Dans une étude portant sur 63 patients atteints de NVV-SVT isolée, 20 Martinelli et al ont identifié une thrombophilie chez 30% des patients. Le dépistage de la thrombophilie est conseillé, après exclusion d’un cancer occulte, en particulier chez les patients présentant une progression du thrombus malgré un traitement anticoagulant approprié.11,21
Traitement de la thrombose veineuse superficielle
Le traitement de la TVS a toujours été un sujet controversé. De grandes variations dans le traitement sont rapportées, en particulier en ce qui concerne le traitement anticoagulant. L’étude POST4, réalisée en France entre mars 2005 et octobre 2006, a fourni des informations intéressantes sur le traitement de la SVT. Un total de 634 patients avaient une SVT isolée à l’inclusion. Des informations sur le traitement qu’ils ont reçu pendant la période d’observation de 3 mois étaient disponibles pour 597 patients, 90,5% des patients ayant reçu un ou plusieurs anticoagulants. Parmi les patients recevant un traitement anticoagulant, 63% ont reçu des doses thérapeutiques, 36,7% des doses prophylactiques et 16,8% des antagonistes de la vitamine K. La durée du traitement était très variable. Un total de 47.2% des patients ont reçu un AINS topique, 8,2% un AINS oral et 10% ont subi une chirurgie veineuse (décapage ou ligature élevée).
Ces données ont montré la nécessité de clarifier le rôle de la thérapie anticoagulante dans la prise en charge de la SVT. L’utilisation d’un traitement anticoagulant chez des patients présentant une TVS a été signalée pour la première fois en 1962 par Zollinger et al.22 après avoir observé la survenue d’une EP, qui a été fatale chez 34 (10,1%) d’une série de 335 patients atteints d’une TVS. Jusqu’à récemment, bien que de nombreuses stratégies anticoagulantes aient été testées, y compris l’héparine non fractionnée ou l’héparine de bas poids moléculaire, à des doses prophylactiques ou thérapeutiques pendant diverses durées, aucune n’avait clairement démontré de bénéfice clinique.
L’étude STENOX23 était un essai randomisé en double aveugle impliquant 427 patients, comparant l’héparine de faible poids moléculaire (énoxaparine à des doses thérapeutiques et prophylactiques) avec les AINS et le placebo. Les patients ont été traités pendant 10 jours, avec un suivi de 3 mois. À 10 jours, il y avait plus d’ETV dans le groupe placebo (P24 a comparé les doses thérapeutiques et prophylactiques de nodraparine chez 163 patients présentant une TV isolée dans le GSV, et les patients ont été traités pendant 1 mois. Au suivi de 3 mois, les résultats étaient similaires dans les deux groupes (7,2% et 8,6% de survenue d’une TEV, respectivement; P = 0,7), ne montrant aucun bénéfice de la posologie thérapeutique. Un phénomène de « rattrapage” ou de rebond a été observé au cours du suivi, car de nombreux ETV ont été rapportés, en particulier dans le groupe de patients traités avec la posologie thérapeutique. Un phénomène de « rattrapage” a également été observé après l’arrêt du traitement à l’héparine de bas poids moléculaire après 1 mois dans l’étude STEVLUX.25 Ces résultats, comme ceux de l’essai STENOX, plaident pour le choix de doses prophylactiques d’héparine de faible poids moléculaire dans la TV. La survenue de la majorité des ETV au cours des 2 et 3 mois suivant l’arrêt du traitement par de l’héparine de faible poids moléculaire dans le groupe recevant des doses thérapeutiques met à nouveau en évidence la question de la durée optimale du traitement anticoagulant.
L’étude CALISTO randomisée en double insu1 a comparé le fondaparinux à 2,5 mg par jour pendant 45 jours avec le placebo chez 3002 patients présentant une SVT du membre inférieur symptomatique isolée d’une longueur d’au moins 5 cm. Les principaux critères d’exclusion étaient le traitement du cancer au cours des 6 mois précédents, la TVP ou l’EP au cours des 6 mois précédents, la SVT située à moins de 3 cm du SFJ et l’insuffisance rénale sévère (clairance de la créatinine 26 la dose de 2,5 mg de fondaparinux a été sélectionnée sur l’idée qu’une dose prophylactique serait suffisante pour traiter les patients atteints de SVT. De plus, cette dose s’est avérée plus efficace pour prévenir les ETV après une chirurgie orthopédique majeure qu’une dose prophylactique d’héparine de bas poids moléculaire, et aussi efficace que la dose thérapeutique d’héparine de bas poids moléculaire chez les patients atteints de syndromes coronariens aigus, ce qui suggère que 2,5 mg de fondaparinux correspondraient aux recommandations de 2008 de l’American College of Chest Physicians (ACCP)27 qui préconisent l’utilisation de doses prophylactiques ou intermédiaires d’héparine de bas poids moléculaire pour traiter les patients atteints de SVT. La durée de 45 jours a été choisie parce qu’une période de traitement de 30 jours ou moins pourrait être trop courte, car la plupart des ETV symptomatiques surviennent après l’arrêt du traitement. Le principal résultat d’efficacité était un composite de décès de toute cause, d’une EP symptomatique, d’une TVP symptomatique, d’une extension symptomatique de la SFJ ou d’une récidive symptomatique de la TVS au jour 47. Il y avait une période de suivi de 77 jours pour les patients.
Le principal résultat d’efficacité est survenu chez 0,9 % des patients du groupe fondaparinux et 5.9% dans le groupe placebo (P28 
Il est intéressant de noter le changement des recommandations par rapport aux lignes directrices ACCP 2008.27 Cependant, il faut tenir compte du fait qu’il s’agit de recommandations de faible grade (grade 2B ou 2C).
Dans la mise à jour de la Revue systématique de la base de données Cochrane sur le « Traitement de la thrombophlébite superficielle de la jambe”, 29,30 Di Nisio et al sont parvenus aux mêmes conclusions. Cette revue était basée sur l’analyse de 30 essais contrôlés randomisés impliquant 6507 participants atteints de SVT des jambes. Les auteurs concluent qu’une dose prophylactique de fondaparinux, administrée pendant 6 semaines, semble être une option thérapeutique valable pour la TV des jambes. Les preuves sur les traitements oraux, les traitements topiques ou la chirurgie sont trop limitées et ne fournissent pas d’informations pour une utilisation en pratique clinique sur les effets de ces traitements en termes de progression de la TEV et de la TEV.
Chirurgie par rapport au traitement anticoagulant
Une revue des études comparant la chirurgie au traitement anticoagulant ne montre aucun bénéfice pour le traitement chirurgical. Les taux de progression de la SVT étaient similaires tandis que l’incidence de la TEV et des complications étaient plus élevées avec la chirurgie.31 Lozano et al n’ont montré aucune différence entre la chirurgie et l’énoxaparine pendant 4 semaines.32 
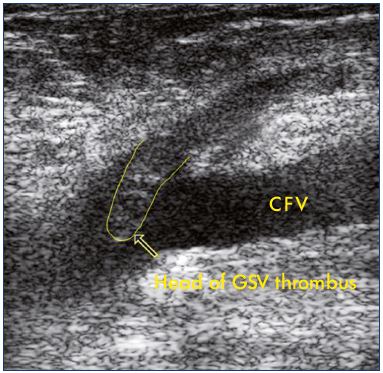
Figure 2. Échographie d’une extension d’une thrombose de la
grande veine saphène dans la veine fémorale commune.
Abréviations: CFV, veine fémorale commune; GSV, grande veine saphène
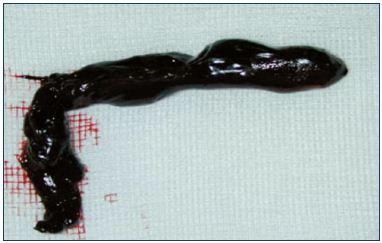
Figure 3. Thrombose de la jonction saphénofémorale.
Image reproduite avec l’aimable autorisation du Dr Nicolini.

En pratique, la plupart des experts recommandent de traiter les patients atteints de SVT prolongée à la SFJ ou à la SPJ avec un traitement anticoagulant à des doses thérapeutiques pendant 3 mois.
Conclusion
La TV ne doit plus être considérée comme une maladie bénigne. Des études épidémiologiques récentes, qui ont inclus un grand nombre de patients, ont montré la gravité potentielle des SVT et ont clairement défini leur place dans les maladies TEV. Une TVP concomitante a été identifiée chez 25% à 30% des patients lors de la présentation et une EP chez 4% à 7% des patients. Par conséquent, tous les patients atteints de TVS doivent subir une analyse recto-verso bilatérale pour confirmer le diagnostic de TVS, déterminer l’emplacement et l’étendue précis de la TVS et diagnostiquer ou exclure la présence d’une TVP. Aujourd’hui, la prise en charge de la SVT a changé, la thérapie anticoagulante étant largement utilisée à la place des AINS. Jusqu’à la récente étude CALISTO, aucun protocole anticoagulant n’avait démontré un bénéfice clinique clair. Les recommandations ont été mises à jour après que l’étude CALISTO a validé le protocole de thérapie anticoagulante basé sur le fondaparinux 2,5 mg par jour pendant 45 jours. Pour les patients présentant une SVT symptomatique des jambes d’au moins 5 cm de longueur, une dose prophylactique de fondaparinux ou d’héparine de bas poids moléculaire pendant 45 jours est recommandée sans anticoagulation (grade 2B). Lorsque le coût du traitement par fondaparinux est acceptable, il est recommandé d’utiliser le fondaparinux à raison de 2,5 mg par jour sur une dose prophylactique d’héparine de faible poids moléculaire (grade 2C). Cependant, les recommandations et les lignes directrices sont de faible qualité et des questions subsistent concernant la gestion des SVT. Certains facteurs de risque de développer ultérieurement une TEV ont été identifiés, mais d’autres recherches sont nécessaires pour définir clairement les sous-groupes de patients présentant une incidence plus élevée d’TEV après une TEV.
1. D ecousus H, Prandoni P, Mismetti P, et al; Groupe d’étude CALISTO. Fondaparinux pour le traitement de la thrombose veineuse superficielle dans les jambes. En anglais J Med. 2010;363:1222-1232.
2. Frappé P, Buchmuller-Cordier A, Bertoletti L, et al; STEPH Study Group. Taux annuel de diagnostic de thrombose veineuse superficielle des membres inférieurs: l’étude communautaire STEPH. J Thrombus Haemost. 2014;12:831-838.
3. Oger E; Groupe d’étude EPI-GETBO. Incidence de la thromboembolie veineuse : une étude communautaire dans l’Ouest de la France. Thrombus Haemost. 2000;83:657- 660.
4. D ecousus H, Quéré I, Presles E, et al; Groupe d’étude POST. Thrombose veineuse superficielle et thromboembolie veineuse: une vaste étude épidémiologique prospective. Ann Stagiaire Med. 2010;152:218-224.
5. G alanaud JP, Genty C, Sevestre MA, et al; Chercheurs OPTIMEV SFMV. Facteurs prédictifs de thrombose profonde concomitante et de récidive thromboembolique veineuse symptomatique en cas de thrombose veineuse superficielle. Thrombus Haemost. 2011;105:31-39.
6. Lutte KS, Kerr TM, Roedersheimer R, Lohr JM, Sampson MG, Cranley JJ. thrombophlébite superficielle diagnostiquée par balayage duplex. Chirurgie. 1991;100:42-46.
7. MONT Barrellier. Thromboses veineuses superficielles des membres inférieurs. Vasc Int réel. 1993;17:7-9.
8. Jorgensen JO, Hanel KC, Mogan AM, Hunt JM. L’incidence de la thrombose veineuse profonde chez les patients atteints de thrombophlébite superficielle des membres inférieurs. J Vasc Surg. 1993; 18:70-73.
9. Bilancini S, Lucchi M. Les thromboses veineuses superficielles sont-elles polymorphes ? Phlébologie. 1999;52:41-43.
10. G illet JL, Perrin M, Cayman R. Thrombose veineuse superficielle des membres inférieurs: analyse prospective chez 100 patients. J Mal Vasc. 2001;26:16-22.
11. Kalodiki E, Stvrtinova V, Allegra C, et al. Thrombose veineuse superficielle: une déclaration de consensus. Int Angiol. 2012;31:203-216.
12. Nicolaides A. Thrombose veineuse superficielle dans la prévention et le traitement de la thromboembolie veineuse. Int Angiol. 2013;32:237-242.
13. G illet JL, Perrin M, Cayman R. Récidive thromboembolique après thrombophlébite superficielle des membres inférieurs. J Phlébologie. 2002;2:103-118.
14. D ewar C, Panther S. Incidence de la thrombose veineuse profonde chez les patients ayant reçu un diagnostic de thrombophlébite superficielle après s’être présentés à un service de thrombose veineuse profonde ambulatoire du service des urgences. Emerg Med J. 2010; 27:758-761.
15. Quenet S, Laporte S, Décousus H, Leizorovicz A, Epinat M, Mismetti P; Groupe STENOX. Facteurs prédictifs des complications thrombotiques veineuses chez les patients présentant une thrombose veineuse superficielle isolée. J Vasc Surg. 2003; 38:944-949.
16. G alanaud JP, Bosson JL, Genty C, et al. Thrombose veineuse superficielle et thromboembolie veineuse récurrente: analyse groupée de deux études observationnelles. J Thrombus Haemost. 2012;10:1004-1011.
17. Cosmi B, Filippini M, Campana F, et al; Enquêteurs de STEVLUX. Facteurs de risque d’événements récurrents chez les sujets présentant une thrombose veineuse superficielle dans l’essai clinique randomisé SteVlux (Thromboembolie superficielle Fluxum). Thrombb Res. 2014; 133: 196-202.
18. G orty S, Patton-Adkins J, DaLanno M, Starr J, Dean S, Satiani B. Thrombose veineuse superficielle des membres inférieurs: analyse des facteurs de risque, récurrence et rôle de l’anticoagulation. Vasc Med. 2004;9:1-6.
19. G illet JL, Allaert FA, Perrin M. thrombophlébite superficielle dans les veines non variqueuses des membres inférieurs. Une analyse prospective chez 42 patients. J Mal Vasc. 2004;29:263-272.
20. Martinelli I, Cattaneo M, Taioli E, de Stefano V, Chiusolo P, Mannucci PM. Facteurs de risque génétiques de thrombose veineuse superficielle. Thrombus Haemost. 1999;82:1215-1217.
21. Milio G, Siragusa S, Malato A, Grimaudo S, Pinto A. Thrombose veineuse superficielle: rôle de la carence héréditaire en anticoagulants naturels en extension aux veines profondes. Int Angiol. 2009;28:298- 302.
22. Zollinger RW, Williams RD, Briggs DO. Problèmes dans le diagnostic et le traitement de la thrombophlébite. Arch Surg. 1962; 85:34-40.
23. D ecousus H; Groupe d’étude sur l’énoxaparine. Comparaison randomisée pilote en double aveugle d’une héparine de faible poids moléculaire, d’un agent anti-inflammatoire non stéroïdien et d’un placebo dans le traitement de la thrombose veineuse superficielle. Arch Int Med. 2003;163:1657-1663.
24. Prandoni P, Tormene D, Pesavento R; Groupe d’enquêteurs Vesalio. Doses élevées vs faibles d’héparine de faible poids moléculaire pour le traitement de la thrombose veineuse superficielle des jambes: un essai randomisé en double aveugle. J Thrombus Haemost. 2005;3:1152-1157.
25. Cosmi B, Filippini M, Tonti D, Avruscio G, Ghirarduzzi A, Bucherini E; Enquêteurs de STEVLUX. Une étude randomisée en double aveugle de l’héparine de bas poids moléculaire (parnaparine) pour la thrombose veineuse superficielle: STEVLUX (thromboembolie superficielle et Fluxum). J Thrombus Haemost. 2012;10:1026-1035.
26. D ecousus H, Frappé P, Accassat S, et al. Épidémiologie, diagnostic, traitement et prise en charge de la thrombose veineuse superficielle des jambes. Meilleur Pract Res Clin Haematol. 2012;25:275-284.
27. Kearon C, Kahn SR, Agnelli G, Goldhaber S, Raskob GE, Comerota AJ; Collège américain des médecins Thoraciques. Thérapie antithrombotique pour la maladie thromboembolique veineuse: Directives de pratique clinique fondées sur des preuves du Collège Américain des Médecins thoraciques (8e Édition). Poitrine. 2008; 133 (suppl 6): 454S-545S.
28. Kearon C, Akl EA, Comerota AJ, et al; Collège américain des médecins thoraciques. Thérapie antithrombotique pour la maladie TEV: Thérapie antithrombotique et Prévention de la thrombose, 9e éd.: Directives de pratique clinique fondées sur des données probantes de l’American College of Chest Physicians. Poitrine. 2012; 141 (complément 2) : e419S-e494S.
29. D i Nisio M, Wichers IM, Middeldorp S. Traitement de la thrombophlébite superficielle de la jambe. Base de données Cochrane Syst Rév. 2013; 30; 4: CD004982.
30. D i Nisio M, Middeldorp S. Traitement de la thrombophlébite superficielle des membres inférieurs. JAMA. 2014;311:729- 730.
31. Sullivan V, Denk PM, Sonnad SS, Eagleton MJ, Wakefield TW. Ligature contre anticoagulation: traitement de la thrombophlébite superficielle au-dessus du genou n’impliquant pas le système veineux profond. J Am Coll Surg. 2001; 193:556-562.
32. Lozano FS, Almazan A. Héparine de faible poids moléculaire contre déconnexion saphénofémorale pour le traitement de la thrombophlébite saphène supérieure au-dessus du genou: une étude prospective. Chirurgie endovasculaire Vasc. 2003; 37:415-420.
33. Chengelis DL, Bendick PJ, Glover JL, Brown OW, Ranval TJ. Progression de la thrombose veineuse superficielle à la thrombose veineuse profonde. J Vasc Surg. 1996; 24:745-749.
34. Hingorani A, Ascher E. thrombophlébite veineuse superficielle. Dans: Gloviczki P, éd. Manuel des troubles veineux. Directives du Forum veineux américain. 3e éd. Londres, Royaume-Uni: Hodder Arnold; 2009: 314-319.
Leave a Reply