Quel Est L’Élément Le Plus Réactif Du Tableau Périodique ?
Le fluor est identifié comme l’élément non métallique le plus réactif et le plus électronégatif du tableau périodique, ce qui en fait l’agent oxydant le plus puissant. Le césium est le métal le plus réactif du tableau périodique, à tel point que le travail avec ce métal se termine souvent par des explosions!
Qu’a dit un chimiste à un autre lorsqu’il l’a trouvé lésé? « Pourquoi êtes-vous en détresse sodique? Je pense que tu réagis trop ! » Tu vois ce que j’ai fait là-bas ? Parfois, je me demande pourquoi – malgré mon hilarité – j’ai vraiment du mal à me faire des amis
De toute façon, à part mes mauvaises notes, la première chose qui me vient à l’esprit quand je pense à la chimie, ce sont des blouses de laboratoire, des vaisseaux aux formes étranges, comme des reflets de miroirs de carnaval, et des explosions flamboyantes. De temps en temps, quelqu’un marmonne « réaction” ou « réactivité”, des termes si omniprésents que vous les trouverez infiltrant les livres de chimie jusqu’à leur toute dernière page. C’est exactement ce qui nous préoccupe en ce moment.

Dépourvue de tout jargon technique, une « réaction » est exactement ce qu’elle signifie, une réponse. La réactivité, d’autre part, peut être définie comme la mesure de la facilité avec laquelle une espèce chimique participera à une réaction et formera des liaisons chimiques. Alors, la question devient – quel élément est le plus facile à inciter? Mais d’abord…
Qu’est-ce qui détermine la réactivité d’un élément?
En termes simples, une réaction chimique est l’occasion idéale pour les acheteurs et les vendeurs d’acheter et de vendre des marchandises. Les acheteurs et les vendeurs sont des éléments chimiques. Les marchandises sont des électrons et la monnaie échangée est de l’énergie.
Le but de ce métier est d’atteindre la stabilité, une configuration optimale des électrons, qui est obtenue lorsque l’enveloppe de valence (la plus externe) d’un élément est complètement remplie ou vidée. Fondamentalement, un élément peut acheter plus d’électrons pour remplir son avant-dernière coque ou les vendre pour le vider.

Moins il y a d’électrons impliqués, moins la dépense énergétique est importante. Quiconque connaît le fonctionnement parcimonieux de la nature devinera que les métiers nécessitant le moins d’énergie sont ceux qui sont les plus susceptibles de se produire. Cela a du sens, car un élément préférerait perdre des électrons et se rendre vide si son enveloppe la plus externe est moins à moitié remplie, ou en gagner pour se remplir, s’il est plus à moitié rempli. En acheter six alors que vous pouvez simplement en perdre deux serait carrément stupide, mais plus important encore, cher!
Ainsi, la réactivité est fonction de la facilité avec laquelle un élément perd ou gagne des électrons.
Comment estimer les incitations d’un élément ?
Le tableau périodique et ses « tendances »
Comment savoir si un élément est un acheteur ou un vendeur? Nous nous référons au tableau périodique.
Le tableau périodique rappelle que les scientifiques sont à la limite du TOC et ne peuvent s’empêcher de tout organiser de manière extrêmement soignée et ordonnée. Le tableau périodique organise chaque élément que nous connaissons de manière colocalisée.
La table organise les éléments en fonction de leur numéro atomique, qui est le même que le nombre de protons ou d’électrons qu’ils englobent. (N’est-ce pas bizarre qu’ils aient tendance à être exactement les mêmes?)
Tendance 1
Le nombre d’électrons dans la coquille de valence augmente d’un à mesure que nous analysons chaque élément d’affilée, bien que le nombre de coquilles reste le même. Le nombre de coquilles peut être déduit du numéro de ligne. Par exemple, chaque élément de la deuxième ligne ne contiendra que deux coquilles, etc.
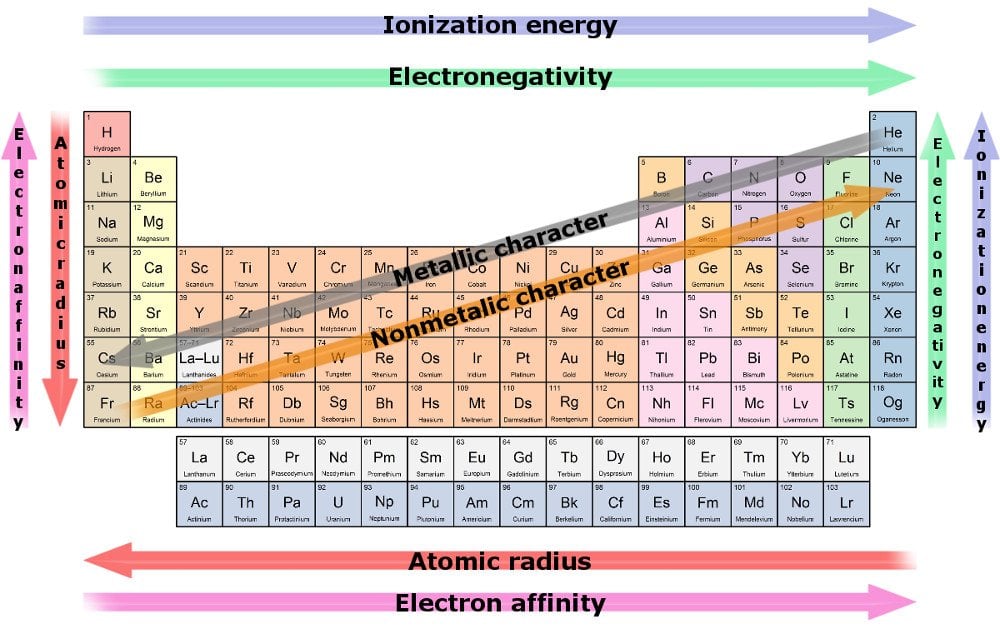
Une conséquence de cette tendance est que le rayon atomique diminue à mesure que nous nous rapprochons du dernier résident d’une ligne. La raison en est que l’augmentation des électrons est reflétée par l’augmentation des protons au centre, alors que les premiers doivent s’entasser dans la même coquille. Dans la guerre à la traction entre les protons qui tirent et les électrons qui incrémentent, le premier gagne, ce qui entraîne une plus grande attraction nucléaire, rapprochant toutes ses coquilles de lui.
Par conséquent, en raison d’une forte attraction d’attraction, un élément est plus susceptible d’acheter ou de gagner des électrons lorsque nous nous déplaçons le long d’une rangée. La mesure de la capacité d’un élément à tirer des électrons vers lui est connue sous le nom d’électronégativité. L’élément le plus électro-négatif est le plus susceptible de voler des électrons et de réagir le plus rapidement.
Tendance 2
Une autre tendance est l’augmentation du rayon des éléments lorsque nous descendons une colonne, tandis que le nombre d’électrons de valence reste le même, même si le numéro atomique ne cesse d’augmenter. En effet, l’augmentation des électrons est parallèle à une augmentation des coquilles. Les métaux lourds ont un rayon accru, en particulier ceux situés sur le fond le plus profond. Ils illustrent l’attraction nucléaire la plus pauvre et ont par conséquent une mauvaise emprise sur leurs électrons les plus externes.

La mesure de la capacité d’un élément à perdre des électrons est connue sous le nom d’électro-positivité, et elle augmente à mesure que nous descendons d’une colonne. Encore une fois, l’élément le plus électropositif est celui qui est le plus susceptible d’abandonner ses électrons et de réagir le plus rapidement.
Maintenant que nous connaissons les règles, révélons les gagnants.
Le fluor non métallique le plus réactif
Le fluor est le premier élément du groupe des halogènes. C’est un gaz jaune pâle, diatomique, très corrosif, inflammable avec une odeur âcre. Son numéro atomique est 9 et a 7 électrons dans sa coquille de valence. De plus, il réside dans la deuxième rangée, ce qui implique que tous ses 9 électrons sont en quelque sorte entassés dans seulement 2 coquilles.
Une coquille de valence à 7 électrons ne nécessite qu’un seul électron pour compléter sa coquille finale et atteindre la stabilité, ce qui n’est pas un gros exploit si l’on considère sa petite taille et sa traction nucléaire vigoureuse. Le fluor est identifié comme l’élément le plus électronégatif du tableau périodique, ce qui en fait l’agent oxydant le plus puissant. C’est le non-métal le plus réactif.

Le fluor est tellement réactif qu’il peut brûler des substances que l’on pourrait généralement considérer comme ininflammables! Il peut brûler du verre, de l’eau et même du sable! Sa promiscuité rend impossible son stockage ou son isolement dans sa forme la plus pure. En raison de sa réactivité sauvage, son histoire précoce d’isolement et d’expérimentation est remplie d’accidents mortels. Oui fatal fatale.
Métal le plus réactif – le césium
Le césium est un métal de couleur or qui réagit de manière explosive avec l’air et l’eau. Son numéro atomique est 55. Le césium réside dans la première colonne et l’avant-dernière ligne. Comme nous l’avons discuté, le rayon d’un élément si bas dans la colonne est assez grand par rapport aux éléments ci-dessus.

(Crédit photo : Dnn87/Wikimedia Commons)
Le grand rayon rend sa traction nucléaire inefficace et la rend terriblement maladroite. Sa grande taille le rend très sensible à l’ionisation. Il est très acquiescent et abandonne facilement le seul électron dans sa coque de valence pour atteindre la stabilité, ce qui le rend très réactif. Le césium est le métal le plus réactif du tableau périodique, à tel point que le travail avec ce métal se termine souvent par des explosions!
Francium
Le francium est le dernier élément de la première colonne, situé juste sous le césium, ce qui en fait le plus gros atome de la colonne. Logiquement, on en déduit que le Francium doit posséder une réactivité supérieure à celle du césium, mais ce n’est pas le cas.
On estime qu’il n’y en a pas plus d’une once dans la croûte terrestre à la fois. Comme il est si rare naturellement, les scientifiques doivent le produire pour l’étudier.

(Crédit photo : MarlonMarin1/Wikimedia Commons)
Cependant, même lorsqu’il est isolé, il ne dure pas très longtemps. Le francium est de nature radioactive, ayant une demi-vie de seulement 22 minutes, il se désintègre donc avant d’avoir une chance de réagir! De plus, la présence de tant de protons fait que ses électrons se déplacent à des vitesses incroyablement élevées. Comme Einstein l’a réalisé, à des échelles si petites et à des vitesses si élevées, des choses étranges commencent à se produire — les électrons se blottissent un peu plus près du noyau que ce à quoi on pourrait logiquement s’attendre, ce qui les rend légèrement plus difficiles à éliminer.
Il semble donc que le francium soit l’élément le plus réactif, hélas théoriquement.
Alerte spoiler!
Vous avez peut—être remarqué que les deux éléments jugés les plus réactifs ne sont gagnants que dans leurs catégories spécifiques – métaux et non-métaux. Désolé d’être un buzzkill, mais il n’y a pas de réponse définitive à qui-est-l’élément-le-plus-réactif-parmi-tous, car il en faut deux pour danser le tango.
On pourrait se demander quel élément est le plus réactif avec le sodium? La réponse est alors le fluor, pas le césium. Ou, peut-être voulez-vous savoir quel élément est le plus réactif avec l’azote. Son Lithium ! Shocker!
Le terme réactivité est souvent notoirement mal interprété. La question est ambiguë et quelque peu incomplète, comme le montre cet article, espérons-le.
Leave a Reply