Prise en charge des extravasations de chimiothérapie
US Pharm. 2009; 34 (9) (Complément en oncologie): 3-11.
RÉSUMÉ: Les médicaments chimiothérapeutiques intraveineux (IV) peuvent provoquer une lésion par extravasation ou une nécrose tissulaire au site d’administration. Bien que la majorité des extravasations puissent être évitées par une administration de perfusion correcte et complète, plusieurs antidotes ont été reconnus et étudiés pour prévenir d’autres lésions tissulaires.
L’infiltration et l’extravasation sont deux complications bien connues et distinctes du traitement par perfusion intraveineuse. Selon la Société des infirmières en perfusion et la Société des infirmières en oncologie, les deux complications impliquent la fuite accidentelle d’une solution intraveineuse dans les tissus environnants; cependant, le type de solution diffère. L’infiltration est l’administration par inadvertance d’une solution ou d’un médicament non toxique ou irritant dans les tissus environnants.1,2 Les nonvésicants sont des agents qui produisent rarement des réactions aiguës ou détruisent les tissus lorsqu’ils s’infiltrent. Les agents irritants peuvent induire une douleur au site d’injection ou le long de la veine, avec ou sans réaction inflammatoire, généralement sans lésion tissulaire persistante. Cependant, les irritants peuvent provoquer des ulcères des tissus mous uniquement si une grande quantité de solution médicamenteuse concentrée est extravasée par inadvertance pour induire des réactions inflammatoires sans lésion tissulaire persistante.3,4
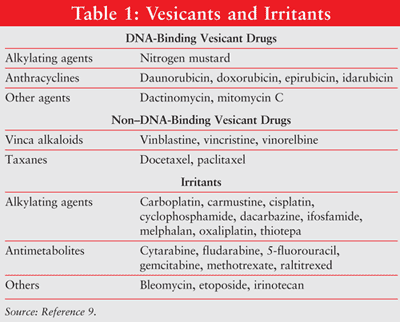
L’extravasation se réfère à l’instillation ou à la fuite par inadvertance de matériel vésicant dans les espaces périvasculaires et sous-cutanés pendant l’administration du médicament.1,2 L’extravasation entraîne des réactions locales allant d’une irritation locale à une nécrose tissulaire sévère de la peau, du système vasculaire environnant et des structures de support.5-8 Les agents chimiothérapeutiques peuvent être classés, en fonction de leur potentiel de causer des lésions tissulaires locales, en tant que vésicants, irritants ou non vésicants. (Plusieurs vésicants et irritants sont décrits dans le TABLEAU 1.9) L’extravasation accidentelle de médicaments intraveineux se produit dans environ 0,1% à 6% des perfusions intraveineuses périphériques et de 0,3 % à 4,7 % des perfusions implantées au port d’accès veineux.10-12
Physiopathologie des lésions tissulaires
L’étendue des lésions tissulaires dépend de la capacité de liaison de l’agent chimiothérapeutique à l’ADN. Les agents de liaison à l’ADN comprennent les anthracyclines, les antibiotiques antitumoraux, les analogues du platine et certains agents alkylants.3,4 Les antinéoplastiques se liant à l’ADN causent des lésions tissulaires en propageant une réticulation létale de l’ADN ou des ruptures de brins causées par des radicaux libres, qui conduisent à l’apoptose cellulaire.13-17 antinéoplastiques non liés à l’ADN (p. ex., alcaloïdes vinca, taxanes, inhibiteurs de la topoisomérase) interfèrent avec la mitose. Les agents non liants à l’ADN sont éliminés plus facilement des sites d’extravasation et causent moins de dommages aux tissus que les agents liants à l’ADN.17
Facteurs de risque d’extravasation
Les risques d’extravasation sont multifactoriels et sont en grande partie modifiables. Beaucoup de ces risques découlent d’erreurs dans l’utilisation et le placement de l’appareil. Les facteurs de dispositif IV qui affectent le risque d’extravasation comprennent le matériau de l’aiguille (c.-à-d. le métal), la taille de la canule (gros plastique vs petit plastique) et le type de cathéter (c.-à-d. le cathéter veineux central). Les aiguilles métalliques peuvent causer plus de dommages lors de l’insertion et sont inflexibles dans le vaisseau, tandis que les aiguilles de gros calibre peuvent entraver la circulation sanguine, ralentissant la dilution de l’infusat.18,19 L’extravasation des CVC peut se produire avec un déplacement de l’aiguille d’un orifice d’accès veineux implanté (IVAP), une occlusion mécanique et des lésions CVC subséquentes, une migration du cathéter ou la formation de manchon de fibrine et une thrombose. Un placement incorrect de l’IVAP est plus susceptible de se produire chez les patients avec de nouveaux dispositifs, ceux avec un gonflement postopératoire important, et les patients obèses ou les femmes à gros seins.20 Les occlusions mécaniques peuvent être dues à la formation d’un thrombus, à un précipité de médicament, à un déplacement rétrograde du cathéter ou à un pincement (c.-à-d. une occlusion intermittente et positionnelle du cathéter; il faut soupçonner que l’occlusion de la perfusion peut être soulagée en demandant au patient de déplacer le positionnement de son bras).2,21,22 L’évitement de l’extravasation dépend fortement du bon entretien du site intraveineux et de la mise en œuvre du taux de perfusion correct. Ces facteurs de risque sont liés aux antinéoplastiques utilisés, aux patients et au clinicien qui administre le médicament.
Prévention
Une surveillance étroite des patients et l’éducation des patients et des praticiens sur les risques et la gestion de l’extravasation vésicante semblent être les pierres angulaires de la prévention. Alors que les médecins ont la responsabilité de rédiger des ordres précis, les infirmières sont responsables de veiller à ce que les appareils soient correctement placés et correctement placés et à ce que les perfusions de chimiothérapie soient surveillées visuellement et au moyen d’entretiens avec les patients. Pendant l’administration de vésicants, le site doit être surveillé pour détecter un gonflement, une rougeur et une douleur. Les vésicants doivent être administrés conformément aux recommandations du fabricant (par exemple, dilution appropriée, temps d’administration spécifié). Les lignes IV doivent être rincées avant et après l’administration de la chimiothérapie. Le rôle du pharmacien serait d’aider à élaborer des politiques qui assureront la vérification, l’étiquetage et la distribution appropriés des agents chimiothérapeutiques. Une façon de procéder consiste à utiliser un étiquetage discriminant lors de la distribution d’antinéoplastiques vésicants afin que les infirmières utilisent les mesures de précaution appropriées. Les pharmaciens peuvent jouer un rôle essentiel dans l’éducation en fournissant des informations sur les médicaments et des services de routine à tous les membres de l’équipe de soins de santé sur l’utilisation et l’administration appropriées des divers agents chimiothérapeutiques. Une approche collaborative multidisciplinaire doit être adoptée afin de garantir la mise en œuvre de pratiques sécuritaires. L’administration de la chimiothérapie chez les patients nécessite une formation appropriée du personnel et une éducation des patients et un soutien administratif par la mise en œuvre de la politique.2,23
Documentation des événements
Chaque incident d’extravasation doit être soigneusement documenté et signalé. La documentation sert à plusieurs fins, notamment fournir un compte rendu précis de ce qui s’est passé, protéger les professionnels de la santé impliqués, recueillir des informations sur les extravasations et mettre en évidence les déficits dans la pratique.23 La documentation et la déclaration aux entités appropriées des effets indésirables des médicaments et des erreurs de médication constituent un autre moyen pour les pharmaciens d’aider à prévenir des événements futurs. Les données recueillies à partir des effets indésirables et des erreurs médicamenteuses rapportés pourraient être utilisées comme outils d’apprentissage pour examiner de manière systémique les moyens par lesquels ces événements se produisent. Les procédures et protocoles locaux sont primordiaux pour la reconnaissance et la gestion opportunes de l’extravasation et la prévention des lésions tissulaires graves. Des efforts de collaboration devraient être déployés pour assurer des tentatives multidisciplinaires en temps opportun pour éduquer tous les membres de l’équipe de soins de santé impliqués dans la prise en charge de ces patients une fois l’événement survenu. Des efforts supplémentaires devraient être déployés pour mettre en place des politiques qui préviendraient de nouveaux événements. Si des politiques sont en place, elles devraient être facilement accessibles et mises à jour régulièrement pour refléter les pratiques actuelles. Les directives d’extravasation 2007 de la Société Européenne de soins infirmiers en oncologie (EONS) fournissent des données et des modèles suggérés qui peuvent être utilisés pour collecter des informations en cas de cas.23
Signes et symptômes d’extravasation
Les signes et symptômes d’extravasation vésicante comprennent un gonflement, une rougeur et / ou une gêne souvent décrits comme des brûlures ou des picotements. Une résistance pendant l’administration du médicament, une perfusion lente ou lente et l’absence ou la perte de retour de sang de la canule intraveineuse, de l’orifice implanté ou d’un autre dispositif d’accès veineux central peuvent indiquer qu’une extravasation vésicante se produit.23 La décoloration et les indurations cutanées peuvent progresser davantage avec l’apparition de cloques ou de nécrose et éventuellement d’ulcérations et de lésions tissulaires profondes. Il peut prendre plusieurs jours pour que l’étendue complète des dommages épithéliaux soit réalisée.
Traitement de l’extravasation induite par la chimiothérapie
Les modalités de traitement utilisées pour la prise en charge de l’extravasation vésicante comprennent l’arrêt immédiat de la chimiothérapie et le refroidissement ou la dilution du site d’extravasation. Pour réduire la morbidité associée à l’extravasation, il est essentiel que les cliniciens soient bien informés des traitements disponibles et travaillent rapidement pour éviter d’autres dommages aux patients. La prise en charge de l’extravasation non médicamenteuse comprend généralement l’élévation du membre et le refroidissement et n’inclut généralement pas l’utilisation d’un traitement pharmacologique.23
Prise en charge initiale de l’extravasation vésicante
La facilité d’intervention précoce peut être facilitée par la mise à disposition d’un kit d’extravasation au sein de l’établissement. La plupart des trousses d’extravasation contiennent des seringues et des canules jetables, des emballages chauds et froids, des tampons de gaze, du plâtre adhésif, des gants stériles et protecteurs et des médicaments pour traiter l’extravasation (par exemple, hyaluronidase, diméthylsulfoxyde 99%, dexrazoxane). Une liste du contenu de la trousse doit être placée dans la trousse et une vérification régulière du contenu du médicament avec des dates de péremption mises à jour doit être tenue régulièrement par un pharmacien.2
Une fois que l’extravasation du vésicant se produit, le clinicien doit immédiatement arrêter la perfusion; cependant, la canule ou l’aiguille à orifice non refermable doivent être maintenues en place et une tentative d’aspiration du vésicant avec une seringue de 10 mL doit être effectuée. La zone d’extravasation doit être marquée et photographiée; ensuite, la canule ou l’aiguille doit être retirée et le médecin doit être informé. Les patients peuvent avoir besoin d’analgésiques pour aider à gérer la douleur qu’ils peuvent ressentir. Une fois que les mesures initiales ont été prises, il est très important de documenter en détail l’effet indésirable du médicament et / ou l’erreur médicamenteuse qui s’est produite.23
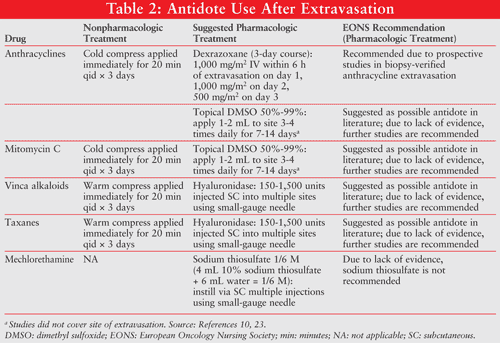
Pour les alcaloïdes vinca, où la dispersion ou la dilution du vésicant est indiquée, appliquer de la chaleur locale pendant 20 minutes 4 fois par jour pendant 1 pendant 2 jours. Pour les autres extravasations vésicantes, y compris les anthracyclines, le traitement initial vise à localiser et à neutraliser l’agent extravasé avec des compresses froides pendant 20 minutes 4 fois par jour pendant 1 à 2 jours, limitant l’absorption cellulaire de ces agents.23
Traitement pharmacologique
DMSO: Le DMSO est un solvant courant qui pénètre dans les tissus et améliore la perméabilité de la peau, ce qui peut faciliter l’absorption d’un médicament extravasé. Lorsqu’il est appliqué par voie topique, il possède des propriétés anti-oxydantes / anti-radicalaires qui peuvent accélérer l’élimination du médicament extravasé. Le DMSO (Rimso-50) est disponible uniquement à l’achat au détail aux États-Unis dans une solution à 50% (vol / vol) dans de l’eau. Cette solution est approuvée par la FDA uniquement pour le traitement de la cystite interstitielle récurrente.24 L’efficacité du DMSO dans le traitement de l’extravasation par chimiothérapie a été décrite pour la première fois dans plusieurs rapports de cas et de petites études cliniques.
Dans un cas, une extravasation de daunorubicine à 10 mg chez un homme de 42 ans a été traitée avec du bicarbonate de sodium, de la dexaméthasone (4 mg), des packs de glace et 1,5 mL de DMSO topique à 70%, appliqué toutes les 3 à 4 heures pendant 10 jours. Ce régime a permis de soulager la douleur et de prévenir les ulcères.25
Olver et Schwarz ont signalé trois cas de résolution d’extravasation avec l’utilisation du DMSO.26 Dans un cas, l’application quotidienne de DMSO à 99% pendant 14 jours a entraîné une résolution complète de la douleur dans les 2 jours sans ulcération chez un patient présentant une extravasation de doxorubicine. Le patient a également reçu du bicarbonate de sodium à 8,4% et le traitement non pharmacologique approprié. (Voir le TABLEAU 2 pour les options non pharmacologiques.) Dans un autre cas, un homme de 49 ans recevant 4 à 6 mg de doxorubicine a été traité pour une extravasation de doxorubicine avec 5 mL de 8.bicarbonate de sodium à 4%, packs de glace et DMSO à 99% appliqués quotidiennement pendant 14 jours. Aucune ulcération ne s’est produite; cependant, une zone indurée de 3 x 2,5 cm limitant l’extension du coude s’est produite.26 Dans un troisième cas, une application topique de DMSO à 99% (toutes les 6 heures pendant 1 semaine puis deux fois par jour pendant une autre semaine) a empêché l’ulcération; cependant, une pigmentation résiduelle est restée.26
Berghammer et al ont également signalé un cas d’extravasation de docétaxel.27 L’extravasat a été dilué avec une solution saline normale (0,9%) et traité avec des packs de glace. Le DMSO a été appliqué 3 fois toutes les 45 minutes et des corticostéroïdes oraux et du diclofénac ont été administrés le jour de l’extravasation. Tous les symptômes ont disparu dans les 24 heures; cependant, des symptômes retardés (décoloration brune, hyperplasie cutanée) sont apparus au jour 5 et ont augmenté par la suite. Aucune intervention chirurgicale plastique n’a été nécessaire. Bien que le DMSO associé à l’hypothermie et à une solution saline isotonique n’ait pas été efficace pour prévenir les symptômes retardés, il a limité l’inflammation et la nécrose tissulaire.
Ludwig et al ont rapporté que l’utilisation d’un mélange de DMSO à 90% et d’alpha-tocophérol à 10% dans les 48 heures suivant les extravasations d’anthracyclines ou de mitomycine C chez 8 patients n’a entraîné aucune ulcération cutanée ni altération fonctionnelle ou neurovasculaire.28 Malheureusement, l’alpha-tocophérol n’est pas un médicament facilement disponible et d’autres essais randomisés doivent être menés pour valider son utilisation.
Dans une étude prospective de 20 patients atteints d’extravasations d’anthracycline, le DMSO 99% a été administré deux fois, 6 fois par jour pendant 2 semaines.29 Aucun ulcère n’a été décrit après le traitement par DMSO, bien qu’un gonflement initial (85 %), un érythème (75 %) et une douleur (60 %) soient évidents. Après une période de suivi de 3 mois chez 16 patients, 6 (38%) patients n’avaient aucun symptôme apparent et 10 (63%) présentaient des indurations pigmentées. Bertelli a également mené une étude prospective évaluant les effets du DMSO sur les extravasations d’anthracyclines.30 La doxorubicine représentait 11 cas et l’épirubicine 46 cas. Les patients ont été traités avec du DMSO à 99% toutes les 8 heures pendant 7 jours. Soixante-dix pour cent des patients (40/57) ont présenté une résolution complète de l’extravasation en 1 semaine, un patient a présenté une induration résiduelle des tissus mous et un patient a présenté une hyperpigmentation résiduelle.
Dans ces rapports de cas et de petites études, les extravasations ont été diagnostiquées cliniquement et non par biopsie. Le DMSO peut être une option pour le traitement des anthracyclines extravasées, de la mitomycine C et de l’actinomycine D. Il est recommandé d’appliquer une fine couche de DMSO sur la zone extravasée et de laisser sécher. Un pansement non occlusif doit être appliqué dans les 10 à 25 minutes. Ces étapes doivent être répétées toutes les 8 heures pendant 7 jours.23 Bien que le DMSO ait été utilisé dans la pratique comme option de traitement, l’absence d’essais prospectifs peut limiter son utilisation. Les lignes directrices sur l’extravasation EONS 2007 recommandent que d’autres études soient menées; cependant, l’utilisation du DMSO de 50% à 99% peut être envisagée à la discrétion du clinicien.23 Il est important de noter qu’aucune des études prospectives sur le DMSO n’a utilisé de bandage afin de permettre à la peau d’absorber complètement le DMSO.
Hyaluronidase: On pense que la hyaluronidase est capable de décomposer la matrice extracellulaire qui sous-tend les cellules épithéliales. La matrice retient de grandes quantités de molécules d’eau et, lors de sa dégradation, elle est capable de libérer le fluide dans le milieu extracellulaire. Dans le cas d’une extravasation, il permet une augmentation du liquide sur le site, diluant ainsi la concentration réelle de la peau sur le site de contact.La hyaluronidase 31,32 a été utilisée pour le traitement des extravasations d’alcaloïdes vinca et de taxanes.33 Doses d’hyaluronidase allant de 150 à 1 500 unités diluées dans 1 mL de solution saline normale par voie sous-cutanée ou intradermique dans l’heure suivant l’extravasation ont été utilisées.
Dans une petite étude clinique portant sur 6 patients atteints d’extravasation à la vinblastine (n = 1), à la vincristine (n = 1) et à la vinorelbine (n = 4), 250 unités de hyaluronidase ont été injectées dans le cathéter à demeure, ou par voie sous-cutanée (6 injections) en cas de lésion. Aucun stéroïde ou paquet froid n’a été appliqué. La douleur s’est résolue dans les jours suivant le traitement par hyaluronidase chez tous les patients. Un patient s’est plaint d’une induration légèrement douloureuse 3 mois après l’extravasation de la vincristine.30 Ces rapports révèlent des informations prometteuses; cependant, il existe toujours un manque global de preuves de l’utilisation de la hyaluronidase pour le traitement des extravasations d’alcaloïdes vinca. D’autres essais prospectifs doivent être menés. Les lignes directrices sur l’extravasation EONS 2007 recommandent que d’autres études soient menées; cependant, l’hyaluronidase peut être considérée comme une option aux doses suggérées à la discrétion du clinicien.23
Thiosulfate de sodium: Le thiosulfate de sodium empêche l’alkylation et la destruction des tissus en fournissant un substrat pour l’alkylation dans le tissu sous-cutané. Il a été démontré que le thiosulfate de sodium était efficace dans des expériences sur des animaux et dans un rapport de cas pour le traitement de l’extravasation de la mechloréthamine (moutarde azotée).33,34 La dose suggérée est de 2 mL de 0,17 M (une solution de 4 mL de thiosulfate de sodium à 10% et de 6 mL d’eau stérile pour injection). En raison du manque de preuves, les directives d’extravasation EONS 2007 ne recommandent pas cela comme antidote.22
Dexrazoxane: Le Dexrazoxane (Totect) a récemment été approuvé par la FDA pour le traitement des extravasations induites par l’anthracycline. Le dexrazoxane a un double mécanisme d’action: 1) il agit comme un chélateur du fer, empêchant la formation de complexes fer-anthracycline et de radicaux hydroxyles médiés par le fer qui causent des dommages oxydatifs; et 2) il stabilise la topoisomérase II et la rend inaccessible à la chimiothérapie anthracycline. Le dexrazoxane bloque l’enzyme afin qu’elle ne soit plus affectée par l’anthracycline et empêche les dommages aux cellules saines des tissus.35
L’efficacité du dexrazoxane a été démontrée dans deux essais cliniques menés en Europe.36 Les deux essais étaient des essais cliniques prospectifs, ouverts, à bras unique et multicentriques menés de juillet 2001 à août 2005, avec un total de 80 patients inscrits. La première étude a inclus des patients de 17 sites cancéreux au Danemark et la seconde des patients de 34 sites cancéreux au Danemark, en Allemagne, en Italie et aux Pays-Bas. L’extravasation de l’anthracycline a été diagnostiquée et confirmée par microscopie à fluorescence de tissus biopsiés prélevés dans les 6 heures suivant le dexrazoxane. Un échantillon de 32 patients évaluables était nécessaire pour montrer une réduction de 70% ou plus de l’incidence de la chirurgie (test binomial unilatéral, a =.025, ß =.20). Le principal point final était le taux de résection chirurgicale et de nécrose. Cinquante-quatre des 80 patients (étude 1: n = 18; étude 2: n = 36) étaient évaluables (n = 13 biopsies négatives; n = 4 aucune biopsie effectuée; n = 8 violations du protocole), avec un âge moyen de 56 ans (plage, 34-81 ans). Soixante-neuf pour cent (n = 37) des patients évalués étaient des femmes. Le dexrazoxane a été administré en perfusion intraveineuse pendant 1 à 2 heures; 1 000 mg / m2 dans les 6 heures; 1 000 mg / m2 après 24 heures; et 500 mg / m2 après 48 heures d’extravasation.36
Les patientes ont été évaluées pour leur efficacité et leur innocuité aux jours 7, 14, 21 et 28, et pour leur efficacité au jour 90.36 Le diagnostic de cancer le plus courant était le cancer du sein (50 %), suivi du lymphome (39 %) et d’autres types de cancer (9 %). Les patients ont présenté des extravasations de doxorubicine (n = 23) ou d’épirubicine (n = 31). La surface d’extravasation moyenne était de 23,6 cm2 dans l’étude 1 et de 39 cm2 dans l’étude 2. Onze patients présentaient des zones d’extravasation supérieures à 75 cm2. Il n’y a eu aucune incidence de chirurgie dans les études 1 et 1 incident (2,8%, IC à 95% 0,1% -14,5%) dans l’étude 2. Le patient qui a développé une nécrose tissulaire due à une extravasation avait une très grande surface d’extravasation de la doxorubicine mesurant 253 cm2. Les symptômes ont augmenté dans les jours qui ont suivi l’extravasation, une nécrose tissulaire a commencé à se produire 9 jours après l’extravasation du patient et la nécrose a été excisée chirurgicalement. Dans l’étude 1, il y a eu 1 (5,6%) incident de nécrose dû à une biopsie, 6 (33.3%) incidents de report ou d’annulation de traitement du cancer prévu et 9 (50 %) hospitalisations dues à l’extravasation. Dans l’étude 2, il y a eu 1 (2,8%) incident de nécrose dû à une extravasation, 3 (8,3%) incidents de nécrose dus à une biopsie, 10 (27,8%) incidents de report ou d’annulation du traitement du cancer prévu en raison de l’extravasation et 13 (36,1%) incidents d’hospitalisation dus à l’extravasation. Au suivi de 3 mois, 88,9 % (n = 16) n’avaient aucune séquelle négative dans l’étude 1 et 63,9 % (n = 23) dans l’étude 2. Quinze des 80 patients présentaient des troubles sensoriels (n = 9), une atrophie cutanée (n = 5), des douleurs (n = 10), une défiguration (n = 1) et une limitation (n= 3). La plupart des patients (71%) ont pu recevoir un traitement de chimiothérapie supplémentaire dans les délais prescrits.
Les effets indésirables les plus courants comprenaient une diminution du nombre de globules blancs (72,5%), une diminution de l’hémoglobine (42,5%), une diminution du nombre de plaquettes (26%), une augmentation de l’aspartate aminotransférase (36,8%), une augmentation de l’alanine aminotransférase (23,9%), une réaction au site d’injection (27,5%) et des nausées (18,8%).36 Les résultats des essais cliniques ont révélé que le dexrazoxane est un agent efficace pour le traitement des extravasations aiguës d’anthracycline et la prévention des symptômes retardés.
Un résumé de ces recommandations de traitement, y compris les lignes directrices EONS 2007, est fourni dans le TABLEAU 2.
Rôle du pharmacien
Les pharmaciens doivent être étroitement associés à l’évaluation et à la prise en charge de toutes les extravasations induites par la chimiothérapie. Ils peuvent jouer un rôle essentiel de plusieurs façons, notamment: 1) l’élaboration de politiques et de protocoles; 2) l’éducation des patients, de la famille et de la multidisciplinarité; 3) la documentation et la déclaration des extravasations et autres réactions indésirables aux médicaments après le traitement; et 4) la surveillance du dosage, de l’administration et de l’efficacité du traitement.
Conclusion
Toutes les études examinées portaient sur des adultes, car les patients pédiatriques auraient eu un risque accru d’agitation et de traction des lignes. À ce jour, le dexrazoxane est le seul agent d’extravasation qui a été étudié dans de grands essais prospectifs multicentriques qui ont utilisé des tests objectifs et fiables pour diagnostiquer les cas d’extravasation; cela fournit des preuves solides de l’utilité du dexrazoxane. Malgré leurs utilisations courantes dans la pratique, d’autres traitements pharmacologiques, tels que le DMSO et la hyaluronidase, n’ont pas été étudiés de manière approfondie; par conséquent, les recommandations basées sur des preuves font défaut. La prise en charge de l’extravasation doit être effectuée à la discrétion du clinicien en collaboration avec tous les membres de l’équipe de soins de santé.
1. Société des Infirmières d’Infusion. Normes de pratique des soins infirmiers par perfusion. J Infus Nurs. 2006; 29 (complément 1): S1-S92.
2. Polovich M, White J, Kelleher L. Directives de chimiothérapie et de biothérapie et Recommandations pour la pratique. 2e éd. Pittsburgh, PA: Oncology Nursing Society; 2005.
3. Ener RA, Meglathery SB, Styler M. Extravasation des thérapies hémato-oncologiques systémiques. Ann Oncol. 2004;15:858-862.
4. Sauerland C, Egelking C, Wickman R, Corbi D. Extravasation vésicante partie I: mécanismes, pathogenèse et soins infirmiers pour réduire le risque. Forum Oncol Nurs. 2006;33:1134-1141.
5. Cassagnol M, Cohen H. Dermatologic toxicities of chemotherapeutic agents. US Pharm. 2008;33(1)(Oncology suppl):10-20.
6. Schulmeister L. Extravasation management. Semin Oncol Nurs. 2007;23:184-190.
7. Viale P. Chemotherapy and cutaneous toxicities: implications for oncology nurses. Semin Oncol Nurs. 2006;22:144-151.
8. Cox K, Stuart-Harris R, Abdini G, et al. The management of cytotoxic-drug extravasation: guide-lines drawn up by a working party for the Clinical Oncological Society of Australia. Med J Aust. 1988;148:185-189.
9. Schrijvers DL. Extravasation: une complication redoutée de la chimiothérapie. Ann Oncol. 2003; 14 (suppl 3): iii26-iii30.
10. Le Service National d’Information Sur L’Extravasation. www.extravasation.org.uk/home.html . Consulté le 25 mars 2009.
11. Lemmers N, Gels M, Sleijfer D, et al. Complications des ports d’accès veineux chez 132 patients atteints d’un cancer du testicule disséminé traités par polychémothérapie. J Clin Oncol. 1996;14:2916-2922.
12. Shetty PC, Mody MK, Kastan DJ. Résultat de 350 orifices thoraciques implantés placés par des radiologues interventionnels. J Vasc Interv Radiol. 1997;8:991-995.
13. Dorr RT. Antidotes aux extravasations de chimiothérapie vésicante. Blood Rev. 1990; 4:41-60.
14. Langer SW, Sehested M, Jensen PB. Traitement de l’extravasation de l’anthracycline avec du dexrazoxane. Clin Cancer Res. 2000; 6: 3680-3686.
15. Raymond E, Faivre S, Woynarowski JM, Chaney SG. Oxaliplatine: mécanisme d’action et activité antinéoplasique. Semin Oncol. 1998; 2 (suppl 5): 4-12.
16. Rivoire LP. Nouveaux médicaments pour le cancer colorectal – mécanismes d’action. Aust Prescr. 2002;25:108-110. www.australianprescriber.com/magazine/25/5/108/10 /. Consulté le 25 mars 2009.
17. Skeel RT. Manuel de chimiothérapie anticancéreuse. 5e éd. Il s’agit de l’un des plus grands noms de la littérature américaine, notamment dans les années 1990 et 1990.
18. Boyle DM, Engelking C. Extravasation vésicante: mythes et réalités. Forum Oncol Nurs. 1995;22:57-67.
19. Hadaway LC. Prévention et gestion de l’extravasation périphérique. Infirmière. 2004;34:66-67.
20. Shulmeister L, Camp-Sorrell D. Extravasation de chimiothérapie à partir de ports implantés. Forum Oncol Nurs. 2000;27:531-538.
21. Debets JM, Wils JA, Schlangen JT. Une complication rare des dispositifs d’accès centro-veineux implantés: fracture du cathéter et embolisation. Soutenir le cancer des soins. 1995;3:432-434.
22. Gorski LA. Occlusions du dispositif d’accès veineux central. Partie 2: Causes et traitement non thrombotiques. Infirmière de santé à domicile. 2003;21:168-171.
23. Directives d’extravasation 2007. Société Européenne des Soins Infirmiers en Oncologie. www.cancerworld.org/CancerWorld/getStaticModFile.aspx?id=2340 . Consulté le 25 mars 2009.
24. Notice du Rimso-50 (diméthylsulfoxyde). Lac Forest, IL: Bioniche Pharma USA LLC; 2009.
25. Lawrence HJ, Bonne nuit SH. Diméthylsulfoxyde limitant les dommages tissulaires causés par l’extravasation d’agents de doxorubicine. Ann Stagiaire Med. 1983;98:1025.
26. Olver DANS, Schwarz MA. Use of dimethyl sulfoxide in limiting tissue damage caused by extravasation of doxorubicin . Cancer Treat Rep. 1983;67:407-408.
27. Berghammer P, Pohnl R, Baur M, Dittrich C. Docetaxel extravasation. Support Care Cancer. 2001;9:131-134.
28. Ludwig CU, Stoll HR, Obrist R, Obrecht JP. Prevention of cytotoxic drug-induced skin ulcers with dimethyl sulfoxide (DMSO) and alpha-tocopherole. Eur J Cancer Clin Oncol. 1987;23:327-329.
29. Olver IN, Aisner J, Hament A, et al. A prospective study of topical dimethyl sulfoxide for treating anthracycline extravasation. J Clin Oncol.1988;6:1732-1735.
30. Bertelli G. Prevention and management of extravasation of cytotoxic drugs. Drug Saf. 1995;12:245-255.
31. Balazs EA, Laurent TC, Jeanloz RW. Nomenclature of hyaluronic acid. Biochem J. 1986;235:903.
32. Girish KS, Kemparaju K. The magic glue hyaluronan and its eraser hyaluronidase. Life Sci. 2007;80:1921-1943.
33. Dorr T. Antidotes to vesicant chemotherapy extravasations. Blood Rev. 1990;4:41-60.
34. Owen OE, Dellatorre DL, Van Scott EJ, Cohen MR. Accidental intramuscular injection of mechlorethamine. Cancer. 1980;45:2225-2226.
35. Totect (dexrazoxane for injection) package insert. Copenhagen, Denmark: TopoTarget A/S; October 2007.
36. Mouridsen HT, Langer SW, Buter J, et al. Treatment of anthracycline extravasation with Savene (dexrazoxane). Results from two prospective clinical multicenter studies. Ann Oncol. 2007;18:546-550.
Leave a Reply