NOAA Global Monitoring Laboratory – Halocarbons and other Atmospheric Trace Species
Chlorofluorocarbons (CFCs)
(published in The Chapman & Hall Encyclopedia of Environmental Science, edited by David E. Alexander and Rhodes W. Fairbridge, pp pp.78-80, Kluwer Academic, Boston, MA, 1999.)
Chlorofluorocarbons (CFCs) are nontoxic, nonflammable chemicals containing atoms of carbon, chlorine, and fluorine. Ils sont utilisés dans la fabrication de sprays aérosols, d’agents gonflants pour mousses et matériaux d’emballage, comme solvants et comme réfrigérants. Les CFC sont classés comme des halocarbures, une classe de composés contenant des atomes de carbone et des atomes d’halogène. Les molécules de CFC individuelles sont étiquetées avec un système de numérotation unique. Par exemple, le nombre de CFC de 11 indique le nombre d’atomes de carbone, d’hydrogène, de fluor et de chlore (par exemple, CCl3F en tant que CFC-11). La meilleure façon de se souvenir du système est la « règle de 90 » ou d’ajouter 90 au nombre de CFC où le premier chiffre est le nombre d’atomes de carbone (C), le deuxième chiffre est le nombre d’atomes d’hydrogène (H) et le troisième chiffre est le nombre d’atomes de fluor (F). Le nombre total d’atomes de chlore (Cl) est calculé par l’expression : Cl = 2 (C+ 1)-H-F. Dans l’exemple, le CFC-11 a un carbone, pas d’hydrogène, un fluor, et donc 3 atomes de chlore.
Les réfrigérateurs de la fin des années 1800 et du début des années 1900 utilisaient les gaz toxiques, l’ammoniac (NH3), le chlorure de méthyle (CH3Cl) et le dioxyde de soufre (SO2), comme réfrigérants. Après une série d’accidents mortels dans les années 1920 lorsque du chlorure de méthyle s’est échappé des réfrigérateurs, une recherche d’un remplacement moins toxique a commencé dans le cadre d’un effort de collaboration de trois sociétés américaines – Frigidaire, General Motors et Du Pont. Les CFC ont été synthétisés pour la première fois en 1928 par Thomas Midgley, Jr. de General Motors, en tant que produits chimiques plus sûrs pour les réfrigérateurs utilisés dans les grandes applications commerciales1. Frigidaire a reçu le premier brevet, numéro 1 886 339, pour la formule des CFC le 31 décembre 1928. En 1930, General Motors et Du Pont formèrent la Kinetic Chemical Company pour produire du Fréon (un nom commercial de Du Pont pour les CFC) en grande quantité. En 1935, Frigidaire et ses concurrents avaient vendu 8 millions de nouveaux réfrigérateurs aux États-Unis utilisant du Fréon-12 (CFC-12) fabriqué par la Kinetic Chemical Company et les sociétés autorisées à fabriquer ce composé. En 1932, la Carrier Engineering Corporation utilisa le Fréon-11 (CFC-11) dans le premier climatiseur domestique autonome au monde, appelé « Armoire atmosphérique ».; En raison du dossier de sécurité des CFC pour la non-toxicité, le fréon est devenu le liquide de refroidissement préféré dans les grands systèmes de climatisation. Les codes de santé publique de nombreuses villes américaines ont été révisés pour désigner le fréon comme le seul liquide de refroidissement pouvant être utilisé dans les bâtiments publics. Après la Seconde Guerre mondiale, les CFC ont été utilisés comme propulseurs pour les sprays anti-insectes, les peintures, les revitalisants capillaires et d’autres produits de soins de santé. À la fin des années 1950 et au début des années 1960, les CFC ont rendu possible une solution peu coûteuse au désir de climatisation dans de nombreuses automobiles, maisons et immeubles de bureaux. Plus tard, la croissance de l’utilisation des CFC a décollé dans le monde entier avec des ventes annuelles maximales d’environ un milliard de dollars (États-Unis) et plus d’un million de tonnes de CFC produites.
Alors que les CFC peuvent être utilisés sans danger dans la plupart des applications et sont inertes dans la basse atmosphère, ils subissent une réaction importante dans la haute atmosphère ou la stratosphère. En 1974, deux chimistes de l’Université de Californie, le professeur F. Sherwood Rowland et le Dr. Mario Molina, a montré que les CFC pourraient être une source majeure de chlore inorganique dans la stratosphère suite à leur décomposition photolytique par rayonnement UV. De plus, une partie du chlore libéré deviendrait active dans la destruction de l’ozone dans la stratosphère2. L’ozone est un gaz à l’état de traces situé principalement dans la stratosphère (voir ozone). L’ozone absorbe le rayonnement ultraviolet nocif dans les longueurs d’onde comprises entre 280 et 320 nm de la bande UV-B, ce qui peut causer des dommages biologiques chez les plantes et les animaux. Une perte d’ozone stratosphérique entraîne un rayonnement UV-B plus nocif atteignant la surface de la Terre. Le chlore libéré par les CFC détruit l’ozone dans les réactions catalytiques où 100 000 molécules d’ozone peuvent être détruites par atome de chlore.
Une grande déplétion printanière de l’ozone stratosphérique s’aggravait chaque année suivante. Cette perte d’ozone a été décrite en 1985 par le chercheur britannique Joe Farman et ses collaborateurs3. Il a été appelé le trou d’ozone antarctique par d’autres. Le trou d’ozone était différent de la perte d’ozone dans les latitudes moyennes. La perte était plus importante au-dessus de l’Antarctique que dans les latitudes moyennes en raison de nombreux facteurs: les températures inhabituellement froides de la région, l’isolement dynamique de cette ìholeî et les réactions synergiques du chlore et du brome4. La perte d’ozone est également accrue dans les régions polaires à la suite de réactions impliquant des nuages stratosphériques polaires (PSCS)5 et dans les latitudes moyennes à la suite d’éruptions volcaniques. La nécessité de contrôler les CFC est devenue urgente.
En 1987, 27 pays ont signé un traité environnemental mondial, le Protocole de Montréal visant à Réduire les Substances qui Appauvrissent la couche d’Ozone 6, qui prévoyait de réduire de 50 % les niveaux de production de ces composés en 1986 avant l’an 2000. Cet accord international prévoyait des restrictions à la production de CFC-11, -12, -113, -114, -115, et les halons (produits chimiques utilisés comme agents extincteurs). Un amendement approuvé à Londres en 1990 était plus énergique et prévoyait l’élimination de la production d’ici l’an 2000. Les solvants chlorés, le méthylchloroforme (CH3CCl3) et le tétrachlorure de carbone (CCl4) ont été ajoutés à l’amendement de London.
De grandes quantités de chlore stratosphérique réactif sous forme de monoxyde de chlore (ClO) qui ne pouvaient résulter que de la destruction de l’ozone par les CFC dans la stratosphère ont été observées par les instruments à bord de l’avion ER-2 de la NASA et de l’UARS (Upper Atmospheric Research Satellite) au-dessus de certaines régions d’Amérique du Nord au cours de l’hiver 19927,8. La préoccupation environnementale des CFC découle de leur longue durée de vie atmosphérique (55 ans pour le CFC-11 et 140 ans pour le CFC-12, CCl2F2)9, ce qui limite notre capacité à réduire leur abondance dans l’atmosphère et la perte future d’ozone qui en découle. Cela a abouti à l’amendement de Copenhague qui a encore limité la production et a été approuvé plus tard en 1992. La fabrication de ces produits chimiques a pris fin pour la plupart le 1er janvier 1996. Les seules exceptions approuvées concernaient la production dans les pays en développement et certaines applications exemptées en médecine (c.-à-d. inhalateurs pour l’asthme) et en recherche. Le Protocole de Montréal comprenait des dispositions d’application en appliquant des sanctions économiques et commerciales si un pays signataire commercialisait ou produisait ces produits chimiques interdits. Au total, 148 pays signataires ont signé le Protocole de Montréal. Les mesures atmosphériques de CFC-11 et de CFC-12 rapportées en 1993 ont montré que leurs taux de croissance diminuaient en raison des réductions volontaires et prescrites des émissions9. De nombreux CFC et certains solvants chlorés se sont soit stabilisés (figure 1), soit leur concentration a diminué en 1994910.
La demande de CFC a été satisfaite par le recyclage et la réutilisation des stocks existants de CFC et par l’utilisation de substituts. Certaines applications, par exemple le dégraissage des métaux et les solvants de nettoyage des cartes de circuits imprimés, qui utilisaient autrefois les CFC utilisent maintenant des fluides sans halogénures, de l’eau (parfois sous forme de vapeur) et des acides citriques dilués. L’industrie a mis au point deux classes de substituts d’halocarbures : les hydrochlorofluorocarbures (HCFC) et les hydrofluorocarbures (HFC). Les HCFC comprennent des atomes d’hydrogène en plus du chlore, du fluor et des atomes de carbone. L’avantage de l’utilisation des HCFC est que l’hydrogène réagit avec l’hydroxyle troposphérique (OH), ce qui entraîne une durée de vie atmosphérique plus courte. Le HCFC-22 (CHClF2) a une durée de vie atmosphérique d’environ 13 ans11 et est utilisé dans la climatisation domestique à faible demande et dans certaines applications de réfrigération depuis 1975. Cependant, les HCFC contiennent encore du chlore, ce qui leur permet de détruire l’ozone. L’amendement de Copenhague prévoit l’élimination de leur production d’ici 2030. Les HFC sont considérés comme l’un des meilleurs substituts pour réduire la perte d’ozone stratosphérique en raison de leur courte durée de vie et de leur manque de chlore. Aux États-Unis, le HFC-134a est utilisé dans tous les nouveaux climatiseurs automobiles domestiques. Par exemple, le HFC-134a croît rapidement en 1995 à un taux de croissance d’environ 100 % par an avec une durée de vie atmosphérique d’environ 12 ans12. (La » règle de 90 » s’applique également à la formule chimique des HCFC et des HFC.)
L’utilisation des CFC, de certains solvants chlorés et des halons devrait devenir obsolète au cours de la prochaine décennie si le Protocole de Montréal est respecté par toutes les parties et si des substituts sont utilisés. La science qui est devenue la base du Protocole de Montréal a abouti au Prix Nobel de chimie de 1995. Le prix a été décerné conjointement aux professeurs F. S. Rowland à l’Université de Californie à Irvine, M. Molina au Massachusetts Institute of Technology, Cambridge, et Paul Crutzen au Max-Planck-Institute for Chemistry à Mayence, en Allemagne, pour leurs travaux en chimie atmosphérique, en particulier concernant la formation et la décomposition de l’ozone (en particulier, par les CFC et les oxydes d’azote).
1Midgley, T., et Henne, A., Organic fluorures as refrigerants, Industrial and Engineering Chemistry, 22, 542-547, 1930.
2Molina, M.J. et F.S. Rowland, puits stratosphérique pour les chlorofluorométhanes: Destruction catalysée par l’atome de chlore de l’ozone, Nature, 249, 810-814, 1974.
3Farman, J.C., B.G. Gardiner et J.D. Shanklin, Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction, Nature, 315,207-210, 1985.
4McElroy, M.B., R.J. Salawitch, S.C. Wofsy et J.A. Logan, Reductions of Antarctic ozone due to synergistic interactions of chlorine and brome, Nature, 321, 759-762, 1986.
5Solomon, S., R.R. Garcia, F.S. Rowland et D.J. Wuebbles, Sur l’appauvrissement de l’ozone antarctique, Nature, 321, 755-758, 1986.
6 Protocole réel sur les Substances qui appauvrissent la couche d’Ozone, 15 pages, Programme des Nations Unies pour l’environnement (PNUE), New York, 1987.
7Toohey, D.W., L.M. Avallone, L.R. Lait, P.A. Newman, M.R. Schoeberl, D.W. Fahey, E.L. Woodbridge et J.G. Anderson, L’évolution saisonnière du chlore réactif dans la stratosphère de l’hémisphère nord, Science, 261, 1134-1136, 1993.
8Waters, J., L. Froidevaux, W. Read, G. Manney, L..Elson, D. Flower, R. Jarnot et R. Harwood, Stratospheric ClO andozone from the Microwave Limb Sounder on the Upper Atmosphere Research Satellite, Nature, 362, 597-602, 1993.
9Elkins, J.W., T.M. Thompson, T.H. Swanson, J.H. Butler, B.D. Hall, S.O. Cummings, D.A. Fisher et A.G. Raffo, Diminution des taux de croissance des chlorofluorocarbones atmosphériques 11 et 12, Nature, 364, 780-783, 1993.
10Prinn, R.G., R.F. Weiss, B.R. Miller, J. Huang, F.N. Alyea, D.M. Cunnold, P.J. Fraser, D.E. Hartley et P.G. Simmonds, Atmospheric trends and lifetimes of CH3CCl3 and global OH concentrations, Science, 269, 187-192, 1995.
11Montzka, S.A., R.C. Myers, J.H. Butler, S.C. Cummings et J.W. Elkins, Global tropospheric distribution and calibration scale of HCFC-22, Geophysical Research Letters, 20 (8), 703-706, 1993.
12Montzka, S.A., R.C. Myers, J.H. Butler, J.W. Elkins, L.T. Lock, A.D. Clarke et A.H. Goldstein, Observations of HFC-134a in the remote troposphere, Geophysical Research Letters, 23, 169-172, 1996.
Lecture supplémentaire suggérée:
Cagin, S., et P. Dray, Between Earth and Sky: How CFC changed our world and threatened the ozone layer, 512 p., Pantheon Press, New York, 1993.
Évaluation scientifique de l’appauvrissement de la couche d’ozone: 1994, sous la direction de D. L. Albritton, R. T. Watson et R. J. Aucamp, 37, 451 p., Organisation météorologique mondiale (OMM), Genève, 1995.
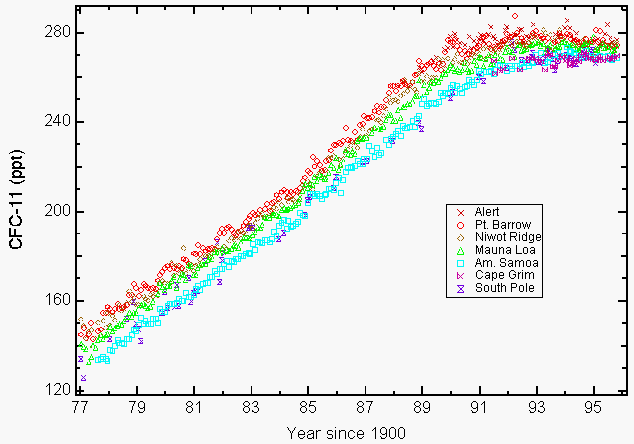
Figure 1: L’accumulation de chlorofluorocarbone-11 (CFC-11) dans l’atmosphère se stabilise à la suite de réductions volontaires et obligatoires des émissions. Moyennes mensuelles déclarées sous forme de rapports de mélange à sec en parties par billion (ppt) pour le CFC-11 au niveau du sol pour quatre stations NOAA/CMDL (Pt. Barrow, Alaska; Mauna Loa, Hawaï; Cape Matatula, Samoa américaines; et Pôle Sud) et trois stations coopératives (Alert, Territoires du Nord-Ouest, Canada (Service de l’environnement atmosphérique); Niwot Ridge, Colorado (Université du Colorado); Cape Grim Baseline Air Pollution Station, Tasmanie, Australie, (Commonwealth Scientific and Industrial Research Organization) 9. (Avec l’aimable autorisation de la NOAA/CMDL)
Leave a Reply