Liaison chimique
Les liaisons chimiques sont les attractions entre les atomes qui les maintiennent ensemble pour former des composés. Il existe trois principaux types de liaisons: les liaisons covalentes qui lient les composés moléculaires, les liaisons ioniques qui lient les sels et les cristaux ioniques et les liaisons métalliques qui lient les atomes des métaux.
Molécules et liaisons covalentes
La plupart des carburants, des plastiques et des produits naturels sont des composés moléculaires, constitués d’atomes liés entre eux en molécules. Le type de liaison joignant les atomes d’une molécule est une liaison covalente, qui se produit lorsque les électrons externes de deux atomes sont partagés entre eux, créant une attraction entre les deux atomes.
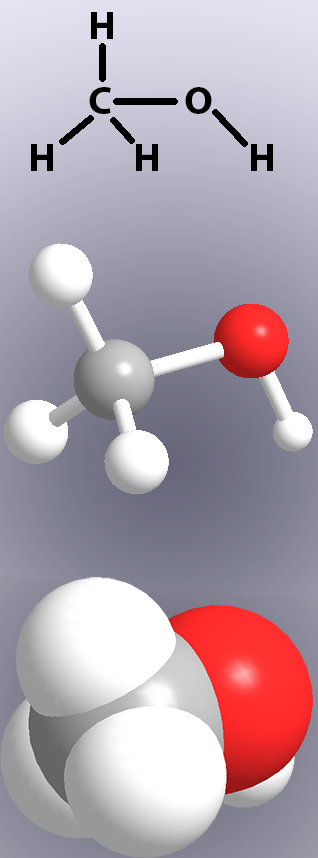
Les liaisons covalentes sont représentées dans les structures chimiques par des lignes (Figure 1, en haut) et dans les modèles en montrant soit des » bâtonnets », soit le chevauchement des atomes (Figure 1, au milieu et en bas).
Les électrons d’une liaison covalente ne sont pas toujours partagés également entre les deux atomes. Lorsque le partage est inégal, un atome aura une très légère charge positive et l’autre atome sera légèrement négatif. Cela crée un petit dipôle électrique – les molécules qui contiennent un dipôle sont des composés polaires. Qu’une molécule soit polaire ou non polaire affectera ses propriétés, telles que les points de fusion et d’ébullition, et la liaison à l’hydrogène.
En savoir plus sur la liaison covalente sur le livret de chimie.
Liaison ionique et métallique
Alors que la liaison covalente implique le partage d’électrons entre deux atomes, la liaison ionique implique le transfert complet d’électrons d’un atome à un autre, créant des ions positifs et négatifs. Ces ions sont ensuite maintenus ensemble par l’attraction entre leurs charges opposées. Les composés ioniques forment des cristaux basés sur ces attractions.
La liaison métallique implique le partage complet des électrons de valence des atomes métalliques, créant une « mer d’électrons » dans laquelle les électrons sont libres de se déplacer. Cela explique en partie la conductivité élevée des métaux. En savoir plus sur la liaison métallique sur le Livret de chimie
Liaisons énergétiques et chimiques
En général, l’énergie sera libérée lorsqu’une liaison se forme entre deux atomes, quel que soit le type de liaison. De même, si une liaison existe déjà entre deux atomes, de l’énergie sera nécessaire pour la rompre. La quantité d’énergie nécessaire pour rompre une liaison est la même que la quantité d’énergie libérée lorsqu’elle se forme.
La plupart des réactions chimiques impliquent à la fois la rupture et la création de liaisons chimiques. Si l’énergie libérée par la formation de nouvelles liaisons est supérieure à l’énergie nécessaire pour rompre les « anciennes » liaisons, l’énergie sera globalement libérée par la réaction. Cette énergie peut être perdue sous forme de chaleur ou peut être utilisée pour l’énergie.
Par exemple, la combustion du méthane (CH4) suit cette réaction chimique:
Cette réaction implique la rupture des quatre liaisons carbone-hydrogène dans le méthane et de la liaison oxygène-oxygène dans O2. Les nouvelles liaisons formées sont les deux liaisons carbone-oxygène (en CO2) et hydrogène-oxygène (en H2O). Ces nouvelles liaisons ont globalement moins d’énergie que les liaisons originales, de sorte que l’énergie sera libérée par cette réaction. La libération d’énergie est une caractéristique des réactions de combustion – vous l’avez peut-être remarqué lorsque vous ressentez une flamme chaude. L’animation ci-dessous illustre la combustion hydrocarbonée du méthane.
Comme une grande quantité d’énergie est libérée lors de la formation du CO2 et de l’H2O lors de la combustion d’hydrocarbures comme le méthane, ceux-ci constituent une bonne source d’énergie primaire. Cela signifie également qu’une grande quantité d’énergie serait nécessaire pour rompre les liaisons du CO2 et former d’autres molécules. C’est l’une des raisons pour lesquelles la photosynthèse nécessite tant d’énergie (de la lumière du soleil) pour convertir le CO2 en glucides.
Pour en savoir plus
- Énergie chimique
- Combustion
- Énergie primaire
- Technologie de conversion d’énergie
- Ou explorez une page aléatoire
Leave a Reply