Les énantiomères et diastéréomères
Les énantiomères et diastéréomères sont les deux seules relations stéréochimiques que vous pouvez avoir entre deux molécules quelconques. Les stéréoisomères sont deux molécules quelconques qui remplissent les deux conditions suivantes :
- Les deux molécules doivent avoir la même formule moléculaire et
- Les deux molécules doivent avoir la même connectivité atomique.
Alors, quelle est la différence alors? Les molécules sont des stéréoisomères si elles ont une forme 3D différente et qu’elles ne sont pas superposables dans l’espace.
Que signifie non superposable?
Les molécules non superposables ne peuvent pas avoir exactement la même apparence, peu importe le nombre d’opérations de rotation que vous effectuez avec elles. Les « rotations » incluent également la rotation libre autour des liaisons simples.
Pensez à vos mains. Si vous les alignez ensemble de sorte que tous les doigts s’alignent, les paumes vont regarder dans les directions opposées. Si vous faites regarder vos paumes dans la même direction, vos pouces regarderont dans une direction différente, etc. Peu importe la rotation de vos mains, vous ne pourrez jamais les rendre exactement identiques — vos mains sont des images miroir non superposables. Le même principe s’applique aux molécules.
Alors, pourquoi avons-nous besoin de deux relations? Pourquoi avons—nous besoin d’énantiomères et de diastéréomères et ne pouvons-nous pas simplement utiliser des stéréoisomères uniques? Il y a en fait un type différent de relations que deux molécules peuvent avoir. Creusons un peu plus.
Quels sont les énantiomères ?
Les énantiomères sont deux molécules qui sont des images miroir non superposables. Tout comme vos mains, les molécules peuvent avoir une image miroir qui ne sera pas superposable à la molécule d’origine. Regardez ces deux molécules:
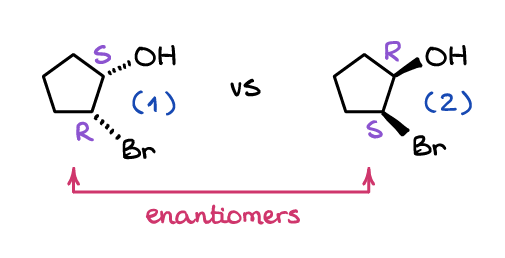
Peu importe combien vous en faites pivoter une dans l’espace, vous ne pourrez jamais la faire ressembler à l’autre. Alors que la molécule (1) et la molécule (2) ont les deux groupes (OH et Br) cis l’un par rapport à l’autre, elles regardent dans des directions différentes du plan du cycle.
Notez qu’il existe de nombreuses façons de créer une image miroir pour une molécule. Voici les trois exemples possibles:
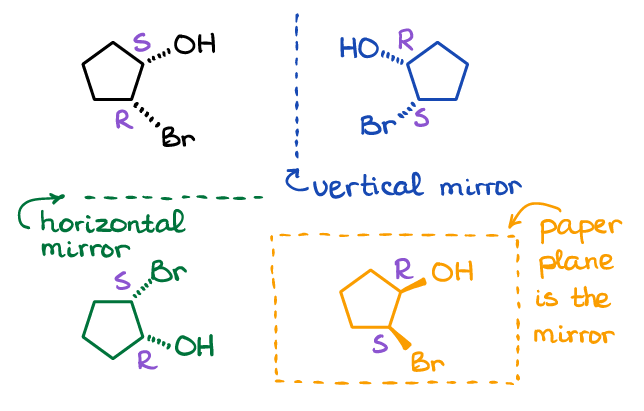
Le plan miroir peut être vertical, horizontal, ou même le papier où vous dessinez la molécule peut être le plan miroir lui-même. Je vous suggère de créer quelques molécules à partir de l’image ci-dessus à l’aide de votre kit de modèles moléculaires (choisissez une réflexion), et assurez-vous qu’elles ne sont pas superposables en les faisant tourner physiquement dans l’espace.
Une autre distinction importante des énantiomères est que tous les stéréocentres sont également en miroir entre les molécules. Ce qui signifie que tous les stéréocentres S sont des R dans l’autre molécule et tous les R dans une molécule sont des S dans l’autre. Par exemple, la molécule (1) ci-dessus est le (1S, 2R)-2-bromocyclopentanol, tandis que son énantiomère, la molécule (2), est le (1R, 2S)-2-bromocyclopentanol.
Quels sont les diastéréomères ?
En ce qui concerne les diastéréomères, ce ne sont pas des énantiomères. seriously Je veux dire, sérieusement, la définition « commune » d’un diastéréomère est les stéréoisomères qui ne sont pas des énantiomères. La définition officielle est cependant que les diastéréomères sont des molécules non superposables qui ne sont pas des images miroir les unes des autres. Par exemple, regardons les deux molécules suivantes:
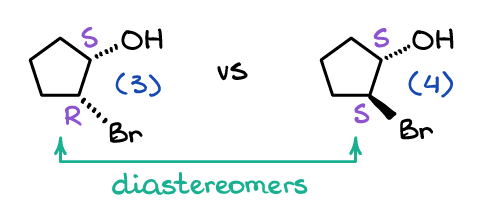
Les molécules (3) et (4) ne sont évidemment pas des images miroir, elles ne peuvent donc pas être des énantiomères. Ils ne sont pas non plus superposables dans l’espace, peu importe combien vous les faites pivoter dans l’espace, ce ne sont donc pas la même molécule non plus. Ainsi, par définition, ce sont des diastéréomères car ce sont des images non superposables et non miroir les unes des autres.
Remarquez que, contrairement aux énantiomères, les diastéréomères n’ont que quelques-uns des stéréocentres qui changent d’une molécule à l’autre. Par exemple, la molécule (3) est le (1S, 2R)-2-bromocyclopentanol, tandis que son diastéréomère est le (1S, 2S)-2-bromocyclopentanol.
Faut-il des carbones chiraux pour avoir des énantiomères et des diastéréomères ?
Non, vous ne le faites pas! Notez comment la définition des énantiomères dit que les molécules sont des images miroir non superposables, tandis que les diastéréomères sont des images non miroir non superposables? Les définitions ne disent rien des centres chiraux ou des atomes. Ainsi, toute paire de molécules qui correspond à la définition fonctionne! Par exemple, les allènes sont des alcènes cumulés qui ne sont pas planaires :
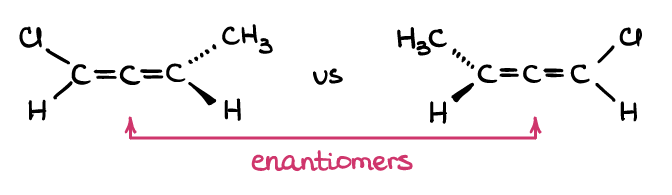
Si vous construisez une paire d’allènes avec votre kit de modèles moléculaires (oui, procurez-vous votre kit de modèles moléculaires et en fait, construisez-les!), vous verrez, que ceux-ci ne sont pas superposables dans l’espace. Mais ces deux molécules n’ont pas de carbones chiraux… et pourtant, elles correspondent à la définition des énantiomères, donc ce sont une paire d’énantiomères! Donc, comme vous pouvez le voir, les atomes chiraux en eux-mêmes n’est pas la chose importante ici, c’est plutôt la structure 3D de la molécule elle-même.
Vous pouvez également avoir des diastéréomères dans des molécules qui n’ont pas d’atomes chiraux. Regardez les exemples suivants:
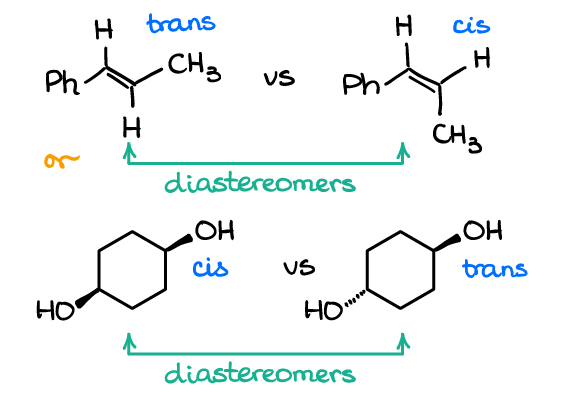
La paire supérieure est un exemple des isomères cis /trans (ou E / Z si vous souhaitez utiliser les noms UIPAC stricts) dans les alcènes. La deuxième paire représente également comme paire d’isomères cis/trans. Aucune des molécules, cependant, n’a d’atomes chiraux. Et puisque chaque paire représente un couple de molécules non superposables qui ne sont pas des images miroir, ce sont des diastéréomères.
Ce sont des exemples typiques sur les tests et de nombreux instructeurs adorent vous poser ces questions. De nombreux étudiants ont tendance à avoir une sorte de vision en tunnel lorsqu’il s’agit de relations stéréochimiques se concentrant uniquement sur des molécules avec des atomes chiraux. C’est une heuristique défectueuse ! Assurez-vous donc de toujours analyser la molécule entière et d’utiliser la définition de la relation, plutôt que de vous concentrer uniquement sur les atomes chiraux.
Leave a Reply