Jetez un coup d’œil aux articles récents
Résumé
Les tumeurs du corps carotidien sont des tumeurs neuroendocrines hypervasculaires rares à croissance lente. Bien que ces tumeurs soient des tumeurs bénignes, elles ont également tendance à une transformation maligne. L’excision chirurgicale complète est la modalité thérapeutique de référence pour le traitement des tumeurs du corps carotidien. Une ablation chirurgicale précoce est recommandée pour prévenir le développement de tumeurs plus grandes et plus avancées, associées à une morbidité et une mortalité plus élevées. Dans ce rapport, nous avons présenté trois cas de tumeur du corps carotidien qui ont été traités avec succès par une excision chirurgicale complète et passé en revue la littérature actuelle. En outre, il a été souligné la nécessité d’une prise en charge chirurgicale précoce indépendamment de l’âge du patient et de la taille de la tumeur.
Mots clés
tumeurs du corps carotidien, prise en charge, excision chirurgicale
Introduction
Les tumeurs du corps carotidien (TCC), également appelées paragangliomes ou chimiodectomes, sont des néoplasmes neuroendocriniens rares qui surviennent près de la bifurcation carotidienne dans les cellules du glome dérivées de la crête neurale embryonnaire. L’incidence déclarée des TCC est de 1 à 2 pour 100 000. La majorité de ces tumeurs sont asymptomatiques et initialement remarquées par l’inspection et la palpation de l’enflure du cou lors de l’examen physique, ou plus généralement comme découvertes fortuites lors d’études d’imagerie radiologique. Néanmoins, les symptômes les plus observés sont la douleur, la dysphagie et le dysfonctionnement autonome dans les cas symptomatiques. Bien que les TCC soient des lésions bénignes, elles ont tendance à se transformer en tumeurs malignes dans environ 10% des cas. Ainsi, afin d’éviter l’invasion locale et les métastases, l’excision chirurgicale précoce est considérée comme une option de traitement curatif primaire pour le traitement des TCC. Dans cet article, nous avons signalé trois cas de TCC qui ont été traités avec succès par une excision chirurgicale complète et avons examiné la littérature actuelle.
Approche chirurgicale
Après avoir informé de l’opération et obtenu les formulaires de consentement chirurgical, les trois cas ont été conduits en salle d’opération pour une excision primaire sous anesthésie générale. La masse tumorale a été approchée par une incision cervicale oblique. Les principes chirurgicaux de base comprenaient une dissection anatomique complète et un contrôle vasculaire avant la tentative d’excision tumorale. À cette fin, toutes les structures neurovasculaires ont été identifiées et des dissections périadventitielles des artères carotides ont été effectuées. Les artères carotides communes, carotides internes et carotides externes ont été retenues à l’aide des bandes de vaisseaux avant la résection tumorale (figure 1). Les vaisseaux d’alimentation alimentant la tumeur ont d’abord été ligaturés, puis la tumeur a été isolée des structures adjacentes et excisée (Figures 2a et 2b). Alors que les masses étaient facilement excisées totalement sans dissection subadventitielle des artères carotides dans les cas de Shamblin de type I et II, dans le cas de Shamblin de type III, la dissection a été réalisée le long du plan sousadventitiel artériel pour permettre une excision tumorale locale complète, ainsi que la préservation des artères carotides. Dans tous les cas, les masses ont été excisées sans lésion neurovasculaire.
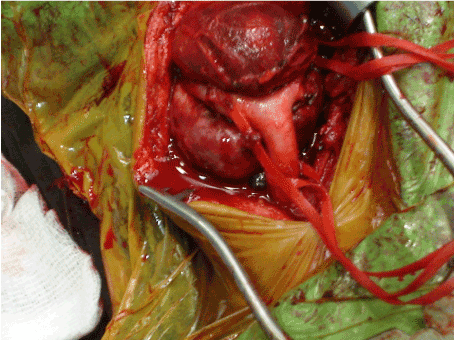
Figure 1. Vue peropératoire de la tumeur du corps carotidien avant l’excision complète.
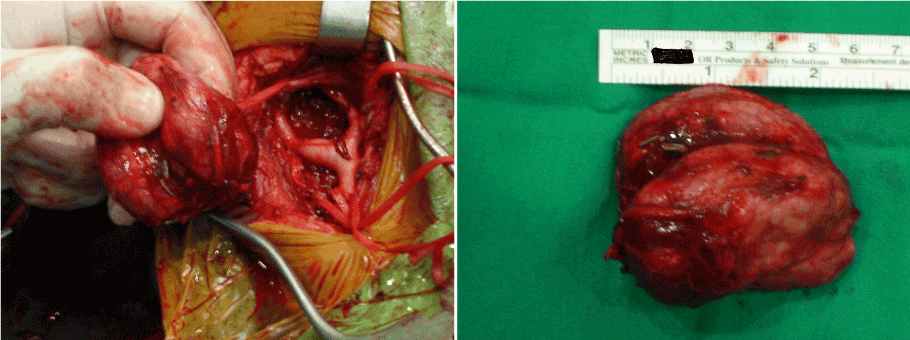
Figures 2a et 2b. Vue peropératoire de la tumeur du corps carotidien après une excision complète.
Présentations de cas
Cas 1
Une patiente de 66 ans a été admise à notre clinique externe en raison de la présence d’un gonflement de la région cervicale droite. L’examen physique, l’échographie duplex et l’angiographie par tomodensitométrie ont révélé une masse sur la bifurcation de la carotide droite mesurant 15 x 15 x 11 mm qui a été considérée comme une TCC. Elle a été opérée le plus tôt possible après l’établissement du diagnostic. Sa lésion a été acceptée comme Shamblin de type I en peropératoire. Elle a été transférée à l’unité de soins intensifs pour une surveillance étroite après l’opération. Le 1er jour postopératoire, le drain a été retiré et la patiente a été transférée à la clinique, puis elle a été libérée sans problème le même jour.
Cas 2
Une patiente de 75 ans a été admise dans notre clinique externe en raison de la présence de vertiges et d’un gonflement de la région cervicale droite. L’examen physique, l’échographie duplex et l’angiographie par tomodensitométrie ont révélé une masse sur la bifurcation de la carotide droite mesurant 40 x 30 x 24 mm qui a été considérée comme une TCC. De plus, une insuffisance vertébrobasilaire a été détectée selon les résultats de l’échographie duplex (volume total des artères vertébrales = 166 mL / min). Elle a été opérée le plus tôt possible après l’établissement du diagnostic. Sa lésion a été acceptée comme Shamblin de type II en peropératoire. Elle a été transférée à l’unité de soins intensifs pour une surveillance étroite après l’opération. Le 1er jour postopératoire, le drain a été retiré et la patiente a été transférée à la clinique, puis elle a été libérée sans problème le 2ème jour postopératoire.
Cas 3
Une patiente de 50 ans a été admise à notre clinique externe en raison de la présence de vertiges et d’un gonflement de la région cervicale droite. Ses symptômes qui ont été progressivement augmentés existaient depuis environ 15 ans. L’examen physique, l’échographie duplex et l’angiographie par tomodensitométrie ont révélé une masse sur la bifurcation de la carotide droite mesurant 75 x 55 x 45 mm qui a été considérée comme une TCC. Elle a été opérée le plus tôt possible après l’établissement du diagnostic. Sa lésion a été acceptée comme Shamblin de type III en peropératoire. Elle a été transférée à l’unité de soins intensifs pour une surveillance étroite après l’opération. À la 4ème heure postopératoire, le patient a été transféré à la clinique. Le 1er jour postopératoire, le drain a été retiré et elle a été évacuée sans problème le 2ème jour postopératoire.
Discussion
Le corps carotidien a été décrit pour la première fois par von Haller en 1743. C’est un organe rond brun rougeâtre, bien circonscrit et hautement spécialisé, de 2 à 6 mm, situé dans l’adventice de la bifurcation carotidienne, alimenté par les vaisseaux d’alimentation provenant principalement de la branche pharyngée ascendante de l’artère carotide externe, et innervé par les nerfs glossopharyngien et vague. Il fonctionne comme un organe chimiorécepteur qui est stimulé par l’acidose, l’hypoxie et l’hypercapnée, et joue un rôle dans le contrôle autonome de la pression artérielle, de la fréquence cardiaque, de la respiration et de la température du sang en réponse aux changements de ces paramètres en augmentant le flux sympathique.
Les TCC sont des tumeurs hypervasculaires à croissance lente qui représentent environ 0,03% de tous les néoplasmes. Ils semblent plus fréquents chez les femmes avec un ratio hommes / femmes de 1: 1,9. Ces tumeurs ont été rapportées comme malignes dans 10% des cas, familiales dans 10% des cas et bilatérales dans 10% des cas sporadiques, la bilatéralité peut atteindre 30% dans les cas familiaux.
En 1971, Shamblin, et al. introduit un système de classification en fonction de la relation avec les artères carotides afin de déterminer la résectabilité de ces tumeurs. Les tumeurs de Shamblin de type I sont des masses localisées et n’impliquent pas les artères carotides environnantes, les tumeurs de type II sont adhérentes ou entourent partiellement les artères carotides et sont donc relativement plus difficiles à réséquer, et les tumeurs de type III sont grandes, enveloppent les vaisseaux et donc le type le plus difficile à tenter la résection. Selon la classification de Shamblin, les tumeurs de type III sont associées à plus de complications neurovasculaires périopératoires et à une intervention chirurgicale complexe. Néanmoins, ce système de classification présente quelques inconvénients car il ne reflète pas la profondeur de l’infiltration tumorale à travers la paroi des artères carotides, ce qui décide s’il est possible de préserver les artères carotides. Par conséquent, Luna-Ortiz, et al. a suggéré une modification du système de classification de Shamblin pour que Shamblin IIIb qui est cliniquement ou histologiquement confirmé s’infiltre dans l’adventice du vaisseau quelle que soit la taille de la tumeur.
Les diagnostics différentiels des TCC comprennent les lymphadénopathies réactives cervicales, les kystes cervicaux latéraux, les kystes brachiaux, les paragangliomes vagaux, les nodules thyroïdiens, les anévrismes de l’artère carotide et les tumeurs de la glande parotide. En plus de ceux-ci, l’hyperplasie du corps carotidien doit également être rappelée; elle peut se développer à cause d’une hypoxie chronique et est principalement décrite chez les patients vivant à haute altitude.
Les TCC ont des difficultés de diagnostic et de prise en charge, car il n’existe pas de lignes directrices dans la littérature pour leur diagnostic et leur traitement. Si un diagnostic de TCC est suspecté à la suite d’un examen physique détaillé, le diagnostic est presque toujours établi par des méthodes d’imagerie radiologique telles que l’échographie duplex, l’angiographie par tomodensitométrie, l’angiographie par résonance magnétique et l’angiographie par soustraction numérique. De nos jours, l’examen échographique est largement utilisé pour le dépistage car il s’agit d’une modalité d’imagerie facilement disponible et non invasive. De plus, dans leur revue multicentrique et leur méta-analyse, le Joint Vascular Research Group a recommandé que l’échographie duplex soit l’examen diagnostique principal pour le diagnostic des TCC. La tomodensitométrie et la résonance magnétique permettent d’évaluer la taille, le degré et le caractère invasif de la tumeur. Les méthodes angiographiques permettent l’évaluation des vaisseaux alimentant la tumeur et l’embolisation préopératoire. En raison de l’hypervascularisation et de la proximité de diverses structures vasculaires et nerveuses de ces tumeurs, la biopsie en tant que méthode de diagnostic est contre-indiquée car elle présente un risque d’hémorragie et de dissémination massives et peut également entraîner la formation de pseudoanévrysmes et une thrombose carotidienne.
La première ablation chirurgicale réussie de la TCC a été appliquée par Albert en 1889, et Gordon-Taylor a défini une dissection sous-adventice sûre en 1940. La dévascularisation des TCC par ligature des vaisseaux d’alimentation pendant la procédure est une méthode chirurgicale pratique courante depuis les années 1980. En 2008, van der Bogt, et al. a suggéré la technique de dissection craniocaudale qui minimiserait la perte de sang et réduirait ainsi le risque de morbidité périopératoire. De nos jours, l’excision chirurgicale reste la modalité thérapeutique de référence pour le traitement des TCC.
La radiothérapie (RT) est une modalité de traitement alternative qui peut diminuer la taille de la tumeur ou arrêter sa croissance. Il est recommandé pour les patients qui ne peuvent pas subir de chirurgie en raison d’une implication étendue, de tumeurs multiples et d’un risque opératoire et anesthésique élevé. Dans l’étude réalisée par Gilbo, et al. , qui est la plus grande série avec 156 cas de paragangliome traités par RT, les auteurs ont présenté leur expérience de 45 ans et ont observé une diminution de la taille de seulement 5 tumeurs (3,2%) et un manque de croissance tumorale après 5 ans chez 99% des patients.
La question de l’utilité de l’embolisation préopératoire est controversée. Selon certaines études, la procédure d’embolisation préopératoire est bénéfique car elle abaisse le flux sanguin et diminue la taille de la tumeur, ce qui peut faciliter l’élimination complète de la tumeur avec moins de perte de sang, en particulier dans les grosses tumeurs. D’autre part, dans certaines autres études, l’embolisation préopératoire n’était pas recommandée en raison non seulement de son inutilité, mais aussi du risque de morbidité postembolisée telle qu’un accident ischémique transitoire et même un accident vasculaire cérébral par des particules emboliques.
Les complications majeures concernant le traitement chirurgical des TCC comprennent des saignements secondaires à une lésion vasculaire, des déficits des nerfs crâniens et un accident vasculaire cérébral périopératoire. Les taux de complications sont en corrélation positive avec la classification de Shamblin. Davila, et coll. a rapporté que le taux de lésion permanente du nerf crânien était de 5,5% et que le taux d’AVC était de 1%, sans mortalité périopératoire dans leur série composée de 183 cas. Pacheco-Ojeda vient de présenter la plus grande série de cas de la littérature avec 215 TCC chirurgicalement excisées. Dans sa série de cas, le taux cumulé de complications était de 27,5%, et ces complications étaient pour la plupart mineures et liées à un dysfonctionnement du nerf crânien, sans accident vasculaire cérébral périopératoire ni décès. Une étude d’examen complète intrigante qui a examiné les complications de la chirurgie CBTS a récemment été publiée. Dans cette étude, un total de 625 cas de 19 études ont été examinés, et les taux de lésion transitoire du nerf crânien, de lésion vasculaire, de lésion permanente du nerf crânien, d’accident vasculaire cérébral et de mortalité périopératoire ont été trouvés comme suit: 31%, 28%, 17%, 2.5% et 0,5%, respectivement.
Indépendamment de l’âge du patient et de la taille de la tumeur, une ablation chirurgicale précoce des TCC est conseillée afin de prévenir le développement de tumeurs plus grandes et plus avancées (classe de Shamblin III), qui sont liées à une morbidité et une mortalité plus élevées. L’excision chirurgicale complète des TCC peut être techniquement difficile en raison de leur proximité avec les principales structures norovasculaires, ainsi que de l’anatomie complexe du cou. Pendant la chirurgie, toutes les structures neurovasculaires doivent être identifiées afin de diminuer la fréquence des complications. Le contrôle proximal et distal des artères carotides avec ligature des branches d’alimentation est important pour réaliser l’excision complète de la tumeur. En conclusion, l’excision chirurgicale des TCC est une procédure très efficace et sûre avec un faible taux de complications neurovasculaires majeures et de mortalité. La détection précoce et l’ablation chirurgicale complète des TCC améliorent les résultats.
- Sevilla García MA, Llorente Pendás JL, Rodrigo Tapia JP, García Rostán G, Suárez Fente V, et al. (2007) paragangliomes de la tête et du cou: révision de 89 cas chez 73 patients. Acta Otorrinolaringol Esp 58: 94-100.
- Jena A, Reddy GV, Kadiyala V, Brinda K, Patnayak R, Chowhan AK (2016) Un cas de tumeur du corps carotidien: défi chirurgical. L’Indien J Vasc Endovasc Surg 3:96-98.
- Dixon JL, Atkins MD, Bohannon WT, Buckley CJ, Lairmore TC (2016) Prise en charge chirurgicale des tumeurs du corps carotidien: une expérience de 15 ans en établissement unique utilisant une approche interdisciplinaire. Proc (Bayl Univ Med Cent) 29:16-20.
- Albsoul NM, Alsmady MM, Al-Aardah MI, Altaher RN (2009) Gestion et résultats du paragangliome du corps carotidien. Eur J Sci Res 37:567-574.
- Gratiot JH (1943) Tumeurs du corps carotidien: revue collective. Internat Abstr Surg 77:177-186.
- Jianu DC, Jianu SN, Motoc AG, Dan TF, Poenaru M, et al. (2016) Une évaluation sur la prise en charge multidisciplinaire des paragangliomes carotidiens: un rapport de sept cas. Rom J Morphol Embryol 57 (2 Suppl): 853-859.
- Toktas F, Yümün G, Gücü A, Göncü T, Eris C, et al. (2014) Procédures chirurgicales de protection pour les tumeurs du corps carotidien: une série de cas. Erciyes Med J 36, 133-135.
- Dorobisz K, Dorobisz T, Temporale H, ZatoÅ »ski T, et al. (2016) Difficultés diagnostiques et thérapeutiques dans les paragangliomes du corps carotidien, basées sur l’expérience clinique et une revue de la littérature. Adv Clin Exp Med 25:1173-1177.
- Shamblin WR, ReMine WH, Sheps SG, Harrison EG Jr (1971) Tumeur du corps carotidien (chimiodectome). Analyse clinicopathologique de quatre-vingt-dix cas. Am J Sourg 122:732-739.
- Luna-Ortiz K, Rascon-Ortiz M, Villavicencio-Valencia V, Herrera-Gomez A (2006) La classification de Shamblin prédit-elle la morbidité postopératoire dans les tumeurs du corps carotidien? Une proposition de modification de la classification de Shamblin. Eur Arch Oto-Rhino-Laryngol 263: 171-175.
- Sajid MS, Hamilton G, Baker DM, Joint Vascular Research Group (2007) A multicenter review of carotid body tumour management. Eur J Vasc Endovasc Surg 34:127-130.
- Ferrante AM, Boscarino G, Crea MA, Minelli F, Snider F (2015) paragangliomes cervicaux: expérience en centre unique avec 44 cas. Acta Oto-Rhino-laryngol Ital 35:88-92.
- Tong Y (2012) Rôle de l’échographie duplex dans le diagnostic et l’évaluation de la tumeur du corps carotidien: Une revue de la littérature. Intraitable Rare Dis Res 1:129-133.
- van der Mey AG, Jansen JC, van Baalen JM (2001) Gestion des tumeurs du corps carotidien. Oto-Rhino-laryngol Clin Nord Am 34: 907-924.
- Gordon-Taylor G (1940) Sur Les tumeurs carotidiennes. Br J Sourg 28, 163-172.
- van der Bogt KE, Vrancken Peeters MP, van Baalen JM, Hamming JF (2008) Résection des tumeurs du corps carotidien: résultats d’une technique chirurgicale en évolution. Ann Surg 247:877-884.
- Moore MG, Netterville JL, Mendenhall WM, Isaacson B, Nussenbaum B (2016) paragangliomes de la tête et du cou: Une mise à jour sur l’évaluation et la prise en charge. Oto-Rhino-Laryngol Tête Cou Surg 154:597-605.
- Carroll W, Stenson K, Stringer S (2004) Tumeur maligne du corps carotidien. Tête Cou 26:301-306.
- Gilbo P, Morris CG, Amdur RJ, Werning JW, Dziegielewski PT, et al. (2014) Radiothérapie pour les paragangliomes bénins de la tête et du cou: une expérience de 45 ans. Cancer 120:3738-3743.
- Persky MS, Setton A, Niimi Y, Hartman J, Frank D, et al. (2002) Traitement endovasculaire et chirurgical combiné des paragangliomes de la tête et du cou – une approche d’équipe. Cou de la tête 24:423-431.
- Kasper GC, Welling RE, Wladis AR, CaJacob DE, Grisham AD, et al. (2006) Une approche multidisciplinaire des paragangliomes carotidiens. Vasc Endovasculaire Surg 40: 467-474.
- Jackson RS, Myhill JA, Padhya TA, McCaffrey JC, McCaffrey TV, et al. (2015) Les effets de l’embolisation préopératoire sur la chirurgie du paragangliome du corps carotidien: Une revue systématique et une méta-analyse. Oto-Rhino-Laryngol Tête Cou Surg 153: 943-950.
- Zeitler DM, Glick J, Har-El G (2010) Embolisation préopératoire en chirurgie tumorale du corps carotidien: est-ce nécessaire? Ann Otol Rhinol Laryngol 119:279-283.
- Sen I, Stephen E, Malepathi K, Agarwal S, Shyamkumar NK, et al. (2013) Complications neurologiques dans les tumeurs du corps carotidien: une expérience de 6 ans en un seul centre. J Vasc Surg 57:64S-8S.
- Davila VJ, Chang JM, Stone WM, Fow RJ, Bower TC, et al. (2016) Prise en charge chirurgicale actuelle des tumeurs du corps carotidien. J Vasc Surg 64: 1703-1710.
- Pacheco-Ojeda LA (2017) Tumeurs du corps carotidien: Expérience chirurgicale dans 215 cas. J Craniomaxillofac Surg.
- Amato B, Serra R, Fappiano F, Rossi R, Danzi M, et al. (2015) Complications chirurgicales de la chirurgie des tumeurs du corps carotidien: une revue. Int Angiol 34:15-22.
Leave a Reply