Hydroxyde de sodium
Hydroxyde de sodium Propriétés chimiques, utilisations, Production
Propriétés chimiques
L’hydroxyde de sodium est un matériau alcalin blanc, inodore et non volatil commercialisé sous forme solide sous forme de pastilles, de flocons, de mottes ou de bâtonnets. Sa solubilité dans l’eau est de 111% en poids et une pression de vapeur de 0 mmHg (NIOSH, 1994).
Il peut réagir avec le tricholoéthylène (TCE) pour former du dichloroacétylène inflammable et avec les métaux pour former de l’hydrogène gazeux (OEHHA, 1993). Sa réactivité avec les métaux doit être prise en compte en ce qui concerne les unités de stockage et les conteneurs.
L’hydroxyde de sodium est couramment disponible sous forme de solution aqueuse connue sous le nom de soude caustique, de lessive de soude ou de lessive simple. Il a diverses utilisations, y compris la neutralisation de l’acide; la fabrication de papier, de textiles, de plastiques, de corrosifs, de colorants, de peinture, de décapant et de savon; raffinage du pétrole; galvanoplastie; nettoyage des métaux; blanchiment; et lavage de la vaisselle. La fabrication illégale de méthamphétamine est un usage croissant.
Utilisations
L’hydroxyde de sodium (NaOH) est l’un des composés industriels de sodium les plus utiles. Il est également connu sous le nom de lessive ou de soude caustique et est l’un des alcalis de base les plus puissants (valeur de pH élevée) sur le marché domestique. Il est utilisé comme nettoyant pour drain et four, et il saponifie les graisses dans la fabrication de savon. Il doit être utilisé avec précaution car il est également capable de produire de graves brûlures de la peau.
Description
L’hydroxyde de sodium, également connu sous le nom de lessive et de soude caustique, est une substance hautement caustique utilisée en petites quantités dans les cosmétiques pour établir et maintenir le pH d’un produit.L’hydroxyde de sodium est un composé extrêmement important dans nos vies car il a de nombreuses utilisations. C’est une base très courante utilisée dans l’industrie chimique et est utilisée pour beaucoup de choses, dont beaucoup se produisent dans notre vie quotidienne. L’une des utilisations les plus connues de l’hydroxyde de sodium est son utilisation dans les drains de débouchage. Il existe de nombreuses marques de nettoyeurs de drain, mais l’un des plus courants est le Drano. Il se présente également sous forme de savon à lessive qui peut être utilisé pour laver pratiquement n’importe quoi, de la vaisselle à votre visage.
structure de l’hydroxyde de sodium
À température ambiante, l’hydroxyde de sodium est un solide inodore cristallin blanc qui absorbe l’humidité de l’air. C’est une substance fabriquée. L’hydroxyde de sodium est un composé inorganique utilisé pour contrôler les niveaux de pH ou servir d’agent tampon dans les cosmétiques et les produits de soins personnels. Il était historiquement utilisé dans la formulation de savons, mais est actuellement utilisé dans une variété de formules, y compris les produits de bain, les produits nettoyants, les parfums, les poudres pour les pieds, les teintures et colorants capillaires, le maquillage, les produits pour les ongles, les produits de propreté personnelle, les shampooings, les produits de rasage, les dépilatoires, les produits de soins de la peau et les produits de bronzage, ainsi que les lisseurs chimiques et les ensembles de vague de cheveux. C’est également un ingrédient populaire dans les solvants industriels comme base chimique pour les savons, les nettoyants pour fours, les détergents et les nettoyants de vidange en raison de sa capacité à dissoudre la graisse, les huiles, les graisses et les dépôts à base de protéines, selon Wikipedia. Moins fréquemment, l’hydroxyde de sodium est considéré comme un ingrédient des dentifrices.
L’hydroxyde de sodium est approuvé par la FDA et a reçu la cote GRAS (Généralement reconnue comme sûre) en tant qu’additif alimentaire direct. Cependant, il est principalement utilisé dans le lavage et le peeling chimique des produits. Il est approuvé pour une utilisation dans les cosmétiques et les produits de soins personnels à des concentrations variables: 5% en poids dans les solvants pour cuticules des ongles, 2% en poids dans les lisseurs à usage général, 4,5% en poids dans les lisseurs à usage professionnel, jusqu’à un pH 12,7 dans les dépilatoires et jusqu’à pH 11 dans d’autres utilisations en tant qu’ajusteur de pH.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
Propriétés chimiques
L’hydroxyde de sodium, le NaOH, également appelé soude caustique ou hydrate de sodium (et anciennement connu sous le nom de lessive), est un solide cristallin blanc, massif et déliquescent soluble dans l’eau, l’alcool et le glycérol. Il fond à 318 ° C (606 DE) et est le produit chimique alcalin le plus utilisé et le plus disponible. La plupart de l’hydroxyde de sodium est produit en tant que coproduit du chlore grâce à l’utilisation de cellules électrolytiques; les cellules sont du type diaphragme, mercure ou membrane. Une partie de l’hydroxyde de sodium est marquée comme produite dans les cellules; la plupart est évaporée et vendue sous forme de solutions à 50% et 73% ou de billes anhydres. La plupart des utilisations finales caustiques nécessitent des solutions de concentrations relativement faibles. La soude caustique est utilisée comme réactif analytique et intermédiaire chimique, dans les bains de récurage et de nettoyage, dans la récupération du caoutchouc et le raffinage du pétrole, dans les bains de trempe pour le traitement thermique de l’acier, dans les huiles de coupe et solubles, dans les savons et les détergents, et dans une grande variété d’autres applications.
Propriétés chimiques
Le NaOH est un matériau déliquescent blanc, inodore, vendu sous forme de granulés, de flocons, de grumeaux ou de bâtonnets. Les solutions aqueuses sont connues sous le nom de lessive de soude
Propriétés chimiques
L’hydroxyde de sodium se présente sous la forme d’une masse fondue blanche ou presque blanche. Il est disponible en petits granulés, flocons, bâtons et autres formes ou formes. Il est dur et cassant et présente une fracture cristalline. L’hydroxyde de sodium est très déliquescent et, lorsqu’il est exposé à l’air, il absorbe rapidement le dioxyde de carbone et l’eau.
Propriétés physiques
Cristaux orthorhombiques blancs, produits sous forme de pastilles, de grumeaux, de bâtonnets, de billes, de copeaux, de flocons ou de solutions; hygroscopiques; très corrosifs; absorbe rapidement le CO2 et l’eau de l’air; densité 2,13 g / cm3; fond à 323 ° C; se vaporise à 1388 ° C; pression de vapeur 1 torr à 739 °C et 5 torr à 843 °C; très soluble dans l’eau (110 g/ 100 ml à température ambiante), générer de la chaleur lors de la dissolution; solutions aqueuses hautement alcalines, pH d’une solution à 0,5% environ 13 et d’une solution à 0,05% environ 12; soluble dans le méthanol, l’éthanol et le glycérol (23,8 g / 100 mL de méthanol et 13.9 g / 100 mL d’éthanol à température ambiante.).
Utilise
La soude caustique est l’une des plus largement utiliséesles produits chimiques. Il est utilisé pour neutraliser les acides; préparer les sels de sodium; précipiter les métaux comme leurs hydroxydes; dans le raffinage du pétrole; dans la aponification des esters; dans le traitement de la cellulose, des plastiques et du caoutchouc; et dans de nombreuses applications synthétiques et analytiques.
Utilisations
L’hydroxyde de sodium est vendu dans le commerce sous forme de flocons ou de granulés anhydres ou de solutions aqueuses à 50% ou 73%. Il a d’innombrables utilisations industrielles et est l’un des 10 principaux produits chimiques en termes de production et d’utilisation à l’échelle mondiale. Environ 15 millions de tonnes d’hydroxyde de sodium sont utilisées chaque année. Sa plus grande utilisation, consommant environ la moitié de sa production, sert de base à la production d’autres produits chimiques. Il est utilisé pour contrôler le pH et neutraliser les acides dans les processus chimiques. L’industrie papetière utilise largement l’hydoxyde de sodium dans le processus de réduction en pâte. L’hydroxyde de sodium est utilisé pour séparer les fibres en dissolvant la lignine de connexion. Il est utilisé de la même manière dans la production de rayonne à partir de cellulose. L’hydroxyde de sodium est un produit chimique clé dans le savon industry.In le processus de saponification, les triglycérides obtenus à partir d’animaux et de plantes sont chauffés dans une solution abasique pour donner du glycérol et du savon:
L’hydroxyde de sodium est utilisé dans l’industrie textile pour blanchir et traiter les textiles afin de les colorer plus facilement. L’industrie pétrolière utilise l’hydroxyde de sodium dans les boues de forage et le bactéricide asa. L’hypochlorite de sodium (NaOCl) est largement utilisé pour le nettoyage et comme désinfectant.L’eau de javel domestique commune se compose d’une solution d’hypochlorite de sodium à environ 5%. Le sodiumhypochlorite est préparé en faisant réagir du chlore avec de la soude : Cl2 (g) + 2NaOH (aq) → NaOCl (aq) + NaCl (aq) + H2O (l). L’hydroxyde de sodium est utilisé dans l’industrie alimentaire pour le nettoyageet éplucher les fruits et légumes. L’hydroxyde de sodium est un ingrédient mineur dans de nombreux produits ménagers courants, mais dans quelques-uns, il peut constituer plus de la moitié du produit. Les dranocristaux contiennent entre 30% et 60% d’hydroxyde de sodium et certains nettoyants de drain peuvent consister en 100% d’hydroxyde de sodium.
Utilisations
L’hydroxyde de sodium est un alcali soluble dans l’eau, ayant une solubilité de 1 g dans 1 ml d’eau. il est utilisé pour détruire les produits chimiques amers des olives qui doivent devenir des olives noires. il fonctionne également pour neutraliser les acides dans divers produits alimentaires.
Utilisations
l’hydroxyde de sodium est utilisé pour ajuster le pH d’un produit afin de le rendre plus acceptable pour la peau. Il est communément appelé soude caustique et sert souvent de réactif chimique lors de la fabrication du savon. S’il est trop concentré, il peut provoquer une grave irritation de la peau.
Utilisations
L’hydroxyde de sodium est l’un des produits chimiques industriels les plus importants. En volume, il figure parmi les dix produits chimiques les plus produits aux États-Unis. Il est utilisé dans la fabrication d’un grand nombre de composés dont plusieurs sels de sodium, dans le traitement de la cellulose pour la production de rayonne et de cellophane, et dans la fabrication de savons, de détergents, de pâtes et de papiers. L’hydroxyde de sodium est un agent neutralisant commun pour les acides dans les titrages acido-basiques et le raffinage du pétrole. Une autre application majeure consiste à extraire des métaux de leurs minerais où la fusion alcaline, telle que la fusion avec de la soude caustique, est souvent appliquée pour ouvrir les minerais. De plus, l’hydroxyde de sodium est utilisé pour précipiter les métaux sous forme d’hydroxydes. D’autres utilisations sont la récupération du caoutchouc, la dissolution de la caséine dans la production de plastiques, le raffinage des huiles végétales, le traitement des textiles, comme éluant en chromatographie ionique, la gravure et la galvanoplastie et comme réactif de laboratoire. L’hydroxyde de sodium est également utilisé comme base forte dans de nombreuses réactions de synthèse organique et catalysées par des bases.
Utilisations
Les solutions de NaOH sont utilisées pour neutraliser les acides et fabriquer des sels de sodium, par exemple dans le raffinage du pétrole pour éliminer les acides sulfuriques et organiques; pour traiter la cellulose dans la fabrication de rayonne viscose et de cellophane; pour récupérer le caoutchouc pour dissoudre le tissu; dans la fabrication de plastiques pour dissoudre la caséine. Les solutions de NaOH hydrolysent les graisses et forment des savons; elles précipitent les alcaloïdes (bases) et la plupart des métaux (sous forme d’hydroxydes) à partir des solutions aqueuses de leurs sels. Aide pharmaceutique (alcalinisant).
Préparation
L’hydroxyde de sodium est fabriqué avec du chlore par électrolyse d’une solution de chlorure de sodium. Différents types de cellules électrolytiques sont utilisés commercialement. Ils comprennent la cellule à mercure, la cellule à diaphragme et la cellule à membrane.
Une solution saturée de saumure est électrolysée. Le chlore gazeux est libéré à l’anode et l’ion sodium à la cathode. La décomposition de l’eau produit des ions hydrogène et hydroxyde. L’ion hydroxyde se combine avec l’ion sodium formant NaOH. Les réactions électrolytiques globales peuvent être représentées par:
2Na + + 2Cl – + 2H2O → Cl2(g) + H2(g) + 2NaOH (aq)
La cellule au mercure se déroule en deux étapes qui se produisent séparément dans deux cellules. La première est connue sous le nom de cellule de saumure ou d’électrolyseur primaire dans laquelle l’ion sodium se dépose sur la cathode au mercure formant un amalgame, tandis que le chlore gazeux est libéré à l’anode:
Na ++ Cl-→ Na-Hg (cathode) + ½Cl2(g) (anode)
Dans la deuxième cellule, dite cellule décomposeuse, une cathode en graphite est utilisée tandis que l’amalgame de sodium sert d’anode. L’eau réagit avec le métal sodique de l’amalgame dans le décomposeur:
Na-Hg + H2O → Na + + OH– + ½H2 + Hg
Dans les cellules à diaphragme chlore-alcali, un diaphragme est utilisé pour séparer le chlore libéré à l’anode de l’hydroxyde de sodium et de l’hydrogène généré à la cathode. Sans diaphragme, l’hydroxyde de sodium formé se combinera avec le chlore pour former de l’hypochlorite de sodium et du chlorate. Dans de nombreuses cellules, des diaphragmes d’amiante sont utilisés pour une telle séparation. De nombreux types de cellules à diaphragme sont disponibles.
L’hydroxyde de sodium est produit soit sous forme de solide anhydre, soit sous forme de solution aqueuse à 50%.
Définition
Le produit commercial le plus important.
Méthodes de production
L’hydroxyde de sodium est fabriqué par électrolyse de saumure à l’aide d’électrodes inertes. Le chlore évolue sous forme de gaz à l’anode etl’hydrogène évolue sous forme de gaz à la cathode. L’élimination du chlorureet des ions hydrogène laisse des ions sodium et hydroxyde en solution.La solution est séchée pour produire l’hydroxyde de sodium solide.
Une deuxième méthode utilise la cellule de Kellner–Solvay. Une solution saturée de chlorure de sodium est électrolysée entre une anode de carbone et une cathode de mercure en écoulement. Dans ce cas, le sodium est produit à la cathode plutôt qu’à l’hydrogène en raison de la préparation du sodium à se dissoudre dans le mercure. L’amalgame sodium-mercure est ensuite exposé à l’eau et une solution d’hydroxyde de sodium est produite.
Réactions
L’hydroxyde de sodium est fortement alcalin et peut réagir avec les acides pour former des sels et de l’eau.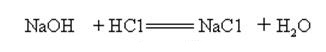
L’hydroxyde de sodium réagit avec les oxydes acides pour former du sel et de l’eau, de sorte que l’hydroxyde de sodium peut être utilisé pour absorber les gaz acides en laboratoire ou industriellement.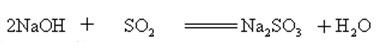
L’hydroxyde de sodium peut réagir avec des solutions aqueuses de nombreux sels métalliques pour former des sels de sodium et des hydroxydes métalliques
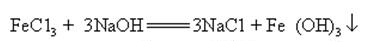
Lorsque l’hydroxyde de sodium et le sel d’ammoniac sont chauffés ensemble, il peut libérer de l’ammoniac
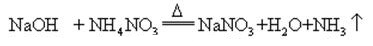
L’hydroxyde de sodium est très corrosif , de sorte que les bouteilles en verre stockant des solutions d’hydroxyde de sodium doivent être des bouchons en caoutchouc et que les bouchons en verre ne doivent pas être utilisés pour empêcher une réaction chimique de s’ouvrir. L’hydroxyde de sodium est une matière première industrielle importante, et peut être produit par électrolyse de solution saline industriellement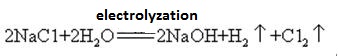
Description générale
Un solide blanc. Corrosif pour les métaux et les tissus. Utilisé dans la fabrication chimique, le raffinage du pétrole, les composés de nettoyage, les nettoyants de drain.
Air &Réactions à l’eau
Solubles dans l’eau. La dissolution peut libérer suffisamment de chaleur pour provoquer de la vapeur et des éclaboussures et enflammer les matériaux combustibles adjacents.
Profil de réactivité
LA SOUDE CAUSTIQUE (hydroxyde de sodium) est une base forte. Réagit rapidement et exothermiquement avec les acides, organiques et inorganiques. Absorbe facilement l’humidité de l’air pour donner des semi-solides caustiques qui attaquent l’aluminium et le zinc avec le dégagement d’hydrogène gazeux inflammable. Catalyse la polymérisation de l’acétaldéhyde et d’autres composés polymérisables; ces réactions peuvent se produire violemment, par exemple, l’acroléine polymérise avec une extrême violence lorsqu’elle est mise en contact avec des matériaux alcalins tels que l’hydroxyde de sodium. Réagit avec une grande violence avec le pentaoxyde de phosphore lorsqu’il est initié par un chauffage local. Le contact (comme agent de séchage) avec le tétrahydrofurane, qui contient souvent des peroxydes, peut être dangereux — des explosions se sont produites lors d’une telle utilisation de l’hydroxyde de potassium chimiquement similaire. Le mélange avec l’une des substances suivantes dans un récipient fermé a entraîné une augmentation de la température et de la pression: acide acétique glacial, anhydride acétique, acroléine, chlorhydrine, acide chlorosulfonique, cyanohydrine d’éthylène, glyoxal, acide chlorhydrique (36%), acide fluorhydrique (48,7%), acide nitrique (70%), oléum, propiolactone, acide sulfurique (96%). Un contact accidentel entre une solution de nettoyage caustique (contenant probablement de l’hydroxyde de sodium) et du pentol a provoqué une violente explosion. . Le chauffage avec un mélange d’alcool méthylique et de trichlorobenzène lors d’une tentative de synthèse a conduit à une augmentation soudaine de la pression et à une explosion. Le NaOH chaud et / ou concentré peut provoquer la décomposition exothermique de l’hydroquinone à température élevée. (Pub NFPA. 491M, 1975, 385)
Danger
Corrosif pour les tissus en présence de mois- ture, fortement irritant pour les tissus (yeux, peau, muqueuses et voies respiratoires supérieures), poison par ingestion.
Danger pour la santé
Forte action corrosive sur les tissus en contact. INHALATION: la poussière peut endommager les voies respiratoires supérieures et les poumons eux-mêmes, produisant une légère irritation du nez à une pneumopathie. INGESTION: dommages graves aux muqueuses; formation ou perforation sévère de cicatrice peut survenir. CONTACT VISUEL : produit de graves dommages.
Danger pour la santé
L’hydroxyde de sodium est une substance hautement corrosive qui endommage les tissus humains.Son action sur la peau est quelque peu différentede brûlures acides. Il n’y a pas de douleur immédiate, mais elle pénètre dans la peau. Il ne coagule pas la protéine pour empêcher sa pénétration ultérieure, et ainsi la brûlure caustique peut devenir sévère et une guérison lente. Le déversement de ses solutions concentrées dans les yeux peut entraîner de graves irritations ou des blessures permanentes.
Il est toxique par ingestion ainsi que par inhalation de sa poussière. Bien que la toxicité orale d’une solution de soude caustique à 5-10% ait été faible chez les animaux d’essai, des doses élevées à des concentrations plus élevées peuvent provoquer des vomissements, une prostration et un collapsus. La dose létale par voie orale chez le lapin est de 500 mg/kg (NIOSH, 1986).
Les poussières d’hydroxyde de sodium ou les aérosols sont irritants pour les yeux, le nez et la gorge. Exposition prolongée à des concentrations élevées dans l’airpeut produire une ulcération du passage nasal.
Risque d’incendie
Non combustible, la substance elle-même ne brûle pas mais peut se décomposer lors du chauffage pour produire des fumées corrosives et / ou toxiques. Certains sont des oxydants et peuvent enflammer des combustibles (bois, papier, huile, vêtements, etc.). Le contact avec les métaux peut faire évoluer de l’hydrogène gazeux inflammable. Les conteneurs peuvent exploser lorsqu’ils sont chauffés.
Inflammabilité et explosibilité
L’hydroxyde de sodium et l’hydroxyde de potassium ne sont pas inflammables sous forme de solides ou de solutions aqueuses.
Applications pharmaceutiques
L’hydroxyde de sodium est largement utilisé dans les formulations pharmaceutiques pour ajuster le pH des solutions. Il peut également être utilisé pour réagir avec de faibles acides pour former des sels.
Utilisations industrielles
La soude caustique (NaOH) est considérée comme le régulateur de pH alcalin le plus puissant. La soude caustiqueest une substance très active et est très corrosive. La majeure partie de la soude caustique est fabriquéepar électrolyse de saumures saturées (NaCl). La soude caustique a une très forte capacité de régulation de pH (c’est-à-dire de pH 7 à pH 14) à un dosage relativement faible par rapport à d’autres substances alcalines. Commercialement, la soude caustique est disponible sous forme anhydre, mais dans la plupart des applications minières, la soude caustique est fournie sous forme de solution à 50%.
Dans l’industrie de traitement des minéraux, l’hydroxyde de sodium est principalement utilisé pour le contrôle de l’alcalinité lors du traitement des minéraux non métalliques. Dans la flottation des métaux de base, l’utilisation dehydroxyde de sodium est rare.
Profil de sécurité
Poison par voie intrapéritonéale. Modérément toxique par ingestion. Données de mutation rapportées. Irritant corrosif pour la peau, les yeux et les muqueuses. Lorsqu’il est chauffé pour se décomposer, il émet des vapeurs toxiques de NanO.
Sécurité
L’hydroxyde de sodium est largement utilisé dans les industries pharmaceutique et alimentaire et est généralement considéré comme un matériau non toxique à faible concentration. À des concentrations élevées, c’est un irritant corrosif pourla peau, les yeux et les muqueuses.
DL50 (souris, IP): 0,04 g / kg
DL50 (lapin, oral): 0,5 g / kg
Exposition potentielle
Le NaOH est utilisé pour neutraliser les acides et fabriquer des sels de sodium dans le raffinage du pétrole, la rayonne viscose; la cellophane, la production de plastique; et dans la récupération des solutions de leurs sels. Il est utilisé dans la fabrication de coton mercerisé, de papier, d’explosifs et de colorants dans le nettoyage des métaux; extraction électrolytique du zinc; étamage; revêtement d’oxyde; blanchiment, blanchiment, lavage de la vaisselle; et il est utilisé dans les industries chimiques.
stockage
des protège-éclaboussures et des gants imperméables doivent être portés en tout temps lors de la manipulation de ces substances pour éviter tout contact avec les yeux et la peau. Les opérations avec des solutions d’hydroxydes métalliques susceptibles de créer des aérosols doivent être effectuées dans un fumoir pour prévenir l’exposition par inhalation. NaOH et KOH génèrent une chaleur considérable lorsqu’ils sont dissous dans l’eau; lors du mélange avec de l’eau, ajoutez toujours des caustiques lentement à l’eau et remuez continuellement. N’ajoutez jamais d’eau en quantités limitées à des hydroxydes solides. Les récipients d’hydroxydes doivent être stockés dans un endroit frais et sec, séparés des acides et des substances incompatibles.
stockage
L’hydroxyde de sodium doit être conservé dans un récipient hermétique non métallique dans un endroit frais et sec. Lorsqu’il est exposé à l’air, l’hydroxyde de sodium absorbe rapidement l’humidité et se liquéfie, mais redevient solide par la suite en raison de l’absorption du dioxyde de carbone et de la formation de carbonate de sodium.
Expédition
UN1823 NaOH, solide, Classe de danger: 8; Étiquettes: 8 – Matière corrosive. UN1824 NaOH, solution, Classe de danger: 8; Étiquettes: 8 – Matériau corrosif
Méthodes de purification
Les impuretés courantes sont l’eau et le carbonate de sodium. L’hydroxyde de sodium peut être purifié en dissolvant 100g dans 1L d’EtOH pur, en filtrant la solution sous vide à travers un disque de verre fritté fin pour éliminer les carbonates et les halogénures insolubles. (Cette opération et les opérations suivantes doivent être effectuées dans une boîte sèche sans CO2.) La solution est concentrée sous vide, en utilisant un chauffage doux, pour donner une suspension épaisse du mono-alcoolate qui est transférée sur un disque de verre fritté grossier et évacuée sans liqueur mère. Après avoir lavé les cristaux plusieurs fois avec de l’alcool purifié pour éliminer les traces d’eau, ils sont séchés sous vide, avec un léger chauffage, pendant environ 30 heures pour décomposer l’alcoolate, laissant une fine poudre cristalline blanche. CAUSTIQUE. Solutions d’hydroxyde de sodium (caustique), 14.77. L’ion carbonate peut être éliminé par passage à travers une colonne échangeuse d’anions (telle que l’Amberlite IRA-400; forme OH–). La colonne doit être fraîchement préparée à partir de la forme chlorure par passage lent préalable d’une solution d’hydroxyde de sodium jusqu’à ce que l’effluent ne donne aucun test pour les ions chlorure. Après utilisation, la colonne peut être régénérée par lavage avec du HCl dilué, puis de l’eau. De même, d’autres ions métalliques sont éliminés lorsqu’une solution de NaOH 1M (ou plus diluée) est passée à travers une colonne de résine A-1 échangeuse d’ions Dowex sous sa forme Na +-. Alternativement, la contamination par le carbonate peut être réduite en rinçant rapidement des bâtonnets de NaOH (analytical reagent quality) avec de l’H2O, puis en les dissolvant dans de l’H2O distillé, ou en préparant une solution aqueuse concentrée de NaOH et en soutirant le liquide surnageant clair. (Le Na2CO3 insoluble est laissé pour compte.) La contamination carbonatée peut être réduite en ajoutant un léger excès de BaCl2 concentré ou de Ba(OH)2 à une solution de NaOH, en agitant bien et en laissant le précipité de BaCO3 se déposer. Si la présence de Ba dans la solution est inacceptable, une purification électrolytique peut être utilisée. Par example, l’amalgame de sodium est préparé par électrolyse de 3L de NaOH à 30% avec 500mL de mercure pur pour cathode, et une anode de platine, passant 15 jours à 4 ampères, dans un flacon en polyéthylène à paroi épaisse. La bouteille est ensuite équipée de tubes d’entrée et de sortie, la solution usée étant évacuée par du N2 sans CO2. L’amalgame est ensuite soigneusement lavé avec un grand volume d’eau désionisée (avec le courant d’électrolyse activé pour minimiser la perte de Na). Enfin, une tige d’acier propre est mise en contact dans la solution avec l’amalgame (pour faciliter le dégagement d’hydrogène), la réaction pouvant se poursuivre jusqu’à atteindre une concentration appropriée, avant d’être transférée dans une cuve de stockage et diluée selon les besoins.
Incompatibilités
Une base forte et un oxydant fort. Réaction violente avec l’acide. Incompatible avec l’eau; liquides inflammables; halogènes organiques, nitrométhane et nitrocomposés, combustibles. Absorbe rapidement le dioxyde de carbone et l’eau de l’air. Le contact avec l’humidité ou l’eau peut générer de la chaleur. Corrosif pour les métaux. Contact avec le zinc, l’aluminium, l’étain et le plomb en présence d’humidité, formant de l’hydrogène gazeux explosif. Attaque certaines formes de plastiques, de caoutchouc ou de revêtements.
Incompatibilités
L’hydroxyde de sodium est une base forte et est incompatible avec tout composé qui subit facilement une hydrolyse ou une oxydation. Il réagira avec les acides, les esters et les éthers, en particulier en solution aqueuse.
Élimination des déchets
Décharger dans un réservoir contenant de l’eau, neutraliser, puis rincer à l’égout avec de l’eau.
Statut réglementaire
GRAS listé. Accepté comme additif alimentaire en Europe.Inclus dans la base de données des ingrédients inactifs de la FDA (préparations dentaires; injections; inhalations; préparations nasales, ophtalmiques, orales, otiques, rectales, topiques et vaginales). Inclus dans les médicaments non parentéraux et parentéraux autorisés au Royaume-Uni. Inclus dans la Liste canadienne des Ingrédients non médicinaux acceptables.
Leave a Reply