Composés covalents
Vous avez maintenant une brève idée des raisons pour lesquelles les différents éléments se comportent différemment. Mais savez-vous qu’une grande partie de cela est due à la « nature” des liaisons dans les composés. Tout comme vous et vos meilleurs amis avez un certain nombre de différences en raison des qualités « intérieures”, c’est le cas des composés ioniques et covalents. Dans ce chapitre, nous en apprendrons plus sur le concept de composés covalents, examinerons leurs propriétés et plus encore.
Suggested Videos
What is a Covalent Compound?
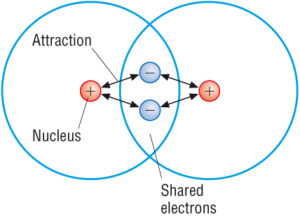
Covalent compounds are the ones having strong intra-molecular bonds. En effet, les atomes des molécules covalentes sont très étroitement liés. Chaque molécule est en effet assez distincte et la force d’attraction entre les molécules individuelles dans un composé covalent a tendance à être faible.
Nous avons besoin de très peu d’énergie pour séparer les molécules. Ceci est dû aux forces d’attraction entre les molécules avec l’absence de charge électrique globale. Les composés covalents sont généralement des molécules gazeuses à température et pression ambiantes. Il peut également s’agir de liquides ayant des points d’ébullition relativement bas.
Ces caractéristiques pourraient être attribuées à leurs faibles forces intermoléculaires qui maintiennent ces atomes ensemble. Cependant, nous avons également beaucoup de composés covalents solides. Ils ont de faibles points de fusion. Cependant, il est intéressant de noter qu’un petit nombre d’entre eux ont une structure complètement différente. Ils forment d’énormes structures où un grand nombre d’atomes sont maintenus ensemble. Ceci est possible en raison de la présence d’électrons partagés.
Ces structures moléculaires géantes sont essentiellement des réseaux constitués de molécules qui sont maintenues ensemble par une structure de liaisons covalentes. Ces liaisons covalentes sont très fortes. Ils ont également tendance à être très durs avec des points de fusion élevés qui sont différents de la plupart des composés covalents. L’exemple de ce type de composés covalents comprend le diamant et le graphite de réseau d’atomes de carbone. Ils comprennent également la silice du réseau d’atomes de silicium et d’oxygène.
Téléchargez le PDF de la Feuille de triche de liaison chimique en cliquant sur le bouton de téléchargement ci-dessous


Parcourez plus de sujets sous Liaison chimique et Structure moléculaire h3>
- Paramètres de Liaison
- Principes fondamentaux de la Liaison chimique
- Hybridation
- Liaison hydrogène
- Composés Ioniques ou Électrovalents
- Théorie de l’Orbitale moléculaire
- Polarité des Liaisons
- Structures de Résonance
- Liaison de valence Théorie
- Théorie VSEPR
Propriétés générales des composés covalents
- Les composés covalents ont généralement de faibles points de fusion. Une exception à cela comprend les molécules de silice et de diamants qui ont un point de fusion élevé.
- Ces composés ont de faibles points d’ébullition. Cela peut être attribué à leur faible force d’attraction entre les différents atomes liés. Les forces de Van Der Waals lient ces atomes.
- Ces composés sont généralement des gaz et des liquides à faible point d’ébullition et de fusion.
- Les composés covalents solides ont des structures molles comme le graphite. Cela est dû à la présence d’un nuage d’électrons entre chaque couche d’atomes de carbone.
- Ces composés sont des non conducteurs de charge électrique. L’absence d’ions chargés en est la principale raison. Une exception à cela est le graphite, où nous voyons un nuage d’électrons. Ceux-ci font du graphite un bon conducteur.
- Ce sont également de mauvais conducteurs de chaleur. Leurs molécules manquent d’électrons libres et cela obstrue le flux d’énergie thermique.
- Les composés covalents ne possèdent pas de caractéristiques polaires en tant que propriété générale. Par conséquent, ces composés sont insolubles dans l’eau. Les molécules d’eau ne sont pas absolument neutres et ont une légère charge négative sur l’atome d’oxygène et de légères charges positives sur les atomes d’hydrogène et puisque les composés covalents sont constitués de molécules neutres ou de molécules avec de légères charges et ne sont donc pas fortement attirés par les molécules d’eau.
(Source: Google)
Propriétés physiques Et Chimiques
- Les composés covalents liquides s’évaporent. Cela signifie que les molécules de liquides et de solides perdent de leur surface dans l’air.
- Ces composés ont très peu d’affinité entre leurs molécules.
- Divers composés covalents ont leurs propres molécules de forme caractéristique. Leurs liaisons sont dirigées à des angles prédéfinis.
- Certains composés, en particulier les médicaments, sont solubles dans l’eau. Le reste est soluble dans l’huile.
- La plupart des composés covalents sont non polaires ou ont très peu tendance à se diviser complètement pour former des ions et ne conduisent donc jamais d’électricité.
- À température et pression normales, on trouvera ces composés sous forme de liquides ou de gaz. Mais, il y a aussi des solides et ils ont des poids moléculaires plus élevés.
- Les cristaux de composés covalents sont de deux types: Un qui a une faible force de van der Waal les maintenant ensemble comme dans l’Iode. Ceux-ci sont facilement fusibles et volatils L’autre ayant un grand réseau d’atomes mettant en place les macromolécules.
- Ces composés sont solubles dans les solvants organiques comme l’éther et le benzène.
- Les liaisons covalentes sont de nature directionnelle. Par conséquent, ils présentent le phénomène d’isomérie.
- Les composés covalents ont principalement une vitesse de réaction très lente, contrairement aux différents composés ioniques.
Exemples résolus pour vous
Propriétés générales des composés covalents

(Source: Google)
Propriétés physiques Et Chimiques
Question:Pourquoi les composés covalents ne sont-ils pas solubles dans l’eau?
Réponse : Les molécules d’eau ne sont pas absolument neutres. Ces molécules ont une légère charge négative sur l’atome d’oxygène et de légères charges positives sur les atomes d’hydrogène. Par contre, on sait que les composés covalents sont constitués de molécules neutres ou de molécules à faibles charges. C’est pour cette raison que ces composés ne sont pas fortement attirés par les molécules d’eau.
Leave a Reply