CIMAvax-EGF: Un nouveau vaccin thérapeutique contre le cancer du poumon avancé
RAPPORT
CIMAvax-EGF: Un nouveau vaccin thérapeutique contre le cancer du poumon avancé
Gisela González1, Agustin Lage1, Tania Crombet1, Gryssel Rodríguez1, Beatriz García1, Ariadna Cuevas1, Lisel Viña1, Norkis Arteaga1, Elia Neninger2
1Centre d’immunologie moléculaire, CIMAve. 216 corner 15, Atabey, Playa, POBox 16 040, La Havane, Cuba
2Hermanos Ameijeiras HospitalSan Lázaro #701 e / Belascoín y Marqués González, Centro Habana, La Havane, Cuba.
RÉSUMÉ
Les résultats permettant à l’Agence de réglementation cubaine (CECMED) d’accorder l’enregistrement sanitaire du vaccin anticancéreux CIMAvax-EGF pour le cancer du poumon non à petites cellules avancé (CPNPC) sont présentés. Il s’agissait du premier enregistrement d’un vaccin thérapeutique à Cuba et également du premier enregistrement d’un vaccin contre le cancer du poumon dans le monde. Par conséquent, un vaccin thérapeutique unique est offert aux patients atteints de cancer du poumon, ce qui augmentera la survie et leur qualité de vie. À cette fin, d’importants défis précliniques, cliniques, réglementaires, productifs et de négociation devaient être rencontrés. Les résultats obtenus dans ces domaines ont donné lieu à 18 articles scientifiques publiés dans des revues à fort impact et à 4 objets d’invention, générant plusieurs brevets à Cuba et dans d’autres pays. Dans le cadre préclinique, l’immunogénicité, l’innocuité et les effets anti-tumoraux ont été démontrés chez différentes espèces animales. L’expérience clinique a commencé en 1995. Jusqu’à présent, cinq essais cliniques de phase I à II ont pris fin à Cuba, deux de phase II ont également pris fin, un à Cuba et un autre au Canada et au Royaume-Uni, et un essai de phase II à III avec un calendrier optimisé ainsi qu’un essai de phase III sont actuellement en cours à Cuba. Dans le domaine de la réglementation, une stratégie d’enregistrement accélérée a été conçue et mise en œuvre. Il a fallu de nouvelles conceptions réglementaires pour développer ce produit unique. Un processus de production évolutif, reproductible et contrôlé a été mis en œuvre, ainsi qu’un système de qualité garantissant une conformité totale aux BPF. Les fonds pour le développement de produits provenaient de la mise en œuvre d’une nouvelle stratégie de négociation: la négociation des actifs incorporels.
Mots clés: Vaccin contre le cancer, CPNPC, Enregistrement accéléré, CIMAvax-EGF, Essai clinique de phase II-III
INTRODUCTION
La relation entre le système formé par le récepteur du Facteur de Croissance Épidermique (EGFR) et ses ligands avec le développement du cancer est bien connue. Dans les tumeurs d’origine épidermoïde, il existe une surexpression de l’EGFR qui se rapporte à de mauvais pronostics et à des rechutes précoces après une intervention chirurgicale. C’est pourquoi ce système est devenu une cible importante pour les thérapies antitumorales.
Les mécanismes de prolifération cellulaire sont initiés par la liaison de l’EGF à l’EGFR. Notre approche thérapeutique consiste en un vaccin avec une formulation EGF le rendant immunogène et induisant une réponse immunitaire humorale. La production d’anticorps anti-EGF spécifiques qui se lient à l’EGF autologue, l’empêche de se lier à l’EGFR, déclenchant ainsi les mécanismes de prolifération cellulaire dérivés de cette interaction (1-4).
Nous rapportons ici les résultats de l’enregistrement à Cuba de ce vaccin (CIMAvax-EGF). Cette initiative s’inscrivait dans le cadre d’une stratégie mondiale comprenant de nouvelles contributions cliniques, réglementaires, technologiques et commerciales, et est soutenue par 18 articles scientifiques internationaux et la propriété intellectuelle dans le monde entier. Nous décrivons également les innovations dans différents domaines qui ont permis l’enregistrement de CIMAvax-EGF à Cuba et au Pérou.
RÉSULTATS ET DISCUSSION
La vaccination par l’EGF est sûre, immunogène et augmente la survie avec une bonne qualité de vie chez les patients à un stade avancé du cancer du poumon
L’expérience clinique avec CIMAvax-EGF dans le traitement du cancer du poumon non à petites cellules (CPNPC) à un stade avancé a commencé en 1995. Jusqu’à présent, cinq essais cliniques de phase I à II ont été terminés à Cuba; 2 essais cliniques randomisés de phase II ont été terminés, un à Cuba et un autre au Canada et au Royaume-Uni, et un essai de phase III est en cours à Cuba. Plus de 800 patients atteints d’un cancer avancé ont été traités avec CIMAvax–EGF, démontrant ainsi qu’il est sûr, immunogène et capable d’augmenter la survie avec une bonne qualité de vie.
L’objectif principal des essais de phase I-II était de décider de la meilleure formulation vaccinale (protéine porteuse et adjuvant), de la dose et du calendrier thérapeutique. Ces résultats ont démontré les avantages de la protéine P64k comme protéine porteuse et du Montanide ISA51 comme adjuvant. L’immunogénicité accrue de l’augmentation de la dose a également été démontrée (5-7).
L’analyse des données regroupées de tous les essais de phase I à II a montré une augmentation significative de la survie chez les patients présentant de meilleures réponses anticorps ou de bons répondeurs anticorps (GAR), et chez les patients présentant une diminution plus prononcée des concentrations de sérum EGF () résultant de la vaccination. Une augmentation significative de la survie de tous les patients vaccinés a également été démontrée par rapport à un contrôle historique simultané (7).
Un essai clinique de phase II a été réalisé chez 80 patients, qui ont été randomisés pour recevoir le CIMAvax-EGF et les meilleurs soins de soutien (BSC) (40 patients) ou BSC seul (40 patients), après la conclusion de la chimiothérapie de première intention. Les conclusions précédentes ont été corroborées dans cet essai. Environ 50% des patients vaccinés étaient GAR et ont survécu beaucoup plus que les patients qui n’atteignaient pas la classification GAR (qui étaient classés comme de faibles répondeurs en anticorps, PAR). De même, les patients présentant la plus forte diminution de la survie ont beaucoup plus survécu que les patients qui n’avaient pas montré cette diminution (tableau 1). Une corrélation inverse significative a été observée entre les titres d’anticorps anti-EGF et, qui s’est produite chez les patients vaccinés mais pas chez les témoins, démontrant ainsi qu’elle était causée par la vaccination (figure 1).
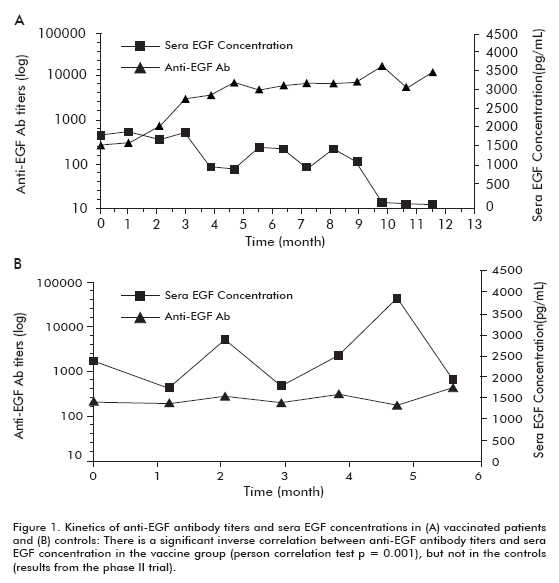
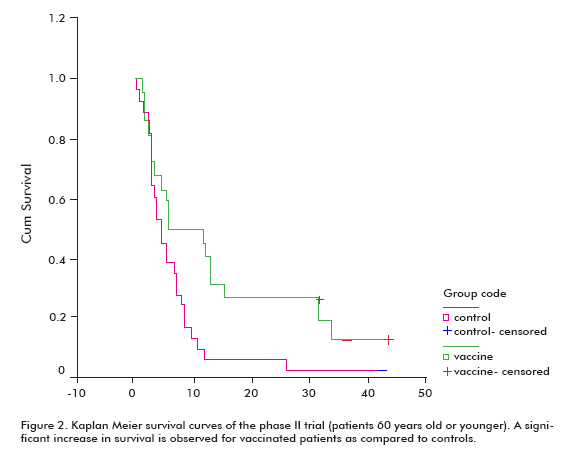
Il y avait une tendance accrue à la survie chez tous les patients vaccinés (18,53 ± 11,47; moyenne ± médiane), par rapport aux témoins non vaccinés (7,55 ± 5.33), ce qui était significatif dans le groupe de patients âgés de 60 ans ou moins (test de rang Log; p < 0,05) (Figure 2) (8).
Comme mis en évidence dans un test de compétition in vitro, les sérums de patients vaccinés ont inhibé la liaison de l’EGF à l’EGFR. Cette inhibition de liaison était proportionnelle aux titres d’anticorps et à la survie. De plus, les sérums de patients vaccinés ont inhibé la phosphorylation de l’EGFR proportionnellement à ses titres d’anticorps anti-EGF.
La reconnaissance préférentielle du site de liaison EGF/EGFR (boucle B de la molécule EGF) a été étudiée. Les patients dont les sérums reconnaissent préférentiellement la boucle B ont survécu significativement plus que les patients qui ne reconnaissent pas cet épitope (9).
Un essai d’optimisation de la dose/du calendrier a récemment été conclu à Cuba (phase I-II). Dans sa conception, tous les éléments augmentant l’immunogénicité dans les essais précédents ont été pris en compte, notamment: Montanide ISA51 comme adjuvant, augmentation des doses, quatre sites d’injection et administration de deux doses de vaccin avant la chimiothérapie de première intention, suivie de la vaccination. Les résultats de cet essai ont démontré une augmentation significative de l’immunogénicité, avec 95% de GAR atteignant dix fois les titres d’anticorps maximaux précédents. Tous les patients vaccinés ont beaucoup plus survécu que les témoins de l’essai de phase II (10).
Une capacité accrue des sérums des patients à inhiber la liaison EGF/ EGFR et la phosphorylation de l’EGFR a également été trouvée. Au septième mois, après la fin de la chimiothérapie, la réponse anticorps s’est déplacée vers la boucle B de la molécule EGF, ce qui pourrait indiquer une amélioration de la qualité de la réponse immunitaire. Les résultats de cet essai ont démontré qu’il existe une marge d’amélioration de la réponse au CIMAvax-EGF qui peut être atteinte en manipulant la dose et le calendrier thérapeutique (10).
Les résultats de ces essais sont en cours de validation dans un essai de phase III actuellement en cours à Cuba.
Conception et mise en œuvre d’une stratégie réglementaire pour l’enregistrement du vaccin afin de le rendre accessible à tous les patients atteints de cancer du poumon non à petites cellules avancés
CIMAvax-EGF est un vaccin thérapeutique contre le cancer du poumon unique au monde. Une stratégie mondiale a été conçue et mise en œuvre; elle a été guidée par les exigences réglementaires, pour l’enregistrement accéléré à Cuba. Une relation étroite entre le promoteur (CIM) et l’Agence de réglementation cubaine (CECMED) avait pour but d’établir les exigences pour l’obtention d’un produit et son application rapide au bénéfice des patients atteints d’un cancer avancé sans autre alternative thérapeutique. Cette stratégie comprenait la conception d’un système de qualité, des contrôles et des spécifications de qualité, ainsi que des exigences en matière de BPF pour couvrir les différentes étapes du développement du produit. Cette stratégie globale peut être utilisée dans le développement d’autres produits similaires.
L’expérience et la documentation réglementaires accumulées ont conduit à l’approbation d’essais cliniques dans différents pays. Le dossier contenant toutes les informations a permis d’enregistrer CIMAvax-EGF à Cuba et au Pérou. Nous pouvons donc affirmer que nous avons une stratégie définie pour l’enregistrement des médicaments dans différents pays.
Le processus de production GMP qui génère un produit évolutif, cohérent et conforme aux spécifications
Le premier défi pour concevoir un processus de production pour CIMAvax-EGF était d’avoir une préparation immunogène de l’EGF. Il a été obtenu par conjugaison chimique de l’EGF recombinant humain à la protéine membranaire recombinante, P64k (de Neisseria meningitidis). Le conjugué est injecté avec un adjuvant approprié (actuellement le Montanide ISA 51 de Seppic, France).
Un procédé à l’échelle du laboratoire a été initialement conçu. Un processus sanitaire et reproductible évolutif (et évolutif) a ensuite été conçu et mis en œuvre, conformément aux directives BPF. Des tests analytiques in vitro et in vivo ont également été conçus et mis en œuvre pour évaluer la qualité des matières premières et des produits intermédiaires et finaux.
Toutes les modifications ont été évaluées et appuyées par la stratégie réglementaire actuelle. Les résultats de l’étude d’équivalence, pour comparer les deux produits, ont reçu l’approbation par CECMED de la demande de procédé à l’échelle, et l’approbation du produit obtenu dans ce procédé pour son utilisation clinique. La mise à l’échelle et l’optimisation du processus de production ont fait place à une publication (11) et à un nouvel objet d’invention, avec des brevets présentés par la suite dans différents pays.
La négociation d’actifs incorporels nous a permis de financer le développement de projets et d’acquérir de l’expérience dans notre travail conjoint avec les autorités réglementaires de différents pays
Ce projet a été négocié avec des homologues étrangers sur la base du nouveau concept de « négociation d’actifs incorporels”, soutenu principalement par la propriété intellectuelle de notre produit en cours de développement. Cette stratégie de négociation consistait à autoriser le projet pour son développement conjoint avec d’autres pays, ce qui signifie que les homologues étrangers couvraient les frais des actions réglementaires et des essais cliniques sur leurs territoires. À la suite de ces négociations, Cuba a reçu des paiements pour des jalons. Cette modalité de négociation nous a également permis d’avoir un échange constant avec des spécialistes d’ici et d’ailleurs, augmentant ainsi notre expérience. Nos résultats positifs avec cette modalité de négociation pourraient être appliqués à d’autres produits en cours dans notre pays.
PERTINENCE DE L’ÉTUDE
CIMAvax-EGF est le premier vaccin thérapeutique pour le traitement du cancer enregistré à Cuba et le premier enregistré au monde pour le traitement du cancer du poumon. Le cancer du poumon est un problème de santé non résolu avec plus de 1,3 million de cas diagnostiqués chaque année et le même nombre de décès dans le monde. À Cuba, c’est la principale cause de décès par cancer chez les deux sexes avec une incidence de plus de 4000 décès par an. La thérapie de choix pour les patients diagnostiqués à un stade avancé est celle de la chimiothérapie de première intention, qui peut être administrée en même temps que la radiothérapie. Il s’agit d’un traitement palliatif, non curatif, avec une réponse complète à la chimiothérapie très rare, et des réponses objectives (complètes ou partielles) survenant chez seulement 25% des patients.
CIMAvax-EGF offre un traitement alternatif pour ces patients qui ont déjà reçu une chimiothérapie de première intention. Les effets indésirables graves des traitements de chimiothérapie et/ou de radiothérapie sont bien connus et détériorent gravement la qualité de vie. Au lieu de cela, la vaccination avec CIMAvax-EGF ne génère que des événements indésirables légers ou modérés, plutôt que graves, qui peuvent être résolus avec des soins de soutien conventionnels, tout en améliorant la survie des patients atteints d’un cancer du poumon avancé et en offrant une bonne qualité de vie.
Jusqu’à présent, plus de 800 Cubains ont été traités avec CIMAvax-EGF dans plus de 20 hôpitaux à travers le pays. L’enregistrement de CIMAvax-EGF permet de l’étendre à tous les patients du pays qui ont reçu un diagnostic de cancer du poumon avancé; faisant ainsi de Cuba le premier pays au monde doté d’un programme national utilisant cette alternative thérapeutique.
En ce qui concerne les avantages économiques, grâce aux négociations de ce projet, nous avons obtenu 6,346 millions USD. La stratégie de négociation du projet vise son développement conjoint avec d’autres pays, ce qui signifie que la contrepartie étrangère couvre les frais des essais cliniques dans leur propre pays, ce qui le rend abordable. Ces essais nécessitent des investissements de millions de dollars, ce qui n’est possible que s’il est soutenu par des homologues étrangers. Dans le même temps, cette stratégie offre plus de données cliniques à Cuba, sans les frais de réalisation des essais ici. Jusqu’à présent, des essais cliniques ont été réalisés au Canada, au Royaume-Uni et en Malaisie. Dans un avenir proche, des essais cliniques commenceront en Chine et en Europe.
De plus, dans le cadre de cette stratégie de licence, les homologues étrangers sont en charge de l’enregistrement des produits dans les régions où ils ont des droits commerciaux. Pendant les processus d’enregistrement et de commercialisation, Cuba recevra des paiements pour les jalons et plus tard, sous forme de redevances de vente.
Le marché mondial des vaccins contre le cancer est considéré comme de l’ordre de milliards de dollars. Le fait que Cuba dispose d’un produit unique pour le traitement avancé du cancer du poumon peut nous fournir un potentiel d’exportation qui peut financer l’utilisation de ce produit dans notre système de santé national.
CONCLUSIONS
La vaccination par CIMAvax-EGF est sûre, immunogène et entraîne une augmentation de la survie avec une bonne qualité de vie chez les patients atteints de tumeurs pulmonaires à un stade avancé. La conception et la mise en œuvre d’une stratégie réglementaire pour l’enregistrement de ce vaccin l’ont rendu disponible pour tous les cas de patients atteints d’un cancer du poumon non à petites cellules à un stade avancé à Cuba. Cette expérience positive pourrait s’appliquer à d’autres produits similaires en cours. Un processus de production évolutif, cohérent et reproductible, conforme aux directives BPF, a été développé pour générer un produit conforme aux spécifications. L’expérience de la négociation des actifs incorporels a été très positive et nous a permis de financer le développement de projets, tout en soutenant l’expérience d’apprentissage issue d’un travail conjoint avec les autorités de régulation de différents pays.
REMERCIEMENTS
Les auteurs tiennent à remercier les spécialistes suivants du Centre d’immunologie moléculaire pour leur contribution à ce travail: Rolando Pérez, Loany Calvo, Suhamy Attention, Belinda Sánchez, Irene Beausoleil, Ernesto Chico, Airama Alvisa, Ileana Carroman, Sergio Tasting, Ana Veloso, Reinaldo Crow, Yanelda Lopez, Yosniel Hernández, Antonio Vallin, Alejandro Portillo, Liuva Wood, Guido Ferrer, Diana Borges, Niuvis Pérez, Tamara García, Idaine Basin, Mayra Santaelena, Joaquin Solozabal, Aida Rodriguez, Maria Elena Garcia, Addis Torres, Eric Chong, Carmen Roll, Maurice Catala, Soraida Acosta, Barbara Wilkinson, Olga Torres, Normando Iznaga tous du Centre d’Immunologie Moléculaire, et aussi à Daniel González, Lourdes B Costa, Galina M Moya, Rolando Páez, Gerardo Guillén, Vivian Pujol, Dinorah Torres du Centre de Génie Génétique et de Biotechnologie.
1. González G, Montero E, León K, Cohen IR, Lage A. Autoimmunization to Epidermal Growth Factor, a component of the im-munological homunculus. Autoimmun Rev 2002; 1:89-95.
2. Lage A, Crombet T, González G. Ciblage de la signalisation des récepteurs du facteur de croissance épidermique: premiers résultats et tendances futures en oncologie. Ann Med 2003; 5 (35): 327-36.
3. González G et Lage A. Vaccins anticancéreux contre la privation immunitaire hormonale: The EGF Vaccine Approach: Leading Topics in Cancer Research, Chapitre 11, Ed Nova Publishers, 2007.
4. González G et Lage A. Vaccins contre le cancer pour la privation immunitaire des hormones / facteurs de croissance: une approche réalisable pour le traitement du cancer. Curr Cancer Drug Targets 2007; 7:229-41.
5. González G, Crombet T, Torres F, Catala M, Alfonso L, Osorio M, et al. Vaccin contre le cancer à base de facteurs de croissance épidermique pour le traitement du cancer du poumon non à petites cellules. Ann Oncol 2003; 14:461-6.
6. Crombet T, Neninger E, Catalá M, García B, Leonard I, Martínez L, et al. Traitement des patients du CPNPC avec un vaccin contre le cancer à base d’EGF. Rapport d’un essai de phase I. Cancer Biol Ther 2006; 5 (2): 136-41.
7. González G, Crombet T, Neninger E, Viada C, Lage A. Vaccination thérapeutique avec facteur de croissance épidermique (EGF) dans le cancer du poumon avancé: analyse des données regroupées de trois essais cliniques. Vaccins Hum 2007; 3 (1): 8-13.
8. Neninger E, De la Torre A, Osorio M, Catald M, Bravo I, Mendoza M, et al. Essai contrôlé randomisé de phase II d’un vaccin contre le facteur de croissance épidermique dans le cancer du poumon non à petites cellules avancé. J Clin Oncol 2008; 26:1452-8.
9. García B, Neninger E, De la Torre A, Leonard I, Martínez R, Viada C, et al. L’inhibition efficace de la liaison du Facteur de Croissance épidermique / Récepteur du Facteur de Croissance épidermique par des anticorps anti-Facteur de Croissance épidermique est liée à une meilleure survie chez les patients atteints d’un cancer du poumon non à petites cellules à un stade avancé traités par le vaccin contre le Facteur de Croissance épidermique. Clin Cancer Res 2008; 14 (3): 840-6.
10. Neninger E, Verdecia BG, Crombet T, Viada C, Pereda S, Leonard I, et al. Combinaison d’un vaccin anticancéreux à base d’EGF avec une chimiothérapie dans le cancer du poumon non à petites cellules avancé. J Immunother 2009; 32:92-9.
11. A, A, A, A, A, A, A, A, A, A, et al. Développement d’un procédé de fabrication pour un vaccin contre le cancer à base de facteur de croissance épidermique. Bio-pharm Int, Vaccines Suppl, octobre 2008.
Leave a Reply