Chimie : Que sont les Acides et les Bases?
Que sont les Acides et les Bases ?
Bien que je vous ai dit que les acides et les bases ne sont pas difficiles à comprendre, j’ai de mauvaises nouvelles: Il n’y a pas une mais trois définitions communes utilisées pour décrire les acides et les bases: les acides et bases d’Arrhenius, les acides et bases de Brnsted-Lowry et les acides et bases de Lewis. Bien que cela donne l’impression que vous devrez en apprendre trois fois sur les acides et les bases, la bonne nouvelle est que, pour de nombreuses raisons pratiques, ces trois définitions sont à peu près équivalentes.
Acides et bases d’Arrhenius
À la fin des années 1800, notre vieil ami Svante Arrhenius a proposé des définitions des acides et des bases tout en travaillant sur des problèmes de cinétique.
Selon Arrhenius, les acides sont des composés qui se décomposent dans l’eau pour dégager des ions hydronium (H+). Un exemple courant d’acide d’Arrhenius est l’acide chlorhydrique (HCl) :
- HCl? H ++Cl-
Les formules des acides commencent généralement par l’hydrogène, bien que les acides organiques soient une exception notable. Les noms et formules de certains acides courants sont donnés dans le tableau ci-dessous:
| Nom de l’acide | Formule |
|---|---|
| acide chlorhydrique | HCl |
| acide nitrique | HNO3 |
| acide phosphorique | H3PO4 |
| acide sulfurique | H2SO4 |
| acide acétique | C2H4O2 |
Les bases d’Arrhenius sont définies comme des composés qui provoquent la formation de l’ion hydroxyde lorsqu’il est placé dans l’eau. Un exemple de base d’Arrhenius est l’hydroxyde de sodium (NaOH) :
- NaOH? Na ++ OH-
Les bases ont généralement « OH » dans leurs formules, bien qu’il existe des exceptions. Par exemple, l’ammoniac (NH3) ne contient pas d’ions hydroxydes mais les forme lorsqu’il réagit avec l’eau :
- NH3 +H2O? NH4++ OH-
Les noms et formules de certaines bases courantes sont dans le tableau suivant:
| Nom de la base | Formule |
|---|---|
| ammoniac | NH3 |
| hydroxyde de potassium | KOH |
| bicarbonate de sodium | NaHCO3 |
| carbonate de sodium | Na2CO3 |
| hydroxyde de sodium | NaOH |
Certains oxydes forment des acides ou des bases lorsque de l’eau est ajoutée. Parce que ces composés ne contiennent pas d’ions H + ou OH- à moins qu’ils ne réagissent avec l’eau, ils sont appelés « anhydrides. »Typiquement, les oxydes de non-métaux sont des anhydrides d’acide (ils forment de l’acide lorsqu’ils sont placés dans l’eau), et les oxydes de métaux sont des anhydrides de base (formant une base lorsqu’ils sont placés dans l’eau).
Acides et bases de Brnsted-Lowry
Au début des années 1900, une autre définition des acides et bases a été proposée par Johannes Brnsted et Thomas Lowry pour expliquer le fait que l’ammoniac peut neutraliser l’acidité du HCl même en l’absence d’eau. Ce phénomène leur a montré que l’ammoniac est une base, même lorsqu’il n’y a pas d’eau autour pour former des ions hydroxydes.
Il existe de nombreux noms et formules différents utilisés pour décrire l’ion hydronium. Bien que la formule ait été montrée précédemment comme « H + », elle est parfois écrite comme « H3O » car il s’agit de l’ion formé lorsque H + se combine avec de l’eau. Une autre façon courante de se référer aux ions hydronium est simplement de les appeler « protons. »Ce nom vient du fait que H + représente un atome d’hydrogène (un proton et un électron) qui a perdu son électron, ne laissant que le proton nu derrière lui.
Un acide Brnsted-Lowry est défini comme un composé qui donne des ions hydronium à un autre composé?par exemple, l’acide chlorhydrique donne des ions H+ aux composés avec lesquels il réagit. Les bases de Brnsted-Lowry sont des composés qui peuvent accepter les ions hydronium?lorsque l’ammoniac reçoit un ion hydronium de HCl, il forme l’ion ammonium.
L’équation suivante représente la réaction d’un acide Brnsted-Lowry avec une base Brnsted-Lowry :
- HNO3+NH3 ? NO3-+NH4+
Dans cette réaction, l’acide nitrique se comporte comme un acide car il donne un proton à l’ammoniac. L’ammoniac se comporte comme une base car il accepte le proton de l’acide nitrique.
Cependant, si vous regardez de l’autre côté de l’équation, nous trouvons les ions nitrate et ammonium. Parce que l’ion nitrate peut accepter des protons de l’ion ammonium (pour former HNO3), l’ion nitrate est une base de Brnsted-Lowry très faible. Parce que l’ion ammonium a un proton supplémentaire à donner (dans ce cas à l’ion nitrate), c’est un acide Brnsted-Lowry.
L’ion nitrate est basé sur la molécule d’acide nitrique, on dit donc que c’est la base conjuguée de l’acide nitrique. De même, l’ion ammonium est l’acide conjugué de l’ammoniac. Ensemble, un acide avec sa base conjuguée (telle que HNO3 et NO3-) ou une base avec son acide conjugué (telle que NH3 et NH4+) est appelé paire acide-base conjuguée.
Acides et bases de Lewis
Dans la définition Brnsted-Lowry des acides et bases, une base est définie comme un composé pouvant accepter un proton. Cependant, comment accepte-t-il le proton?
Une caractéristique que les bases de Brnsted-Lowry ont en commun les unes avec les autres est qu’elles ont une paire d’électrons non partagée. Quand un ion hydronium vient errer près de la molécule, parfois les paires solitaires vont tendre la main et l’attraper. Un exemple de ceci est lorsque l’ammoniac accepte un proton dans une solution acide:
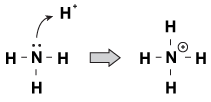
Figure 23.1L’ammoniac peut saisir un proton de l’acide nitrique avec sa seule paire d’électrons.
Une façon de voir ce processus est que l’atome d’ammoniac donne sa seule paire au proton. Parce que les paires solitaires sont à l’origine de cette réaction chimique, nous avons une nouvelle définition de l’acidité et de la basicité, appelée « Acidité de Lewis / basicité. »Une base de Lewis est un composé qui donne une paire d’électrons à un autre composé (l’ammoniac dans notre exemple). Un acide de Lewis est un composé qui accepte une paire d’électrons (l’ion H + dans notre exemple).
Les bases de Lewis sont des produits chimiques qui peuvent donner des paires d’électrons. Les acides de Lewis sont des produits chimiques qui peuvent les accepter.
Bien que l’ammoniac ait donné une paire isolée à un proton dans notre exemple, la paire isolée dans l’ammoniac peut également réagir avec de nombreux autres composés. Par exemple, l’ammoniac peut donner sa seule paire d’électrons à BH3 par le processus suivant:

Figure 23.2 La seule paire sur l’ammoniac se fixant à BH3.
Dans ce processus, l’ammoniac est la base de Lewis et BH3 est l’acide de Lewis.
Généralement, la définition de Lewis des acides et des bases est la plus utile car elle est la plus inclusive des trois définitions. Par exemple, la définition de Brnsted-Lowry d’un acide inclut HF mais pas BH3, qui ne perd pas de proton lorsqu’il est attaché par les paires solitaires sur une base de Lewis.
Extrait de The Complete Idiot’s Guide to Chemistry 2003 par Ian Guch. Tous droits réservés y compris le droit de reproduction en tout ou en partie sous quelque forme que ce soit. Utilisé par arrangement avec Alpha Books, membre de Penguin Group (USA) Inc.
Pour commander ce livre directement auprès de l’éditeur, visitez le site Web de Penguin USA ou appelez le 1-800-253-6476. Vous pouvez également acheter ce livre à Amazon.com et Barnes &Noble.
Leave a Reply