Carbone: les essentiels
Le carbone est un élément du groupe 14 et est très largement distribué dans la nature. On le trouve en abondance dans le soleil, les étoiles, les comètes et les atmosphères de la plupart des planètes. Le carbone est présent sous forme de dioxyde de carbone dans l’atmosphère et dissous dans toutes les eaux naturelles. C’est un composant des roches sous forme de carbonates de calcium (calcaire), de magnésium et de fer. L’atmosphère de Mars est très mince mais ce qu’il y a contient environ 95% de CO2.
Le charbon, le pétrole et le gaz naturel sont principalement des hydrocarbures. Le carbone est unique parmi les éléments dans la grande variété de composés qu’il peut former. La chimie organique, un sous-ensemble 1 / 112ème de la chimie inorganique, est l’étude du carbone et de ses composés. Alors que le silicium pourrait prendre la place du carbone dans la formation d’une foule de composés apparentés, il n’est pas possible actuellement de former des composés stables avec de très longues chaînes d’atomes de silicium.
Le carbone se trouve libre dans la nature sous trois formes allotropes: amorphe, graphite et diamant. Le graphite est l’un des matériaux les plus doux connus tandis que le diamant est l’un des plus durs. Le carbone, sous forme de diamants microscopiques, se trouve dans certaines météorites. Les diamants naturels se trouvent dans d’anciens « tuyaux » volcaniques tels que ceux trouvés en Afrique du Sud. Des diamants sont également récupérés au fond de l’océan au large du cap de Bonne-Espérance.

Une bague en diamant.
Plus récemment, une autre forme de carbone, le buckminsterfullerène, C60, a été découverte. Cette forme de carbone fait aujourd’hui l’objet d’un grand intérêt dans les laboratoires de recherche.
Le carbone pur est disponible sous différentes formes (allotropes). La forme la plus courante de carbone pur est l’α-graphite. C’est aussi la forme thermodynamiquement la plus stable. Le diamant est une deuxième forme de carbone mais est beaucoup moins commun. D’autres formes de carbone comprennent les fullerènes. Alors que le diamant et le graphite sont des réseaux infinis, les fullerènes tels que le buckminsterfullerène, C60, sont une espèce moléculaire discrète. Les formes amorphes de carbone telles que la suie et le noir de fumée sont des matériaux constitués de très petites particules de graphite.
La plupart du graphite est du graphite α et il possède une structure de couche dans laquelle chaque carbone est directement lié à trois autres atomes de carbone à une distance de 141,5 pm. La délocalisation dans la liaison est évidente puisque les distances C-C sont égales et plus courtes que les liaisons simples carbone-carbone normales (typiquement 154 pm). La distance entre les couches d’atomes de carbone est de 335,4 pm. Dans la plupart des graphite (α-graphite), les couches d’atomes sont disposées en ABABAB… répétez la mode mais la forme β (rhomboédrique) l’empilement est ABCABCABC… bien que les distances carbone-carbone et l’espacement entre couches restent les mêmes que sous la forme α. La différence d’enthalpie entre α- et α-graphite est inférieure à 1 kJ mol-1 (0,59 ± 0,17 kJ mol-1. Les formes des éléments les plus lourds correspondent au graphite ne sont pas connues et les structures du silicium, du germanium et de l’étain gris sont liées à la structure du diamant (ci-dessous).

Disposition des atomes dans les allotrops de carbone les plus courants : α-graphite.
Comme le diamant a une structure légèrement plus compacte, sa densité est supérieure à celle du graphite. L’aspect du diamant est bien connu et c’est aussi l’un des matériaux les plus durs connus. Comme le graphite, il est relativement peu réactif mais brûle dans l’air à 600-800°C. Chaque atome de carbone est lié à quatre voisins à une distance de 154,45 heures de manière tétraédrique et chaque cristal de diamant est donc une structure de réseau géante unique. En principe (et en pratique !) le graphite peut être converti en diamant par l’application de chaleur et de pression. La cellule unitaire du diamant est cubique avec a = 356,68 pm. Presque tous les diamants possèdent cette structure, mais un très faible pourcentage montre une structure hexagonale liée à la wurtzite et ceux-ci sont appelés lonsdaléite.

Structures cristallines de diamant.
Récemment, un autre allotrope de carbone a été caractérisé. Alors que le diamant et le graphite sont des réseaux infinis, le buckminsterfullerène, C60, est une espèce moléculaire discrète. La molécule de buckminsterfullerène est un réseau de 12 pentagones et 20 hexagones pliés en une sphère. L’effet est très similaire au patchwork de 12 pièces de cuir pentagonales et 20 hexagonales cousues ensemble qui composent un football d’association (ballon de football). Le nom buckminsterfullerene (ou buckyball a été inventé en raison de la relation entre la structure de C60 et les conceptions de dôme géodésique de R. Buckminster Fuller. Buckminsterfullerene est maintenant disponible dans le commerce et a également été identifié dans l’espace interstellaire et la suie.
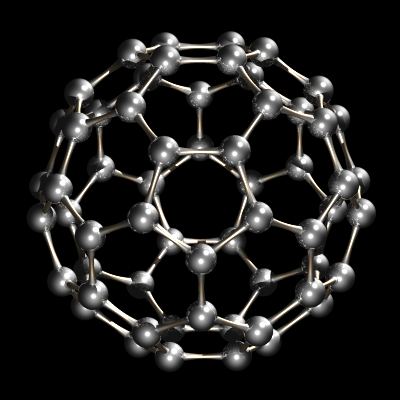
C60, Buckminsterfullerene.
D’autres fullerènes (cages carbonées fermées) tels que le C60 et le C84 sont également connus et disponibles dans le commerce. Le plus petit fullerène possible est le dodécaèdre C20, composé de 12 pentagones et pas d’hexagones du tout. Les nanotubes sont apparentés aux fullerènes. Ce sont des tubes donnant l’apparence de graphite laminé, bien qu’ils soient fabriqués à partir de graphite. Ils sont ouverts tandis que les fullerènes sont des structures fermées.
Une caractéristique intéressante des fullerènes est leur capacité à enfermer des atomes tels que le potassium et d’autres métaux alcalins pour créer des structures endoédriques notées K @ C60.
En 1961, l’Union Internationale de Chimie Pure et Appliquée (UICPA) a adopté l’isotope 12C comme base pour les poids atomiques. Le carbone 14, 14C, un isotope d’une demi-vie de 5730 ans, est utilisé pour dater des matériaux tels que le bois, des spécimens archéologiques, etc. Le carbone 13, 13C, est particulièrement utile pour les études de marquage isotopique car il n’est pas radioactif, mais est un noyau de spin I = 1/2 et donc un bon noyau RMN.
Leave a Reply