Biologie pour les Majors I
Résultats d’apprentissage
- Identifiez les composants de réactions chimiques simples
Tous les éléments sont les plus stables lorsque leur enveloppe la plus externe est remplie d’électrons selon la règle de l’octet. En effet, il est énergétiquement favorable aux atomes d’être dans cette configuration et cela les rend stables. Cependant, comme tous les éléments n’ont pas assez d’électrons pour remplir leurs coquilles les plus externes, les atomes forment des liaisons chimiques avec d’autres atomes, obtenant ainsi les électrons dont ils ont besoin pour atteindre une configuration électronique stable. Lorsque deux atomes ou plus se lient chimiquement, la structure chimique résultante est une molécule. La molécule d’eau familière, H2O, se compose de deux atomes d’hydrogène et d’un atome d’oxygène; ceux-ci se lient ensemble pour former de l’eau, comme illustré à la figure 1. Les atomes peuvent former des molécules en donnant, en acceptant ou en partageant des électrons pour remplir leur enveloppe extérieure.
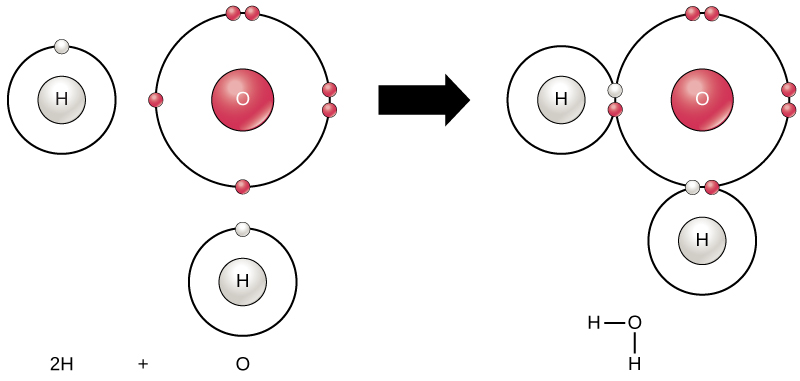
Figure 1. Deux atomes ou plus peuvent se lier les uns aux autres pour former une molécule. Lorsque deux hydrogènes et un oxygène partagent des électrons via des liaisons covalentes, une molécule d’eau se forme.
Les réactions chimiques se produisent lorsque deux atomes ou plus se lient pour former des molécules ou lorsque les atomes liés sont séparés. Les substances utilisées au début d’une réaction chimique sont appelées les réactifs (généralement trouvés sur le côté gauche d’une équation chimique), et les substances trouvées à la fin de la réaction sont connues sous le nom de produits (généralement trouvés sur le côté droit d’une équation chimique). Une flèche est généralement tracée entre les réactifs et les produits pour indiquer la direction de la réaction chimique; cette direction n’est pas toujours une « rue à sens unique ».”Pour la création de la molécule d’eau montrée ci-dessus, l’équation chimique serait:
2H + O → H2O
Un exemple de réaction chimique simple est la décomposition de molécules de peroxyde d’hydrogène, chacune constituée de deux atomes d’hydrogène liés à deux atomes d’oxygène (H2O2). Le peroxyde d’hydrogène réactif est décomposé en eau, contenant un atome d’oxygène lié à deux atomes d’hydrogène (H2O), et en oxygène, qui se compose de deux atomes d’oxygène liés (O2). Dans l’équation ci-dessous, la réaction comprend deux molécules de peroxyde d’hydrogène et deux molécules d’eau. Ceci est un exemple d’équation chimique équilibrée, dans laquelle le nombre d’atomes de chaque élément est le même de chaque côté de l’équation. Selon la loi de conservation de la matière, le nombre d’atomes avant et après une réaction chimique doit être égal, de sorte qu’aucun atome ne soit, dans des circonstances normales, créé ou détruit.
2H2O2 (peroxyde d’hydrogène) → 2H2O (eau) +O2 (oxygène)
Même si tous les réactifs et produits de cette réaction sont des molécules (chaque atome reste lié à au moins un autre atome), dans cette réaction seuls le peroxyde d’hydrogène et l’eau sont représentatifs d’une sous-classe de molécules appelées composés : ils contiennent des atomes de plus d’un type d’élément. L’oxygène moléculaire, en revanche, comme le montre la figure 2, est constitué de deux atomes d’oxygène doublement liés et n’est pas classé comme un composé mais comme un élément.
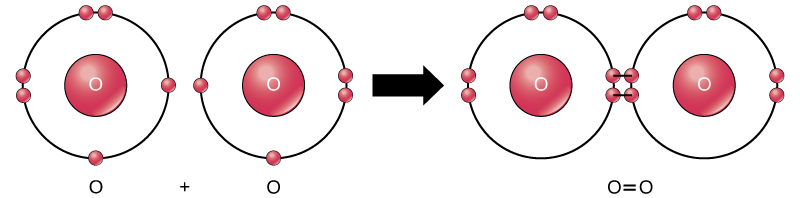
Figure 2. Les atomes d’oxygène d’une molécule d’O2 sont reliés par une double liaison.
Certaines réactions chimiques, comme celle ci-dessus, peuvent se dérouler dans une direction jusqu’à épuisement des réactifs. Les équations qui décrivent ces réactions contiennent une flèche unidirectionnelle et sont irréversibles. Les réactions réversibles sont celles qui peuvent aller dans les deux sens. Dans les réactions réversibles, les réactifs sont transformés en produits, mais lorsque la concentration en produit dépasse un certain seuil (caractéristique de la réaction particulière), certains de ces produits seront reconvertis en réactifs; à ce stade, les désignations des produits et des réactifs sont inversées. Ce va—et-vient continue jusqu’à ce qu’un certain équilibre relatif entre les réactifs et les produits se produise – un état appelé équilibre. Ces situations de réactions réversibles sont souvent désignées par une équation chimique avec une double flèche dirigée vers les réactifs et les produits.
Par exemple, dans le sang humain, les ions hydrogène en excès (H+) se lient aux ions bicarbonate (HCO3–) formant un état d’équilibre avec l’acide carbonique (H2CO3). Si de l’acide carbonique était ajouté à ce système, une partie de celui-ci serait convertie en ions bicarbonate et hydrogène.
HCO3–+H + ↔ H2CO3
Dans les réactions biologiques, cependant, l’équilibre est rarement obtenu car les concentrations des réactifs ou des produits ou des deux changent constamment, souvent avec un produit d’une réaction étant un réactif pour une autre. Pour revenir à l’exemple de l’excès d’ions hydrogène dans le sang, la formation d’acide carbonique sera la direction principale de la réaction. Cependant, l’acide carbonique peut également quitter le corps sous forme de gaz carbonique (via l’expiration) au lieu d’être reconverti en ion bicarbonate, entraînant ainsi la réaction à droite par la loi chimique connue sous le nom de loi d’action de masse. Ces réactions sont importantes pour maintenir l’homéostasie de notre sang.
HCO3-+H+ ↔ H2CO3 ↔ CO2+H2O
En résumé: Réactions chimiques et molécules
L’enveloppe électronique externe dicte la facilité et le type de liaisons chimiques qu’un atome particulier va former. La formation de composés est souvent décrite visuellement dans des équations chimiques qui montrent les réactifs participant aux réactions chimiques pour former des produits.
Essayez-le
Contribuez!
Améliorer cette pageen savoir plus
Leave a Reply