Avantages et inconvénients du dépistage prénatal
L’objectif du dépistage et du diagnostic prénatal est d’identifier les anomalies chromosomiques, les conditions génétiques et les anomalies structurelles du fœtus avant la naissance.
Les options de dépistage et de diagnostic impliquent une gamme de tests non invasifs et invasifs à différents stades de la grossesse et ont progressé à pas de géant au cours des 40 dernières années, parallèlement à des changements sociaux et démographiques importants au cours de cette période.
En Australie en 2013, l’âge moyen des femmes qui ont accouché était de 30,1 ans, contre 29,5 ans en 2003, tandis que la proportion de mères âgées de 35 ans et plus est passée de 19% en 2003 à 22% en 2013, et l’âge moyen des premières mères a également augmenté, passant de 27,8 ans en 2003 à 28,6 en 20131
Il y a quarante ans, l’âge maternel était le seul outil de dépistage disponible identifier les grossesses à risque d’anomalies chromosomiques. Depuis lors, la disponibilité de tests prénataux non invasifs de plus en plus bon marché et précis a permis aux femmes de tous âges d’avoir de meilleures options de tests prénataux.
Face aux nombreuses options de dépistage prénatal, certains couples peuvent se sentir dépassés, tandis que les cliniciens peuvent avoir du mal à suivre tous les détails des nouveaux tests. Mais le counseling est essentiel pour s’assurer que les couples sont pleinement conscients du processus de test du point de vue physique, émotionnel, pratique et financier.
La première et la plus importante question à poser est: le couple devrait-il envisager des tests prénataux? Certains couples ne discutent jamais de la question jusqu’à ce qu’ils tombent enceintes, et beaucoup n’ont jamais envisagé la possibilité d’avoir un bébé avec un problème chromosomique, tel que le syndrome de Down, ou une malformation congénitale, telle qu’une fente labiale.
D’un autre côté, de nos jours, l’amélioration de la littératie en santé signifie que de nombreux couples sont informés et proactifs, et certains veulent que tous les tests disponibles garantissent que leurs bébés sont en bonne santé.
La question suivante porte sur le ou les tests à subir et sur le point de savoir s’il s’agit de tests de dépistage ou de diagnostic. Par définition, un test de dépistage enquête sur une population pour identifier les personnes à risque accru d’avoir une certaine condition, tandis qu’un test de diagnostic détermine si une personne a une condition particulière. Dans le contexte des tests prénataux, les tests de dépistage comprennent les échographies, le dépistage biochimique et les tests prénataux non invasifs (NIPT), tandis que les tests diagnostiques sont l’échantillonnage des villosités choriales (CVS) et l’amniocentèse.
Enfin, lorsqu’on parle de tests aux couples, il y a les questions pratiques de coût et d’accès, qui seront influencées dans une large mesure par le statut socio-économique du patient. De nombreux services d’échographie et autres tests de haute qualité ne sont pas remboursables par Medicare et sont donc inabordables pour certains patients.
Bien sûr, ce n’est pas parce qu’un test est disponible qu’il doit être effectué, et les couples qui se lancent dans un test prénatal doivent le faire les yeux grands ouverts pour éviter de se retrouver dans des montagnes russes cauchemardesques lorsqu’ils sont référés pour « tous les tests”.
À cette fin, le conseil pré-test est essentiel pour que les couples comprennent les chances maternelles liées à l’âge d’un bébé avec un problème chromosomique majeur, et puissent ensuite les évaluer par rapport aux risques et avantages des différents tests proposés.
Les couples doivent comprendre exactement ce que les tests peuvent et ne peuvent pas détecter, et, plus fondamentalement, exactement pourquoi ils subissent le test. À ce stade, il faut répondre à des questions difficiles: envisageraient-ils d’interrompre une grossesse si un fœtus était diagnostiqué avec le syndrome de Down? Le diagnostic informerait-il la prise en charge et la planification de l’accouchement si un fœtus atteint du syndrome de Down présentait également un défaut cardiaque majeur nécessitant une chirurgie cardiaque néonatale?
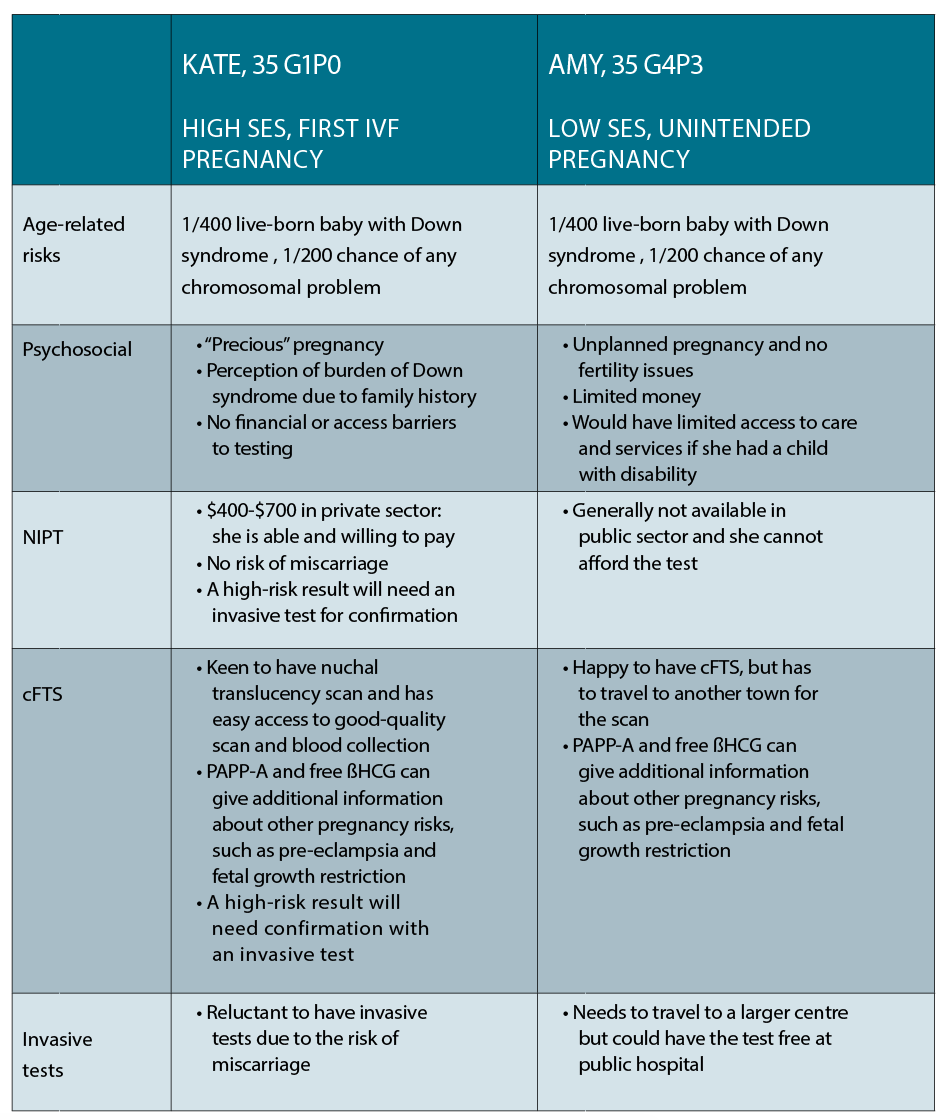
Cet article examine deux scénarios de cas courants et la gamme d’options de test prénatal disponibles pour les deux.
Cas 1
Kate est une avocate d’entreprise de 35 ans vivant dans le centre-ville, qui a conçu sa première grossesse lors de son quatrième cycle de FIV. Elle est maintenant enceinte de 10 semaines et souhaite connaître les options qui s’offrent à elle pour un diagnostic prénatal. Elle a un cousin atteint du syndrome de Down et est très préoccupée par son propre risque d’avoir un bébé avec la même condition.
Cas 2
Amy a également 35 ans et vit dans une petite ville de Nouvelle-Galles du Sud. Elle et son partenaire ont trois jeunes enfants et ont des difficultés financières, et elle est à 10 semaines d’une grossesse involontaire. Elle veut connaître ses options pour les tests prénataux car une de ses amies a récemment donné naissance à un enfant atteint du syndrome de Down.

Les couples doivent comprendre exactement ce que les tests peuvent et ne peuvent pas détecter
TEST NON INVASIF
Une échographie précoce du premier trimestre, ou de datation, est réalisée entre sept et 12 semaines et est utile pour confirmer la présence d’une grossesse viable et déterminer s’il y a une grossesse multiple. Il permet également une datation précise de la gestation, aide à exclure une grossesse extra-utérine et à localiser le placenta. Il n’est pas effectué pour détecter les malformations congénitales.
Une analyse de la translucidité nucale est réalisée entre 11 semaines et trois jours, et 13 semaines et six jours (longueur du croupion de la couronne fœtale de 45 à 84 mm), idéalement dans le cadre du « dépistage combiné du premier trimestre”. La translucidité nucale est un espace rempli de liquide à l’arrière du cou fœtal qui peut être mesuré par ultrasons. Il est bien connu que plus la translucidité nucale est large, plus le risque d’anomalies fœtales, y compris des problèmes chromosomiques tels que le syndrome de Down, ainsi que des anomalies cardiaques structurelles et certains troubles d’un seul gène, est élevé.
À ce jour, la recommandation a été que l’analyse de la translucidité nucale soit effectuée en conjonction avec un dépistage biochimique maternel en tant que dépistage combiné du premier trimestre (CFT), qui mesure le PAPP-A et le ßHCG libre pour améliorer les taux de détection du syndrome de Down.
Seul, le scan de la translucidité nucale a un taux de détection d’environ 65% à 70% pour le syndrome de Down, et avec l’ajout de marqueurs sériques tels que PAPP-A et bêta-HCG libre, tous deux rapportés comme des multiples de la médiane (MoMs), cela augmente à environ 90% avec un taux de faux positifs de 5%.
Dans la plupart des cas, ces tests seront rassurants et offriront aux couples une tranquillité d’esprit sans mettre la grossesse en danger, ce qui peut survenir avec des tests invasifs tels que le CVS ou l’amniocentèse.
Avec la disponibilité des tests prénataux non invasifs, un débat a surgi quant à la valeur du dépistage combiné du syndrome de Down au premier trimestre, bien que beaucoup soutiennent que l’analyse de 12 semaines a encore un rôle à jouer dans l’identification des anomalies structurelles et d’autres problèmes qui pourraient nuire à l’issue de la grossesse.2
L’échographie de morphologie fœtale est réalisée entre 18 et 20 semaines et peut détecter jusqu’à 50% des anomalies structurelles majeures. Il n’est pas recommandé comme test de dépistage primaire du syndrome de Down. La sensibilité de l’analyse pour détecter les malformations est influencée par un certain nombre de facteurs, notamment la nature de la malformation, la compétence et l’expérience de l’opérateur, la qualité de l’appareil à ultrasons, l’habitus du corps maternel et la position du placenta.
TEST PRÉNATAL NON INVASIF
Un échantillon génétique fœtal détectable dans le sang maternel, qui peut être testé pour un diagnostic prénatal précis, est depuis longtemps le saint graal du test prénatal. Les améliorations de la technologie de l’ADN ont finalement conduit à la capacité d’isoler et de mesurer l’ADN fœtal circulant dans le sang maternel.3
Environ 10% à 15% de l’ADN dans le sang maternel est d’origine fœtale et provient de cellules fœtales intactes ainsi que d’ADN fœtal sans cellules circulantes (adncCFF), dérivé principalement de la dégradation des cellules placentaires. L’ADNCFC est éliminé de la circulation maternelle dans les heures suivant l’accouchement, et l’ADN fœtal détecté pendant une grossesse représente donc l’ADN du fœtus actuel.
Le NIPT consiste à mesurer les fragments de chromosomes exempts de cellules et à utiliser les différences quantitatives pour distinguer les grossesses aneuploïdiques de celles qui ne sont pas affectées. Par exemple, les fœtus atteints du syndrome de Down auront une augmentation mesurable et statistiquement significative du nombre de fragments du chromosome 21.
Cependant, à l’instar de l’échantillonnage des villosités choriales, l’ADNC CCFF reflète l’ADN placentaire plutôt que l’ADN fœtal, ce qui doit être pris en compte lors du conseil et de la discussion des options de test invasif potentielles. Cela peut renvoyer des résultats cytogénétiquement ambigus causés par des facteurs tels que le mosaïcisme placentaire.
De nombreuses sociétés de biotechnologie ont lancé différentes plates-formes NIPT avec des noms euphémistes tels que Harmony et Panorama, permettant des tests prénataux non invasifs à grande échelle pour l’aneuploïdie fœtale, telles que la trisomie 13, 18 et 21, et des anomalies communes des chromosomes sexuels, telles que le syndrome de Turner.
Les principaux avantages du NIPT sont qu’il est non invasif, disponible à partir de neuf semaines de gestation, et qu’il présente une sensibilité et une spécificité élevées, bien qu’il s’agisse par définition d’un dépistage plutôt que d’un test de diagnostic. Cependant, environ 25% des anomalies chromosomiques ne seront pas détectées par NIPT, et des tests invasifs devraient donc être proposés aux femmes présentant un risque accru d’anomalie chromosomique, par exemple en cas d’augmentation de la mesure de la translucidité nucale ou de TFC, ou celles présentant une anomalie structurelle détectée par échographie.4
Il y a aussi un inconvénient pratique dans le contexte australien car le NIPT n’est pas financé par des fonds publics, ce qui entraîne une inégalité d’accès. Il n’est pas encore établi comment le NIPT devrait être intégré à la pratique courante de dépistage prénatal, ni quel est le moyen le plus rentable de le faire.
De nombreux experts préconisent actuellement le modèle de dépistage contingent selon lequel toutes les femmes ont des TFC, et les personnes à haut risque de syndrome de Down (> 1/50) se voient proposer des tests invasifs; celles à risque intermédiaire entre 1/50 et 1/300 se voient proposer un choix de tests NIPT ou invasifs; et celles à faible risque (< 1/300) sont rassurées et pas offert d’autres tests.5
TESTS INVASIFS OU DIAGNOSTIQUES
Au cours des dernières années, le nombre de procédures de tests prénataux invasifs a considérablement diminué, principalement en raison de la disponibilité de tests non invasifs améliorés.6 Les principales indications pour effectuer des tests invasifs sont maintenant pour le diagnostic prénatal des troubles à gène unique (Mendéliens), plutôt que pour détecter l’aneuploïdie.
Le prélèvement de villosités choriales est un test invasif effectué à 11 à 13 semaines de grossesse, soit par une approche trans-vaginale ou trans-abdominale, selon la préférence de l’opérateur et l’emplacement du placenta. Le taux de fausse couche liée à la procédure est faible (< 1%) mais reste néanmoins un obstacle pour certaines femmes, en particulier chez celles ayant des antécédents d’infertilité ou de perte de grossesse.
Il y a 1% de chances d’obtenir un résultat non concluant avec CVS. Cela est généralement dû au mosaïcisme placentaire confiné, un phénomène bien connu qui peut être associé à un faible PAPP-A et à des résultats de grossesse défavorables, y compris une restriction de la croissance fœtale et une perte précoce de la grossesse, même si le fœtus a un caryotype normal. Lorsque les résultats du CVS sont ambigus, des tests supplémentaires – généralement une amniocentèse – sont effectués pour déterminer si l’anomalie chromosomique est vraiment présente chez le fœtus ou si elle est confinée au placenta.
L’amniocentèse est réalisée après 15 semaines et est également associée à un petit (<0.5%) risque de fausse couche. L’amniocentèse est considérée comme l’étalon-or, en ce sens que les cellules fœtales obtenues à partir du liquide amniotique sont dérivées de plusieurs tissus fœtaux, y compris les voies urinaires et la peau, et sont donc plus véritablement représentatives du caryotype fœtal que celles obtenues à partir du placenta. Le principal inconvénient de l’amniocentèse par rapport au CVS est le moment plus tardif, et donc une gestation plus avancée, au moment où les résultats sont reçus.
Actuellement, la plupart des laboratoires de diagnostic se sont éloignés de l’analyse cytogénétique (caryotype) comme test standard et ont adopté des techniques moléculaires, y compris la réaction quantitative en chaîne par polymérase fluorescente (QF-PCR). La QF-PCR est moins coûteuse et demande moins de main-d’œuvre que l’analyse de caryotype standard, et les résultats sont obtenus plus rapidement (dans les 24 à 48 heures par rapport aux 10 à 14 jours) car la technique ne nécessite pas de culture de cellules fœtales.
Alors que la QF-PCR est capable de diagnostiquer les aneuploïdies courantes impliquant les chromosomes 13, 18, 21 et les chromosomes sexuels, elle ne peut pas détecter d’autres anomalies chromosomiques rares. De plus, il ne peut pas déterminer si une trisomie est due à une non-disjonction (c’est-à-dire une aneuploïdie commune liée à l’âge) ou à une translocation, ce qui est plus rare mais préoccupant, car elle peut être héréditaire et associée à un risque accru de récidive lors de futures grossesses.
La microréseau chromosomique, également appelée caryotypage moléculaire, est bien établie comme l’une des principales enquêtes utilisées pour évaluer les bébés et les enfants présentant des anomalies structurelles et une déficience intellectuelle. Il analyse les chromosomes à une résolution beaucoup plus élevée (généralement < 2,5 ko ou 250 000 paires de bases) par rapport à la résolution de 5 Mo à 10 Mo d’un caryotype standard, ou étude cytogénétique, pour détecter les petites duplications et délétions chromosomiques.
De plus en plus, le microarray est utilisé dans le cadre prénatal, où il peut donner des résultats difficiles à interpréter, appelés « variantes de signification incertaine”. Pour cette raison, le microréseau chromosomique ne doit être offert qu’avec des conseils appropriés avant et après le test, et uniquement dans les situations où cela est cliniquement indiqué. Dans les grossesses à haut risque où une anomalie structurelle ou une mesure de la translucidité nucale accrue a été détectée, il a été démontré que les microréseaux améliorent le rendement diagnostique d’environ 6%.7
Le diagnostic génétique préimplantatoire est maintenant disponible pour les patients présentant un risque accru d’aneuploïdie ou de trouble d’un seul gène. Ils peuvent maintenant subir une FIV et faire biopsier et tester les embryons via un diagnostic génétique préimplantatoire au cinquième jour, avant le transfert d’embryons dans l’utérus.
Le DPI est de plus en plus utilisé par les couples qui souhaitent éviter une grossesse atteinte d’une maladie génétique particulière ou d’une anomalie chromosomique. Bien qu’il ne soit pas précis à 100%, le DPI peut réduire considérablement le risque d’avoir une grossesse affectée, et donc la nécessité d’envisager une interruption de grossesse.
Il existe deux principaux types de diagnostic génétique préimplantatoire:
Test d’aneuploïdie: il est utilisé pour les couples à risque d’aneuploïdie en raison d’un âge maternel avancé, d’une translocation équilibrée des parents, d’une fausse couche récurrente et d’un échec d’implantation;
Test pour un trouble d’un seul gène: ceci est utilisé dans les couples à risque d’avoir un enfant avec un seul trouble génique, y compris des conditions autosomiques récessives, liées à l’X ou autosomiques dominantes. Dans ces situations, le diagnostic moléculaire ou ADN spécifique doit être identifié, avant que le DPI puisse être proposé.
Il est essentiel que les couples qui envisagent une FIV et un DPI soient orientés vers des conseils appropriés car ils doivent être pleinement conscients du point physique, émotionnel et financier pertinent pour ces procédures.
Le Dr Kennedy est directeur de MotherSafe RHW et Chargé de cours conjoint de la Santé des Femmes et des enfants à l’UNSW
1. AIHW Australia’s mothers and babies 2013 en bref
2. McLennan A, Palma-Dias R, da Silva Costa F, et al. Tests prénataux non invasifs dans la pratique clinique de routine – un audit du NIPT et du dépistage combiné du premier trimestre dans une population australienne non sélectionnée. ANZJOG 2016; 56:22-28.
3. Lo YMD, Corbetta N, Chamberlain PF, Rai V, Sargent IL, Redman CWG, Lambris JS. 1997. Présence d’ADN fœtal dans le plasma et le sérum maternels. Lancette 350, 485-4874:
4. Petersen OB1, Vogel I, Ekelund C, Hyett J, Tabor A. Conséquences diagnostiques potentielles de l’application du test prénatal non invasif: étude basée sur la population d’un pays avec un dépistage du premier trimestre existant. Échographie Obstétricale Gynécologique. 2014 Mars; 43 (3): 265-71.
5. Hui L, Hyett J Tests prénataux non invasifs pour la trisomie 21; défis pour la mise en œuvre en Australie. ANZJOG 2013; 53(5): 416-424.
6. Hui L, Muggli EE, Halliday JL. Tendances démographiques du dépistage prénatal et du diagnostic de l’aneuploïdie: une analyse rétrospective de 38 années de données à l’échelle de l’État. JOJ 2016; 123(1):90-7
7. Wapner RJ et al Chromosomal microarray versus karyotyping for prenatal diagnosis N Engl J Med 2012; 367:2175-2184

Leave a Reply