Anesthésie dentaire: Aperçu des agents injectables utiles pour la thérapie parodontale non chirurgicale
Aperçu des agents injectables utiles pour la thérapie parodontale non chirurgicale
Laura Webb
Les procédures de thérapie parodontale non chirurgicale (NSPT) sont généralement des procédures électives nécessitant des anesthésiques de durée intermédiaire (voir tableau 1). Tout ce dont nous avons besoin pour fournir une anesthésie locale sûre et efficace à nos patients est à notre disposition. Alors, comment choisissons-nous? La sélection des agents pour la NSPT doit être basée sur le profil du patient, la durée de la procédure et le besoin d’hémostase. Un aperçu des agents importants (noms génériques) disponibles aux États-Unis est également discuté ci-dessous, ainsi que leurs considérations générales en ce qui concerne la NSPT chez les patients adultes.
Agents et vasoconstricteurs
Tous les anesthésiques locaux dentaires injectables disponibles aujourd’hui en Amérique du Nord sont des anesthésiques locaux amides. Ces agents sont sûrs, non allergènes, généralement métabolisés dans le foie et excrétés par les reins (exceptions discutées plus loin). Ce sont également des vasodilatateurs légers, qui entraînent une augmentation du taux d’absorption anesthésique dans la circulation sanguine, un risque accru de toxicité systémique, une réduction de la durée d’action et une augmentation des saignements dans la région.
Des vasoconstricteurs sont ajoutés aux agents anesthésiques locaux pour contrecarrer les propriétés vasodilatatrices. En resserrant les vaisseaux sanguins dans la région, l’absorption est diminuée, ce qui réduit le risque de toxicité systémique, augmente la durée d’action et augmente l’hémostase.
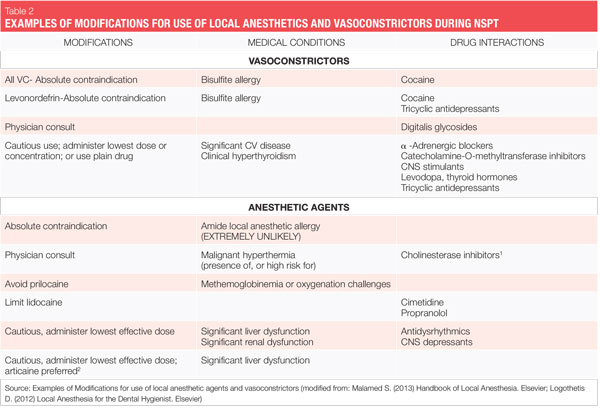
Lors de l’anesthésie locale, des agents contenant des vasoconstricteurs doivent être utilisés à moins qu’il n’y ait une raison impérieuse ou une contre-indication absolue à ne pas les utiliser.1 Une contre-indication absolue décrit une circonstance où un médicament ne doit en aucun cas être administré parce qu’il est dangereux. Une contre-indication relative décrit une circonstance où le médicament peut être utilisé avec précaution après un examen réfléchi du risque par rapport au bénéfice et lorsqu’une alternative plus sûre n’est pas disponible. La plupart des patients que nous traitons entrent dans cette dernière catégorie car il existe peu de contre-indications absolues à l’administration d’anesthésiques locaux dentaires pour les patients éligibles à des procédures électives, telles que la NSPT (voir tableau 2).
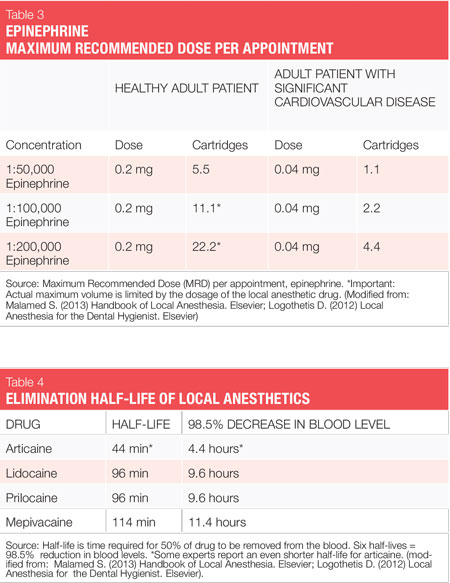
Les deux vasoconstricteurs disponibles aux États-Unis sont l’épinéphrine et la lévonordéfrine. L’épinéphrine est disponible dans les anesthésiques dentaires lidocaïne, articaïne, prilocaïne et bupivacaïne. Dans les cartouches dentaires américaines, l’épinéphrine est formulée en concentrations de 1: 50 000, 1: 100 000 et 1: 200 000. Il convient de noter que la durée d’effet de l’anesthésie pulpaire et des tissus mous est essentiellement la même avec toutes ces concentrations vasoconstrictrices, et donc la concentration la plus faible disponible est recommandée. Les concentrations de 1: 100 000 et 1: 200 000 fournissent généralement une bonne hémostase pour la NSPT. Les agents contenant 1:200 000 épinéphrine peuvent être utiles lorsqu’il est nécessaire de limiter la dose de vasoconstricteur (voir Tableaux 2, 3).1-3 La concentration la plus élevée, 1:50 000, est recommandé uniquement lorsque l’hémostase supplémentaire est nécessaire et doit être administrée en très petit volume sous forme d’injections d’infiltration (papillaires) adjacentes au site de saignement.La 1-3 lévonordéfrine est un sixième aussi puissante que l’épinéphrine et n’est disponible qu’en 2% de mépivacaïne et en 1: 20 000 lévonordéfrine. Il fournit significativement moins d’hémostase que l’épinéphrine et est donc moins utile pour la NSPT. La lévonordéfrine est absolument contre-indiquée chez les patients prenant des antidépresseurs tricycliques.1 Parfois, en raison de problèmes de fabrication, la lévonordéfrine n’est pas disponible.
Comme indiqué ci-dessus, il existe peu de contre-indications absolues à l’utilisation d’un vasoconstricteur chez les patients éligibles à la NSPT. Dans la plupart des situations, limiter la quantité de vasoconstricteur reçue par un patient produit un bénéfice adéquat sans compromettre la sécurité du patient.
Par exemple, les patients présentant une contre-indication relative aux vasoconstricteurs peuvent souvent recevoir la dose d’épinéphrine la plus faible possible, sans dépasser la dose maximale « cardiaque » recommandée de 0,04 mg par rendez-vous (voir tableau 3). Les risques liés à l’utilisation de l’épinéphrine par rapport aux avantages doivent toujours être pris en compte. Rappelons cependant qu’un contrôle inadéquat de la douleur peut entraîner la libération de quantités imprévisibles d’épinéphrine endogène, dépassant peut-être la dose qui serait fournie par l’hygiéniste. Plus un patient est compromis sur le plan médical, plus il a besoin d’une anesthésie profonde.1,2
Toutes les cartouches d’anesthésiques locaux dentaires avec vasoconstricteurs contiennent des conservateurs au bisulfite. Les bisulfites se trouvent également couramment dans les aliments et les boissons. Une hypersensibilité aux bisulfites a été rapportée, en particulier chez les asthmatiques (2 Patients ayant démontré une véritable allergie aux bisulfites ne doivent pas recevoir d’agent anesthésique local contenant des vasoconstricteurs (contre-indication absolue).
Agents spécifiques
Lidocaïne – Commercialisée en 1948, la lidocaïne a été le premier anesthésique local amide et une grande amélioration par rapport aux agents ester précédemment disponibles. Il reste l’étalon-or par lequel tous les autres sont jugés et détient 49% de la part de marché américaine.4 Il est composé d’épinéphrine sous forme de lidocaïne à 2%, 1:100 000 épinéphrine et 2% de lidocaïne, 1:50 000 épinéphrine. La lidocaïne est absolument contre-indiquée chez les patients présentant une véritable allergie aux anesthésiques locaux de type amide (extrêmement peu probable) ou chez les patients présentant une allergie connue au bisulfite.
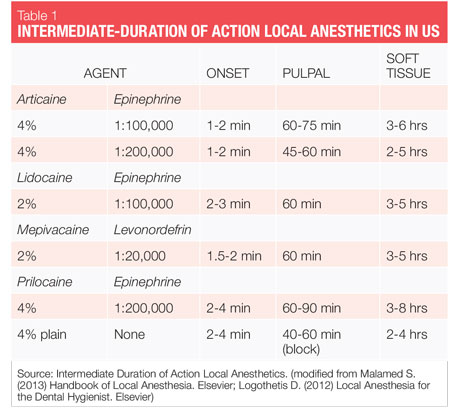
Mepivacaïne – Commercialisé en 1960, il est disponible sous forme de 2% de mepivacaïne, de 1: 20 000 lévonordéfrine et de 3% de mepivacaïne (plaine). La mépivacaïne a un effet vasodilatateur plus doux que la plupart des autres amides et peut donc être utile chez les patients pour lesquels le vasoconstricteur est contre-indiqué et ne peut pas recevoir de prilocaïne ordinaire à 4%.
Cependant, la durée d’action pour la plaine de 3% de mépivacaïne est courte. La mépivacaïne est absolument contre-indiquée chez les patients présentant une véritable allergie aux anesthésiques locaux de type amide (extrêmement peu probable) ou avec la formulation de lévonordéfrine au 1: 20 000, les patients présentant une allergie connue au bisulfite ou prenant des antidépresseurs tricycliques.
Prilocaïne – Commercialisée en 1965, la prilocaïne est moins toxique et moins puissante que la lidocaïne ou la mépivacaïne et offre une durée d’action légèrement plus longue. Il est disponible sous forme d’épinéphrine 1: 200 000 prilocaïne à 4% et de prilocaïne à 4% (ordinaire).
Une caractéristique intéressante concernant la prilocaïne ordinaire est que non seulement elle a un effet vasodilatateur plus doux que la plupart des autres amides, mais, lors d’une injection en bloc, c’est le seul anesthésique local ordinaire de durée intermédiaire. Cela peut être un bon choix pour les patients pour lesquels le vasoconstricteur est contre-indiqué. Les deux formulations de prilocaïne à 4% sont recommandées pour les patients présentant une sensibilité à l’épinéphrine et nécessitant une durée d’action intermédiaire.
La prilocaïne réduit la capacité de charge en oxygène du sang à des doses plus élevées (doses supérieures à la dose maximale recommandée) et est donc relativement contre-indiquée chez les patients à risque de méthémoglobinémie, les patients présentant des problèmes d’oxygénation tels que la drépanocytose, l’insuffisance cardiaque / respiratoire, ainsi que chez les patients recevant de l’acétaminophène ou de la phénacétine car les taux de méthémoglobine sont augmentés.
Puisque la prilocaïne est également métabolisée dans les poumons et les reins, elle est métabolisée plus facilement par le foie que la lidocaïne ou la mépivacaïne. De plus, il efface les reins plus rapidement que les autres autres amides.1 La prilocaïne est absolument contre-indiquée chez les patients présentant une véritable allergie aux anesthésiques locaux de type amide (extrêmement peu probable) et si vous utilisez la formulation d’épinéphrine au 1: 200 000, chez les patients présentant une allergie connue au bisulfite.
Articaïne – L’articaïne est disponible en Europe depuis 1976, mais n’a été commercialisée aux États-Unis qu’en 2000. C’est le deuxième anesthésique local le plus populaire aux États-Unis, détenant actuellement 35,6 % des parts de marché aux États-Unis, et c’est le principal anesthésique dentaire au Canada et en Europe.4
Sa popularité a été attribuée à des taux de réussite d’injection plus élevés liés à une solubilité lipidique accrue et à une diffusion plus rapide à travers les tissus durs et mous, y compris l’anesthésie des racines palatales avec injections buccales et l’anesthésie mandibulaire avec injections suprapériostées.1,5-7 rapports indiquent également une durée d’anesthésie plus profonde et plus longue.6
Classé comme amide avec des caractéristiques d’amide et d’ester, il est 1,5 fois plus puissant que la lidocaïne et présente une toxicité similaire. Aux États-Unis, il est composé d’épinéphrine sous forme d’articaïne à 4%, 1:100 000 d’épinéphrine et 4% d’articaïne, 1:200 000 d’épinéphrine. La biotransformation se produit à la fois dans le plasma et le foie. En raison de sa composition unique et de sa voie de biotransformation, la demi-vie d’élimination (temps nécessaire pour que 50% d’un médicament soit retiré du sang) de l’articaïne, telle que rapportée par les fabricants, n’est que de 44 minutes,4 plus de deux fois plus rapide que tous les autres agents amides, ce qui réduit le risque de toxicité systémique (voir tableau 4). Ceci est significatif, en particulier pour les patients pour lesquels un taux de biotransformation plus élevé peut être souhaité (enfants, médicalement compromis, femmes enceintes, allaitantes, maladie du foie, etc.). Certains experts rapportent que la demi-vie d’élimination de l’articaïne n’est que de 27 minutes (2,7 heures pour diminuer le taux sanguin de 98,5%) – encore plus rapide!1
L’articaïne est absolument contre-indiquée chez les patients ayant des antécédents connus d’hypersensibilité aux anesthésiques locaux de type amide, ou chez les patients présentant une allergie connue au bisulfite.
Autres considérations
Il y a eu une certaine controverse sur l’utilisation d’anesthésiques locaux à 4% tels que la prilocaïne et l’articaïne en ce qui concerne une neurotoxicité accrue et un risque accru de paresthésie.1,2,8,9 Une seule étude (Pogrel 2012) était de nature clinique et était « basée sur des patients réellement vus et examinés par un seul clinicien. »9Dans l’étude Pogrel, il a été déterminé que le nombre de cas de paresthésie de l’articaïne était proportionnel à sa part de marché. D’autres rapports ont été de nature rétrospective, reposant sur des rapports de faute professionnelle, et, par conséquent, peuvent avoir été susceptibles de biais de signalement.9
Dans une étude récente de neurotoxicité anesthésique locale in vitro, il a été conclu que l’articaïne était la moins neurotoxique et présentait le profil de sécurité le plus favorable par rapport à la lidocaïne, à la mépivacaïne et à la prilocaïne.8
D’autres experts affirment que la paresthésie est le plus souvent liée à un traumatisme mécanique et non à un traumatisme chimique, car le nerf lingual se trouve sur le chemin de l’aiguille dentaire pointue lors de la fourniture du bloc IA. Cet avis est en partie étayé par ce qui suit:
•95% des cas de paresthésie surviennent dans la mandibule (généralement le nerf lingual)
•Il n’y a aucun rapport de paresthésie après l’administration des injections de Gow-Gates et de Vazirani-Akinosi (lorsque le nerf lingual n’est pas à proximité)
• Il n’y a aucun rapport de paresthésie après l’utilisation de l’articaïne en médecine.10
Des études supplémentaires sont nécessaires, car les preuves ne sont pas concluantes concernant un risque plus élevé de paresthésie avec l’utilisation de l’articaïne par rapport aux autres anesthésiques locaux.
Nous choisissons des agents anesthésiques locaux en fonction de notre jugement professionnel, de nos expériences et du profil du patient. Les informations concernant les dosages, la sécurité et l’efficacité des agents sont constamment mises à jour. L’exploration continue de la littérature scientifique concernant les agents anesthésiques locaux est essentielle afin que nous puissions assurer une anesthésie locale efficace et sûre pour nos patients. RDH
1. Malamed S. (2013) Manuel d’anesthésie locale. Elsevier.
2. Logothetis D. (2012) Anesthésie locale pour l’hygiéniste dentaire. Elsevier.
3. Schwartz PJ. (2013) Anesthésie, Un problème de Cliniques de chirurgie buccale et Maxillo-faciale. Elsevier.
4.Septodonte. www.septodont.com .
5. Katyal V. L’efficacité et la sécurité de l’articaïne par rapport à la lignocaïne dans les traitements dentaires: une méta-analyse. J Dent. 2010 Avril; 38 (4): 307-17.
6.Costa CG, Toramano IP, Rocha RG, Francischone CE, Totamano N. Périodes d’apparition et de durée de l’articaïne et de la lidocaïne lors de l’infiltration maxillaire. j. prosdent. 2005 Oct; 94(4): 381.
7.Batista da Silva C, Berto LA, Volpato MC, Ramacciato JC, Motta RH, Ranali J, Groppo FC. Efficacité anesthésique de l’articaïne et de la lidocaïne pour le bloc nerveux incisif / mental. J Endod. 2010 Mars; 36 (3): 438-41.
8.Malet A, Faure, M, Déletage N, Pereira B, Haas J, Lambert G. Les effets cytotoxiques comparatifs de différents anesthésiques locaux sur la lignée cellulaire du neuroblastome humain. Anesthésie &Analgésie. 2015 Mars; 120 (3): 589-596.
9.Pogrel. MAMAN. Lésions nerveuses permanentes des blocs nerveux alvéolaires inférieurs – une mise à jour actuelle. 2012 Oct; J ADC; 40 (10): 795-797.
10.Malamed, S. A Renaissance in Local Anesthesia, Séminaires internationaux, 2 mai 2015; Sacramento CA.
LAURA J. WEBB, RDH, MS, ADC, est une clinicienne, éducatrice et conférencière expérimentée qui a fondé LJW Education Services (ljweduserv.com ). Elle offre des cours de méthodologie éducative et des services de consultation en accréditation pour les programmes de formation dentaire alliés et des cours de CE pour les cliniciens. Laura parle fréquemment des sujets de l’anesthésie locale et de l’instrumentation parodontale non chirurgicale. Elle a reçu le prix ADHA Alfred C. Fones 2012. Elle a reçu le prix ADHA Alfred C. Fones 2012. Laura peut être contactée à [email protected] .
Leave a Reply