Acide oxalique
Meera Senthilingam
Cette semaine, nous nous rendons en France et découvrons un composé qui a affecté la santé d’un commandant très connu
Lars Öhrström
Le premier septembre 1870 fut un jour sombre pour Charles Louis Napoléon Bonaparte. À Sedan, petite ville française proche de la frontière belge, le commandant de l’armée française, Patrice de Mac-Mahon, est blessé et l’empereur malade et faible, mieux connu sous le nom de Napoléon III, doit se rendre et se livrer comme prisonnier à l’indomptable duo prussien von Moltke et Bismarck. La guerre de 1870 a donc été perdue et le rapport de force de l’Europe s’est considérablement incliné vers l’est, et nous savons tous comment cela s’est terminé.

Source: ©
Sedan, France
Était-ce dû aux importants dépôts cristallins d’oxalate de calcium qui s’étaient formés dans les reins de Napoléon ? Probablement pas: il semble que la guerre ait été perdue dès qu’elle a été déclarée à cause de la supériorité technique et organisationnelle prussienne.
Cependant, l’empereur n’était pas très désireux de prendre les armes en premier lieu, certains de ses conseillers étant les principaux bellicistes. Il est difficile de savoir dans quelle mesure il a pu résister et les contrer tout en étant assailli par la condition très douloureuse connue sous le nom de calculs rénaux.
Il est plus facile de se tourner vers les calculs rénaux eux-mêmes, car ceux-ci sont sensibles à des méthodes d’interrogation scientifique détaillées telles que la diffraction des rayons X. Ils sont formés de deux composants simples, des ions calcium positifs, Ca2 +, et des ions oxalate négatifs, donnant un composé assez commodément connu simplement sous le nom d’oxalate de calcium.
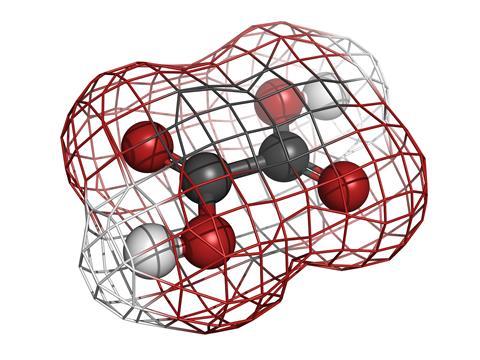
L’acide oxalique est le thème de ce podcast et les anions oxalates sont ce que vous obtenez, avec les ions H +, lorsque vous dissolvez des cristaux de cet acide fort dans l’eau. L’acide oxalique est une petite molécule de formule C2O4H2, mais est peut-être mieux représentée sous la forme de HOOC-single-bond-COOH: seulement deux groupes d’acides carboxyliques réunis pour en faire le diacide organique le plus simple. Vous connaissez peut-être ce produit chimique comme le composé qui fait que la rhubarbe a cette saveur acide particulière au goût, mais on le trouve également dans les épinards et un certain nombre d’autres légumes que la plupart d’entre nous mangent joyeusement. Il fait également partie de notre métabolisme normal et se produit complètement naturellement dans notre corps.
Source: ©
Elle doit son nom à une plante, l’oseille des bois commune, une petite plante herbacée dont les feuilles ont un goût acide distinct, revitalisant si vous vous perdez dans les bois, et portant le nom latin Oxalis acetosella.
La caractéristique la plus distinctive de cette petite molécule est sa forme. Cela ressemble un peu à deux Y reconstitués en chevauchant leurs bases. Les atomes de carbone sont aux deux intersections et les atomes d’oxygène aux quatre extrémités avec les protons (ou ions H +) suspendus un à un à l’un de ces oxygènes. De plus, il est complètement plat et lorsqu’il a perdu ses protons pour devenir l’anion oxalate, il a des charges négatives situées sur deux de ses atomes d’oxygène.
La plupart des applications techniques de l’acide oxalique reposent sur sa planéité et sa charge négative, tout comme les problèmes rénaux de Napoléon. À la veille de la bataille de Sedan, von Moltke avait réussi à engager l’armée française par un mouvement classique de tenaille, attaquant de deux côtés plutôt que du centre. De la même manière, les ions oxalate ont deux paires d’électrons sur chacun des atomes d’oxygène négatifs qui attaquent facilement, de deux côtés, tout ion métallique qui se trouve sur son chemin. Et tout comme à Sedan, plus d’ions oxalate suivront, entourant le métal de deux, trois ou quatre ions oxalate selon sa taille.
Cet effet peut être utilisé pour éliminer les composés de fer indésirables, en particulier la rouille, des ustensiles de cuisine et même du marbre. En tant que charognards, l’acide oxalique ou les oxalates sont des composants de nombreuses formulations techniques de nettoyage et ces solutions fonctionnent toutes sur l’hypothèse que les composés métal-oxalate formés sont solubles dans l’eau et peuvent donc être facilement lavés.

Source: ©
Pas si oxalate de calcium. Les ions calcium positifs aiment vraiment les atomes d’oxygène oxalate les plus négatifs, et à un point tel qu’ils ne se soucient pas si les atomes d’oxygène oxalate portent une charge négative ou non. Ainsi, non seulement il y aura un mouvement de pince vers l’avant vers un ion calcium, mais aussi vers l’arrière, s’attachant à un autre dans cette direction. Comme chaque ion calcium est assez gros, quatre ions oxalate s’assembleront autour de chaque ion métallique (contre trois pour le fer), chacun se fixant à deux autres ions calcium dans l’autre sens. De cette façon, l’oxalate de calcium deviendra un réseau infini qui sera complètement insoluble dans l’eau. Au fur et à mesure que de plus en plus d’ions calcium et d’ions oxalate traversent le rein, les cristaux se développeront jusqu’à ce que la condition devienne assez douloureuse.
Mais ne vous inquiétez pas, en dehors de certaines conditions médicales très particulières, un apport normal, voire élevé, en ions calcium et en acide oxalique provenant de sources naturelles ne semble pas augmenter le risque de calculs rénaux.
L’insolubilité des oxalates trouve également son utilité dans la technologie. Les éléments de terres rares, ou lanthanoïdes, deviennent de plus en plus importants dans de nombreuses applications techniques. Souvent, la première étape de leur traitement et de leur raffinage, après une première lixiviation des minerais, consiste à précipiter ces éléments sous forme d’oxalates, car comme pour l’oxalate de calcium, ils sont très insolubles.
Outre sa rencontre malheureuse avec l’oxalate de calcium, Napoléon III est connu dans l’histoire de la chimie comme l’instigateur du développement de la margarine et pour avoir poussé à une méthode peu coûteuse et pratique de fabrication de l’aluminium à l’échelle industrielle, à son époque le plus cher de tous les métaux. Il n’a pas vu cet objectif plus tard atteint, mais il est à noter que le produit chimique qui lui a causé tant de douleur, l’acide oxalique, est également utilisé pour fabriquer et colorer la couche d’oxyde dure, résistante à l’abrasion et à la corrosion – également connue sous le nom de revêtement anodisé – qui est maintenant si important dans bon nombre de nos applications de l’aluminium.
Meera Senthilingam
Donc santé et industrie réunies. C’était Lars Öhrström de la Chalmers Tekniska Högskola en Suède qui vous apportait la chimie débilitante des reins de l’acide oxalique. La semaine prochaine, Lars revient avec un composé entièrement capable de se protéger.
Lars Öhrström
On ne sait pas quand le ferrocène a été fabriqué pour la première fois, mais il semble qu’il ait été enregistré comme une « boue jaune » à la fin des années 1940 par des techniciens de procédé inspectant les tuyaux d’un craqueur Union Carbide, qui a été utilisé dans la fabrication du petit cyclopentadiène hydrocarboné à partir de dicyclopentadiène.
Cela a provoqué un certain émoi, car aucune molécule stable composée uniquement d’un hydrocarbure et d’un métal de transition n’était connue auparavant, et ce composé pouvait être maintenu à l’air à température ambiante sans s’enflammer spontanément. Il a également survécu à la rencontre de tueurs notoires de molécules organométalliques telles que l’eau, les acides ou les bases.
Meera Senthilingam
Et découvrez la chimie permettant cela dans Chemistry in its Element de la semaine prochaine. D’ici là, merci d’avoir écouté, je suis Meera Senthilingam
Leave a Reply