1.14: Distinction entre pH et pKa
Acidité relative et Valeurs de pKa
Une application de l’équation de Henderson-Hasselbach est la capacité de déterminer l’acidité relative des composés en comparant leurs valeurs de pKa. Plus un acide est fort, plus l’ionisation est importante, plus le pKa est bas et plus le pH du composé en solution est bas. Certaines valeurs de pKa sélectionnées pour les composés dans l’étude de la chimie organique sont présentées ci-dessous. Comme les réactions organiques peuvent être effectuées dans des environnements non aqueux, le pH peut dépasser 14 et les composés organiques peuvent avoir des valeurs de pKa supérieures à 16. C’est une variante de cette phrase du Magicien d’Oz, « Nous ne vivons plus dans l’eau. »





C’est une très bonne idée de mémoriser les plages approximatives de pKa des composés ci-dessus. Un mot d’avertissement: lorsque vous utilisez la table pKa, assurez-vous absolument que vous envisagez la paire acide / base conjuguée correcte. Si on vous demande de dire quelque chose sur la basicité de l’ammoniac (NH3) par rapport à celle de l’ion éthoxyde (CH3CH2O-), par exemple, les valeurs de pKa pertinentes à considérer sont 9,2 (le pKa de l’ion ammonium) et 16 (le pKa de l’éthanol). D’après ces chiffres, vous savez que l’éthoxyde est la base la plus forte. Ne faites pas l’erreur d’utiliser la valeur pKa de 38: c’est le pKa de l’ammoniac agissant comme un acide, et vous indique à quel point l’ion NH2-est basique (très basique!)
* Une note sur le pKa de l’eau: Le pKa de l’eau est de 14. Les textes de biochimie et de chimie organique énumèrent souvent la valeur comme 15,7. Ces textes ont incorrectement pris en compte la valeur molaire de la concentration d’eau dans la constante d’équilibre. La dérivation correcte de la constante d’équilibre implique l’activité de l’eau, qui a une valeur de 1.
Exemple
Bien que ce cours commence avec des groupes fonctionnels uniques, nous finirons par travailler avec des composés intéressants contenant plusieurs groupes fonctionnels. Reconnaître quels hydrogènes peuvent être ionisés sous forme de protons acides et quels hydrogènes ne peuvent PAS, est une compétence utile. Notez dans cet exemple que nous devons évaluer l’acidité potentielle à quatre endroits différents sur la molécule.
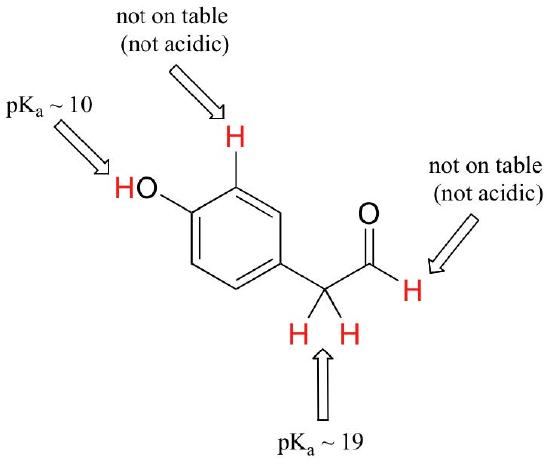
Les protons aldéhydes et aromatiques ne sont pas du tout acides (les valeurs de PK sont supérieures à 40 – pas sur notre table). Les deux protons sur le carbone à côté du carbonyle sont légèrement acides, avec des valeurs de pKa autour de 19-20 selon le tableau. Le proton le plus acide se trouve sur le groupe phénol, donc si le composé devait être soumis à un seul équivalent molaire de base forte, c’est le proton qui serait donné.
Acide &Environnements de base – Tout est Relatif en Réactivité
Parce que notre objectif est de comprendre la réactivité chimique dynamique, nous n’avons PAS besoin de connaître la quantité spécifique des formes protonées et non transformées d’un composé. Nous avons simplement besoin de savoir quelle forme est prédominante. Lorsque le pH de l’environnement est inférieur au pKa du composé, l’environnement est considéré comme acide et le composé existera principalement sous sa forme protonée. Lorsque le pH de l’environnement est supérieur au pKa du composé, l’environnement est considéré comme basique et le composé existera principalement sous sa forme déprotonée.
Par example, le pKa de l’acide acétique est d’environ 5. À un pH de 1, l’environnement est considéré comme acide et l’acide acétique existe principalement sous sa forme protonée. À pH 8, l’environnement est considéré comme basique et l’acide acétique se déprotone pour former de l’acétate (CH3CO2-). Inversement, le pKa du phénol est de 10. À pH 8, l’environnement est considéré comme acide pour le phénol et il reste principalement protoné.
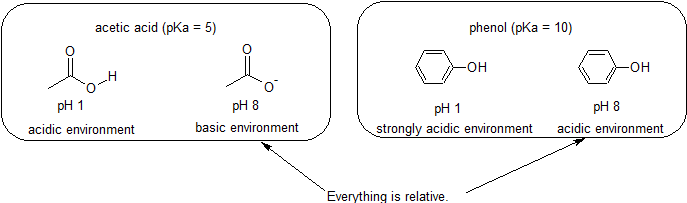
Il est également important de se rappeler que la chimie organique ne doit PAS nécessairement se produire dans l’eau, de sorte que les valeurs de pKa peuvent atteindre 50.
Exercice
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
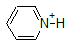 |
 |
 |
 |
 |
 |
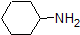 |
 |
 |
 |
 |
 |
 |
 |
 |
Leave a Reply