vertaamalla hapettimien ja Reduktanttien vahvuuksia
oppimistavoitteet
- tunnista, miten tarkastella standardinmukaisia Pelkistyspotentiaaleja elinkelpoisten pelkistävien ja hapettavien aineiden näkökulmasta REDOX-reaktioissa.
voimme mitata standardipotentiaaleja monille erilaisille kemiallisille aineille, joista osa on lueteltu taulukossa P2. Näiden tietojen avulla voidaan vertailla eri aineiden oksidatiivisia ja pelkistäviä vahvuuksia. Standardivetyelektrodin (SHE) puolireaktio sijaitsee yli taulukon \(\PageIndex{1}\) luettelon puolivälissä. Kaikki taulukossa SHE: n alapuolella olevat reaktantit ovat vahvempia hapettimia kuin H+, ja kaikki She: n yläpuolella olevat ovat heikompia. Taulukon vahvin hapetin on F2, jonka standardielektrodipotentiaali on 2,87 V. Tämä korkea arvo vastaa fluorin korkeaa elektronegatiivisuutta ja kertoo, että fluorilla on voimakkaampi taipumus hyväksyä elektroneja (se on vahvempi hapetin) kuin millään muulla alkuaineella.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g) + 2e−\(\rightleftharpoones\) 2F−(aq) | 2,87 |
kaikki hapettimet ja pelkistimet eivät synny tasavertaisina. Taulukon \(\PageIndex{1}\) vakiovähennyspotentiaalit voidaan tulkita aineiden paremmuusjärjestykseksi niiden hapettavan ja pelkistävän tehon mukaan. Vahvat hapettavat aineet ovat tyypillisesti yhdisteitä, joiden alkuaineet ovat korkeassa hapetustilassa tai joissa on korkea elektronegatiivisuus, jotka saavat elektroneja redox-reaktiossa (Kuva \(\PageIndex{1}\)). Esimerkkejä vahvoista hapettimista ovat vetyperoksidi, permanganaatti ja osmiumtetroksidi. Pelkistävät aineet ovat tyypillisesti elektropositiivisia alkuaineita, kuten vety, litium, natrium, rauta ja alumiini, jotka menettävät elektroneja redox-reaktioissa. Pelkistiminä orgaanisissa ja organometallisissa reaktioissa käytetään usein hydridejä (yhdisteitä, jotka sisältävät vetyä formaalissa -1 hapetustilassa), kuten natriumhydridiä, natriumborohydridiä ja litiumalumiinihydridiä.
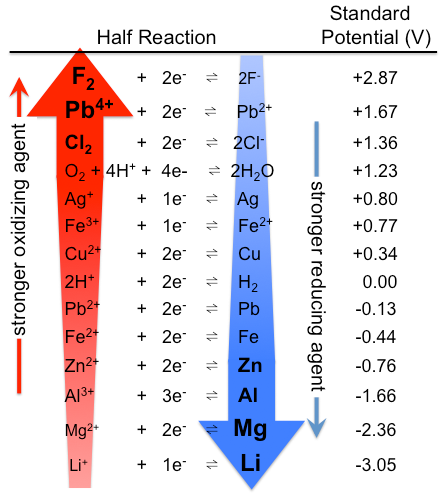
kuva \(\PageIndex{1}\): taulukko standardielektrodipotentiaaleista. Huomaa, että arvojärjestys on päinvastainen tässä, vahvojen hapettavien aineiden ollessa ylhäällä ja vahvojen pelkistävien aineiden ollessa alhaalla, kuin taulukossa \(\PageIndex{1}\). Aktuaaliset vakiopotentiaalit ovat tietenkin samat. (CC BY-SA 3.0; Tem5psu).
vastaavasti kaikki taulukon \(\PageIndex{1}\) lajit, jotka sijaitsevat H2: n yläpuolella, ovat voimakkaampia reduktantteja kuin H2, ja ne, jotka sijaitsevat H2: n alapuolella, ovat heikompia. Taulukon vahvin pelkistin on siis metallinen litium, jonka standardielektrodipotentiaali on -3,04 V. Tämä seikka saattaa olla yllättävä, koska cesium, ei litium, on vähiten elektronegatiivinen alkuaine. Näennäinen anomalia voidaan selittää sillä, että elektrodipotentiaalit mitataan vesiliuoksessa, jossa molekyylien väliset vuorovaikutukset ovat tärkeitä, kun taas ionisaatiopotentiaalit ja elektronien affiniteetit mitataan kaasufaasissa. Pienen kokonsa vuoksi Li + – ioni stabiloituu vesiliuoksessa voimakkailla sähköstaattisilla vuorovaikutuksilla vesimolekyylien negatiivisen dipolipään kanssa. Nämä yhteisvaikutukset aiheuttavat Li+: lle huomattavasti suuremman Δhydraation kuin CS+: lle. Litiummetalli onkin vesiliuoksessa alkalimetallien vahvin pelkistin (helpoimmin hapettava).
standardinmukaiset pelkistyspotentiaalit voidaan tulkita aineiden paremmuusjärjestykseksi niiden hapetus-ja pelkistystehon mukaan. Taulukon \(\PageIndex{1}\) lajit, jotka sijaitsevat H2: n yläpuolella, ovat voimakkaampia pelkistäviä aineita (helpommin hapettuvia) kuin H2. H2: n alapuolella sijaitsevat lajit ovat voimakkaampia hapettavia aineita.
koska taulukossa \(\PageIndex{1}\) esitetyt puolireaktiot on järjestetty E°-arvojensa mukaiseen järjestykseen, voidaan taulukon avulla nopeasti ennustaa eri hapettimien ja reduktanttien suhteelliset vahvuudet. Mikä tahansa puolireaktion vasemmalla puolella oleva laji hapettaa spontaanisti minkä tahansa toisen puolireaktion oikealla puolella olevan lajin, joka on sen alapuolella taulukossa. Vastaavasti mikä tahansa puolireaktion oikealla puolella oleva laji vähentää spontaanisti jonkin toisen puolireaktion vasemmalla puolella olevan lajin, joka on sen yläpuolella taulukossa. Näiden yleistysten avulla voidaan ennustaa monien erilaisten redox-reaktioiden spontaanisuutta (E°cell > 0), kuten esimerkissä \(\PageIndex{1}\).
esimerkki \(\PageIndex{1}\): Hopeasulfidi
hopeaesineille muodostuva mustatahrainen on ensisijaisesti Ag2S. puolireaktio, jolla tahraus tapahtuu, on seuraava:
- viitaten taulukkoon \(\PageIndex{1}\), ennustetaan, mitkä lajit—H2O2(aq), Zn(s), I−(aq), Sn2+(aq)—voivat pelkistää Ag2S: n Ag: ksi standardiolosuhteissa.
- näistä lajeista-H2O2(aq), Zn(s), I−(aq), Sn2+(aq), mikä on vahvin pelkistävä aine vesiliuoksessa ja siten paras ehdokas kaupalliseksi tuotteeksi.
- taulukon \(\PageIndex{1}\) tiedoista ehdottaa vaihtoehtoista pelkistintä, joka on helposti saatavilla, edullinen ja mahdollisesti tehokkaampi tahran poistamisessa.

annettu: pelkistyspuolireaktio, standardielektrodipotentiaali ja luettelo mahdollisista reduktanteista
pyydetty: Ag2S: n reduktantit, vahvin reduktantti ja potentiaalinen pelkistäjä tahran poistamiseksi
strategia:
A niiden asemista taulukossa \(\PageIndex{1}\), Päätä mikä laji voi vähentää Ag2S: ää. määritä, mikä laji on vahvin reduktantti.
B käytä taulukkoa \(\PageIndex{1}\) tunnistaaksesi Ag2S: lle pelkistimen, joka on yleinen kotitaloustuote.
ratkaisu
voimme ratkaista ongelman kahdella tavalla: (1) vertaa neljän mahdollisen reduktantin suhteellisia kantoja taulukossa \(\PageIndex{1}\) olevaan Ag2S/Ag-parin sijaintiin tai (2) vertaa kunkin lajin E°: TA Ag2S/Ag-parin E°: een (-0,69 V).
- a taulukon \(\PageIndex{1}\) lajit on järjestetty ylhäältä alas kasvavan pelkistysvoiman mukaiseen järjestykseen. Ongelman neljästä lajista I−(aq), Sn2+(aq) ja H2O2(aq) ovat Ag2S: n yläpuolella ja yksi sen alapuolella. Näin ollen voimme päätellä, että Zn(s) voi vähentää Ag2S(s): iä standardiolosuhteissa, kun taas I−(aq), Sn2+(aq) ja H2O2 (aq) eivät voi. SN2+(aq) ja H2O2(aq) esiintyvät taulukossa kahdesti: vasemmalla puolella (hapetin) toisessa puolireaktiossa ja oikealla puolella (reduktantti) toisessa.
- vahvin reduktantti on Zn(s), laji puolireaktion oikealla puolella, joka sijaitsee lähempänä taulukon \(\PageIndex{1}\) pohjaa kuin puolireaktiot, joihin kuuluvat I-(aq), Sn2+(Aq) ja H2O2(aq). (Kaupallisia tuotteita, joissa käytetään sinkkipalaa, markkinoidaan usein ”ihmetuotteena”, jolla poistetaan tahnaa hopeasta. Sähkönjohtavuuteen tarvitaan vain lämmintä vettä ja suolaa.)
- b taulukossa \(\PageIndex{1}\) Zn (s) alapuolella olevista reduktanteista, jotka ovat siis vahvempia reduktantteja, on yleisesti saatavilla vain yksi kotitaloustuotteista: Al(s), jota myydään alumiinifoliona elintarvikkeiden käärimiseen.
esimerkki \(\PageIndex{2}\):
käytä taulukon \(\PageIndex{1}\) tietoja määrittääksesi, tapahtuuko kukin reaktio spontaanisti standardiolosuhteissa:
- Sn(s) + Be2+(aq) → Sn2+(aq) + Be(s)
- MnO2(s) + H2O2(aq) + 2h+(aq) → O2(g) + MN2+(Aq) + 2H2O(l)
annettu: redox-reaktio ja luettelo standardielektrodipotentiaaleista (taulukko P2 )
kysytty: reaktion spontaanisuus
strategia:
- tunnista kunkin yhtälön Puolireaktiot. Määritä taulukon \(\PageIndex{1}\) avulla puolireaktioiden vakiopotentiaalit sopivaan suuntaan.
- käytä \(E_{cell}=e^o_{srp}(katodi) – E^o_{srp}(anodi)\) – yhtälöä laskeaksesi standardisolupotentiaalin kokonaisreaktiolle. Tästä arvosta määritetään, onko kokonaisreaktio spontaani.
liuos
- metallinen Tina hapettuu Sn2+: ksi(aq) ja Be2+(aq) pelkistyy alkuaineberylliumiksi. Voimme löytää standardielektrodipotentiaalit jälkimmäiselle (pelkistys) puolireaktiolle (-1.85 V) ja entiselle (hapettumisen) puolireaktiolle (-0,14 V) suoraan taulukosta \(\PageIndex{1}\).
B lisäämällä kaksi puolireaktiota saadaan kokonaisreaktio:
|
\(\textrm{katodi:} \; \mathrm{Be^{2+}(Aq)} +\mathrm{2e^ -} \rightarrow \mathrm{be(S)}\) \(\textrm{anodi:} \; \mathrm{Sn(s) \rightarrow \mathrm{Sn^{2+}}(s)} +\mathrm{2E^ -}\) \(\textrm{yhteensä:} \; \mathrm{Sn(s)+ \mathrm{Be^{2+}(aq)} \rightarrow \mathrm{Sn^{2+}}(aq)} + \mathrm{Be(S)}\) |
\(e^\circ_{\textrm{katodi}}}=\textrm{-1.99 V} \ \ e^\circ_{\textrm{anode}}=\textrm{-0.14 v} \ \ e^\Circ_{\textrm{cell}}=e^\circ_{\textrm{katodi}}-e^\circ_{\textrm{Anode}} \ \ \hspace{5mm} =- \textrm{1.85 V}\) |
vakiosolupotentiaali on melko negatiivinen, joten reaktio ei tapahdu spontaanisti kuten kirjoitettu. Toisin sanoen metallinen tina ei voi pelkistää Be2+: ta berylliummetalliksi vakio-olosuhteissa. Sen sijaan käänteinen prosessi, stannous-ionien (Sn2+) pelkistyminen metallisella berylliumilla, jolla on positiivinen arvo E° – solussa, tapahtuu spontaanisti.
- a MnO2 on hapetin (Mn4+ pelkistyy MN2+: ksi), kun taas H2O2 on reduktantti (O2− hapetetaan O2: ksi). Voimme saada standardielektrodipotentiaalit pelkistys-ja hapetuspuolireaktioille suoraan taulukosta \(\PageIndex{1}\) .
B kaksi puolireaktiota ja niitä vastaavat potentiaalit ovat seuraavat:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ e^\circ_{\textrm{anode}}=\textrm{0.70 V} \\ e^\circ_{\textrm{cell}}=e^\circ_{\textrm{katodi}}-e^\circ_{\textrm{anode}} \\ \hspace{5mm} =-\textrm{0.53 V}\) |
reaktion standardipotentiaali on positiivinen, mikä viittaa siihen, että standardiolosuhteissa se tapahtuu spontaanisti kirjoitettuna. Vetyperoksidi pelkistää MnO2: ta ja liuoksesta kehittyy happikaasua.
harjoitus \(\PageIndex{2}\)
käytä taulukon \(\PageIndex{1}\) tietoja selvittääksesi, onko jokainen reaktio todennäköisesti spontaanisti standardiolosuhteissa:
- 2ce4+(aq) + 2cl−(aq) → 2ce3+(aq) + Cl2(g)
- 4mno2(s) + 3O2(g) + 4oh−(aq) → 4mno4−(Aq) + 2H2O
vastaus
- spontaani (E°Cell = 0, 36 V)
- nonspontaaninen (E°Cell = -0.20 V)
vaikka E° – solun merkki kertoo, tapahtuuko tietty redox-reaktio spontaanisti standardiolosuhteissa, se ei kerro, missä määrin reaktio etenee, eikä se kerro, mitä tapahtuu epätyypillisissä olosuhteissa. Näihin kysymyksiin vastaaminen vaatii kvantitatiivisempaa ymmärrystä sähkökemiallisen kennopotentiaalin ja kemiallisen termodynamiikan välisestä suhteesta.
Yhteenveto
eri hapettimien ja reduktanttien suhteelliset vahvuudet voidaan ennustaa e° – arvojen avulla. Eri aineiden oksidatiivisia ja pelkistäviä vahvuuksia voidaan verrata standardielektrodipotentiaalien avulla. Näennäiset poikkeavuudet voidaan selittää sillä, että elektrodipotentiaalit mitataan vesiliuoksessa, mikä mahdollistaa voimakkaat intermolekulaariset sähköstaattiset vuorovaikutukset, eikä kaasufaasissa.
käsitteelliset ongelmat
- elektrodipotentiaalien järjestystä ei aina voida ennustaa ionisaatiopotentiaalien ja elektronien affiniteettien avulla. Miksi? Odotatko, että natriummetallilla on suurempi tai pienempi elektrodipotentiaali kuin sen ionisoitumispotentiaali ennustaa? Mikä on sen likimääräinen elektrodipotentiaali?
- viittaamatta taulukoituihin tietoihin Br2/Br−, Ca2+/Ca, O2/OH− ja Al3+ / Al, kummalla oletat olevan vähiten negatiivinen elektrodipotentiaali ja kummalla eniten negatiivinen? Miksi?
- koska munanvalkuaisissa on rikkipitoisia aminohappoja, hopeahaarukalla kananmunien syöminen tahraa haarukan. Kemistinä kaapissasi on kaikenlaisia mielenkiintoisia puhdistusaineita, mukaan lukien 1 M oksaalihappoliuos (H2C2O4). Valitsisitko tämän ratkaisun puhdistaaksesi haarukan, jonka olet tahriintunut munakokkelin syömisestä?
- reaktion Cu2+(aq) + 2e− → CU(s) elektrodipotentiaali on standardiolosuhteissa 0,34 V. Onko CU: n 0,5 mol: n hapettumispotentiaali yhtä suuri kuin -0,34/2 V? Selitä vastauksesi.
- Katso taulukkoa \(\PageIndex{1}\) ennustaaksesi
- mitkä lajit—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) ja / tai H2O2(aq)—voivat normaaliolosuhteissa hapettaa Mno4: ksi(s).
- mikä laji—Sn4+(aq), Cl−(aq), AG+(aq), Cr3+(aq) ja / tai H2O2(aq)—on vesiliuoksen vahvin hapettava aine.
käsitteellinen vastaus
- Ei; E° = -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply